Проблема рубца на матке после оперативного родоразрешения в последние годы становится все более обсуждаемым вопросом, что связано с неуклонным многофакторным увеличением частоты кесарева сечения [1]. В связи с этим особенно усилился интерес к отдаленным последствиям оперативного родоразрешения, таким как: толщина остаточного миометрия (residual myometrial thickness, RMT) и образование ниши в области рубца [2, 3]. Наличие ниши и небольшой толщины остаточного миометрия связано со значительным риском развития гинекологических осложнений, таких как: аномальные маточные кровотечения, дисменорея, постменструальные кровянистые выделения, тазовые боли, бесплодие, а также большая вероятность осложнений при последующих беременностях: разрыв (расхождение рубца) на матке, предлежание и/или врастание плаценты [3, 4], внематочная беременность в рубце после кесарева сечения, угроза выкидыша и/или преждевременных родов [5]. До настоящего момента метропластика являлась методом коррекции ниши в области рубца на матке, проводимая для потенциального снижения частоты перечисленных выше осложнений, однако эффективность проводимых повторных оперативных вмешательств на матке все еще нуждается в дополнительных исследованиях [6, 7].
Актуальной темой на сегодняшний день для практического здравоохранения является разработка методик, предотвращающих развитие дефектов миометрия в области рубца [8]. Особую необходимость поиска эффективных комплексных подходов к решению проблемы ускорения регенерации тканей обуславливает, наблюдаемый во всем мире, экспоненциальный рост частоты случаев врастания плаценты в рубец на матке, при которых происходит образование маточной грыжи, полное истончение миометрия в области рубца на матке с врастанием плаценты в близлежащие органы и ткани, а также с образованием неоангиогенеза между маткой и мочевым пузырем [9, 10].
Одним из последних новых методов регенерации миометрия после кесарева сечения является инъекционное введение аутологичной плазмы, обогащенной тромбоцитами (Platelet-rich plasma (PRP) в зону формирования рубца [11]. PRP производится из свежей цельной крови, эксфузию которой производят из периферической вены за 10–15 минут до операции, хранится в антикоагулянтном растворе кислотно-цитратной декстрозы во время транспортировки до центрифуги. Далее производится двухэтапное центрифугирование в ротационной угловой центрифуге и выделение готовой PRP (рис. 1).
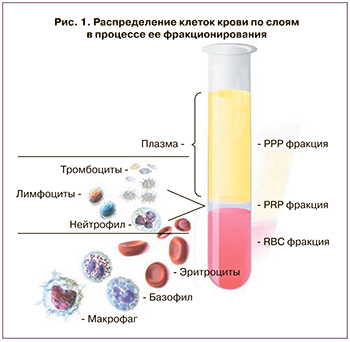
При введении в область раны, тромбоциты активируются, и происходит их агрегация для высвобождения гранул, содержащих факторы роста: сосудистого эндотелиального фактора роста, трансформирующего фактора роста, фактора роста тромбоцитов и эпидермального фактора роста, которые регулируют миграцию клеток, их прикрепление, пролиферацию, дифференциацию и способствуют накоплению внеклеточного матрикса [12]. В настоящее время PRP широко используется в различных направлениях медицины, таких как ортопедия, офтальмология и хирургия для лечения ран и улучшения регенерации тканей.
В анализируемой литературе была выявлена эффективность PRP при хирургических вмешательствах в гинекологии и акушерстве; лечении пациенток с бесплодием, обусловленным «тонким» эндометрием и улучшении качества заживления рубцов на матке и коже после кесарева сечения [12, 13]. Исследований по влиянию PRP на регенерацию миометрия после метропластики при врастании плаценты до настоящего времени в мире не проводили.
Целью нашего исследования является оценка влияния применения инъекционного введения плазмы, обогащенной тромбоцитами (PRP) на формирование рубца на матке после метропластики у пациенток с врастанием плаценты.
Материалы и методы
На начальном этапе работы был проведен расчет необходимого объема выборки и определена статистическая мощность исследования. Для определения необходимого объема выборки были сделаны следующие расчеты: при предполагаемой частоте формирования ниши в области рубца у пациенток контрольной группы равной 60% и ожидаемом двухкратном снижении частоты формирования ниши у пациенток с PRP (интервенционная группа) для значений альфа-риска 5% и бета-риска 20% (статистическая мощность исследования составила 80%), был определен необходимый минимальный общий объем выборки равный 84 пациентам: по 42 женщины в основной и контрольной группах. С учетом ожидаемого выхода из исследования было рекрутировано 156 беременных.
Согласно проведенному расчету необходимого объема выборки, в слепое рандомизированное клиническое испытание, выполненное на базе ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им акад. В.И. Кулакова» Минздрава России с 2020 по 2022 гг., было включено 156 пациенток. Из них исключены из исследования на первом этапе 40 женщин: 35 не соответствовали критериям включения и 5 отказались от участия.
Критериями включения в исследование были: возраст пациенток 18–45 лет, рубец на матке после предыдущего кесарева сечения, врастание плаценты, выявленное при ультразвуковом исследовании (УЗИ) и магнитно-резонансной томографии, информированное согласие на участие в исследовании.
К критериям невключения в исследование относили: тяжелые экстрагенитальные заболевания матери, острые инфекционные заболевания или обострение хронических, миому матки больших размеров/множественную миому матки, онкологические заболевания в настоящее время или в анамнезе, отсутствие согласия пациентки. Для забора крови и получения положительного эффекта от PRP значимыми критериями не включения выступали: сифилис, ВИЧ, гепатиты В и С, системные заболевания крови и коагулопатии, гемоглобин менее 100 г/л, тромбоциты менее 100×109/л, аномалии и дисфункции тромбоцитов, прием нестероидных противовоспалительных препаратов, антикоагулянтная и антиагрегантная терапия.
Критерии исключения из исследования: перевязка маточных труб, отсутствие возможности вернуться в Центр для прохождения экспертного УЗИ, желание пациентки добровольно прекратить участие в исследовании.
В качестве проверяемой гипотезы была выбрана гипотеза превосходства. В качестве первичных изучаемых исходов были определены процент образования ниш и толщина остаточного миометрия. В качестве вторичных изучаемых исходов были определены индексы резистентности сосудов матки через 12 недель после операции. Для генерации случайной последовательности распределения пациенток был использован метод непрозрачных запечатанных и последовательно пронумерованных конвертов Заблаговременно были приготовлены 116 (по 58 для каждой группы) непрозрачных конвертов, в которых было указана схема (с терапией PRP и без применения интраоперационного введения PRP). Для уменьшения систематической ошибки использован метод «ослепления»: врач ультразвуковой диагностики не был осведомлен о методе терапии. Все пациентки были информированы о цели и задачах данной работы, этапах его проведения, дальнейшего мониторинга и дали согласие в его участии.
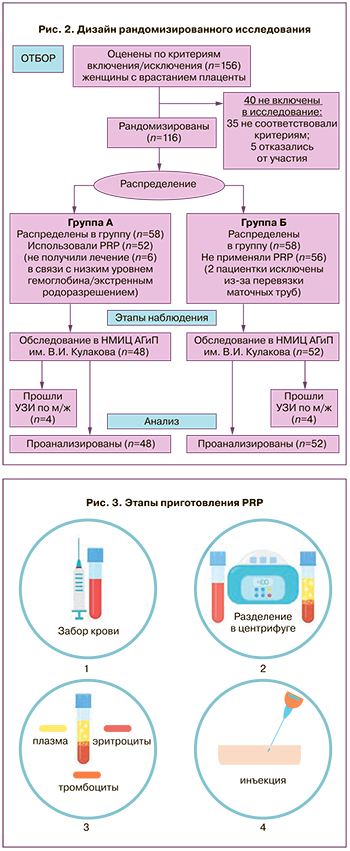
Все обследованные женщины после прохождения отбора по критериям включения (n=100) были разделены на две группы: основную (n=48) составили пациентки, которым после органосохраняющей операции и метропластики при врастании плаценты была введена PRP и группу сравнения (n=52) без введения PRP в область рубца. Из основной группы 4 пациентки были исключены из исследования в связи с низким уровнем гемоглобина и 2 – в связи с экстренным родоразрешением, а из контрольной группы – 2 женщины из-за выполнения перевязки маточных труб после родоразрешения. Также по 4 пациентки из каждой группы выбыли из исследования в связи с прохождением УЗИ после метропластики по месту жительства (рис. 2).
Нами проведен анализ клинических, анамнестических данных, результатов инструментальных и лабораторных исследований. Оценивали такие показатели, как возраст матери, предшествующие операции на матке, информацию о предыдущих беременностях (число, предшествующих операций кесарева сечения), объем кровопотери, длительность операции [14]. Всем пациенткам с подозрением на врастание плаценты проводилось оперативное лечение в объеме срединной лапаротомии, донного кесарева сечения, комплексного компрессионного гемостаза, баллонной тампонады матки, метропластики. После зашивания разреза на матке участницам группы вмешательства вводили PRP, выделенную из крови пациенток, в область разреза (как с верхней, так и с нижней стороны гистеротомии между децидуальной тканью и миометрием), в то время как контрольная группа не получала PRP.
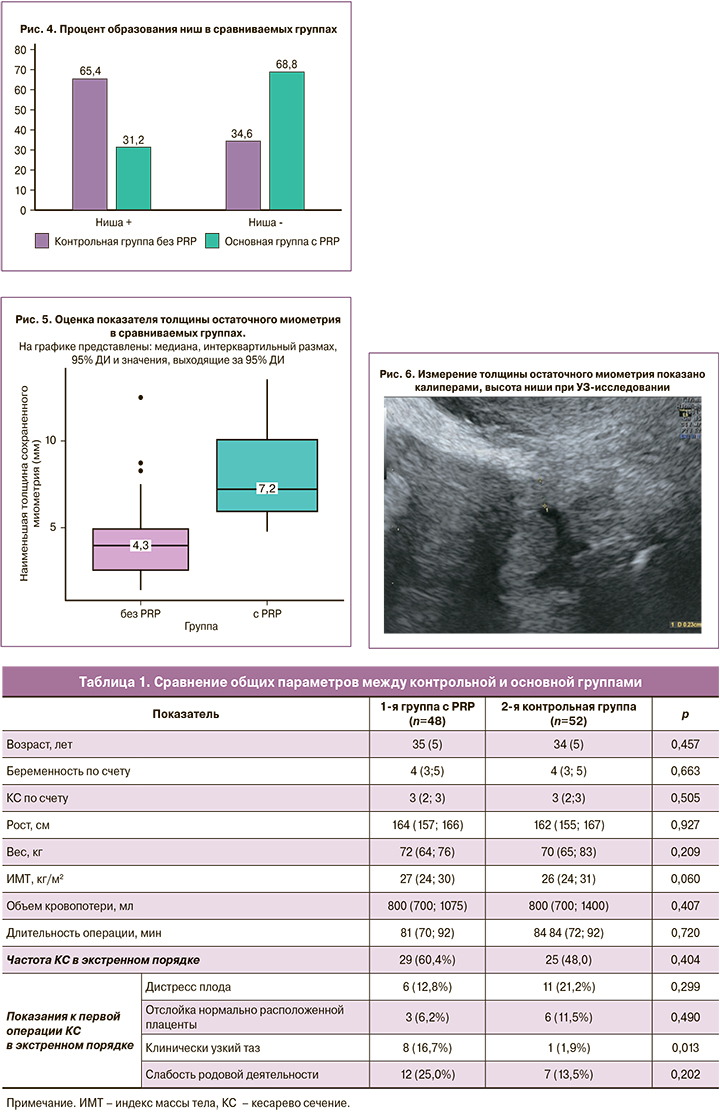
Для приготовления PRP выполняли эксфузию венозной крови за 10–15 минут до начала операции объемом 13,5 мл в шприц с 1,5 мл антикоагулянта (общий объем 15 мл). Далее кровь с цитратом переливали в пробирку в форме песочных часов и центрифугировали в течение 5–7 минут при 3500 оборотах в минуту. В результате центрифугирования получали около 3–4 мл PRP. В контрольной группе область метропластики оставалась без инъекционного введения PRP (рис. 3).
Далее, апоневроз, подкожно-жировая клетчатка и кожа были восстановлены одинаковым образом в двух группах. Все операции были выполнены одной бригадой акушеров. Для максимального увеличения объективности ультразвуковой оценки состояния рубца на матке (через 12 недель после операции) специалист, проводивший исследование, не был осведомлен, к какой группе относилась пациентка.
Научно доказано, что при концентрации тромбоцитов, превышающей первоначальные значения более чем в 4 раза, начинает проявляться стимулирующий эффект обогащенной плазмы. Для подтверждения эффективности PRP в клинико-диагностической лаборатории Центра производили подсчет количества тромбоцитов в PRP на гематологическом анализаторе Sysmex XP-350, что составило 765–2738 10*9/л, данные результаты совпадали и даже были несколько выше результатов зарубежных исследований [15].
УЗИ проводились на системах экспертного класса Voluson S6 Expert (GE Healthcare, Австрия) и Samsung Medison WS80A (Samsung Medison, Южная Корея) с использованием 3D/4D трансвагинального конвексного мультичасточного (2–8 MHz) и 3D/4D внутриполостного мультичастотного (5–13 MHz) датчиков. Через 12 недель после операции проводилось трансвагинальное УЗИ рубца на матке и ультразвуковая допплерография кровотоков в маточных артериях. Исследование зоны рубца на матке выполняли согласно ранее описанным критериям в Дельфийском протоколе 2019 г., где консенсусом были утверждены следующие понятия [16]:
1) «ниша» – идентифицированный в области рубца после кесарева сечения дефект миометрия глубиной не менее 2 мм;
2) «ответвление ниши» – идентифицированная более узкая часть главной ниши, распространяющаяся по направлению к серозной оболочке и имеющая ширину меньшую, чем основная ниша.
В соответствии с наличием ответвлений выделяют 3 подкласса ниш: 1 – простая ниша; 2 – простая ниша с одним ответвлением; 3 – комплексная ниша, имеющая более одного ответвления [8, 16].
Основные параметры, используемые для ультразвуковой оценки области рубца на матке: RMT в области рубца, толщина прилегающего миометрия (adjacent myometrial thickness, AMT) и, вычисляемый, как отношение толщины остаточного миометрия к толщине прилегающего миометрия, «коэффициент заживления» (RMT/AMT), а также параметры ниши. Точное измерение и стандартизированное описание ниши в ультразвуковом протоколе являются принципиально важными для клинической оценки гинекологических симптомов, планирования хирургического лечения и последующих беременностей.
Дополнительно в исследовании проводили ультразвуковую допплерографию, определяя индекс резистентности сосудов матки (левой и правой маточной артерии, радиальных артерий в области рубца на матке и области задней стенки матки).
Статистический анализ
Статистический анализ проводился с использованием программы StatTech v. 2.8.8 (ООО «Статтех», Россия).
Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Колмогорова–Смирнова. Количественные показатели, имеющие нормальное распределение, описывались с помощью средних арифметических величин (M) и стандартных отклонений (SD), границ 95% доверительного интервала (95% ДИ). В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1; Q3). Для проверки равенства дисперсий перед применением параметрических методов статистики использовали критерий Фишера. Сравнение двух групп по количественному показателю, имеющему нормальное распределение, при условии равенства дисперсий выполнялось с помощью t-критерия Стьюдента. В качестве меры эффекта использовали разницу средних (РС) значений с 95% доверительным интервалом. Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна–Уитни. В качестве меры эффекта использовали разницу медиан (РМ) с 95% доверительным интервалом. Качественные показатели описывались с помощью абсолютных значений и %. Для сравнения двух групп по качественному показателю использовали точный тест Фишера. В качестве меры эффекта использовали отношение рисков (ОР) с 95% доверительным интервалом. Различия считали статистически значимыми при p<0,05.
Результаты
Средний возраст исследуемой популяции составил 34 (5) лет и подавляющее большинство пациенток были повторнородящими. Исследуемая популяция пациенток была однородна, у них не было выявлено существенных различий с точки зрения возраста, веса, роста, паритета, степени инвазии плаценты и индекса массы тела (табл. 1). При первом оперативном родоразрешении частота кесарева сечения по экстренным показаниям составила 28/48 (58,3%) в группе 1 и 29/52 (55,8%) – в группе 2. Из них наиболее часто встречались: дистресс плода в родах, за которым следовала отслойка нормально расположенной плаценты, клинически узкий таз и слабость родовой деятельности (табл. 1).
В данном исследовании все операции проведены с применением техники турникетного гемостаза, одной бригадой хирургов по четко отработанной схеме этапов операции. После выполненных операций проводили УЗИ через 12 недель; ниша в области рубца на матке была выявлена у 49% женщин. Из общего числа случаев с нишами 15/48 (31,2%) и 34/52 (65,4%) были в группах, получавших PRP, и в контрольной группе, соответственно (p<0,001) (рис. 4).
Статистически значимо выше была отмечена RMT в интервенционной и контрольной группах – 7,2 (6; 10) и 4,3 (3; 5) мм соответственно (р<0,001) (рис. 5, 6).
Сравнивая две группы по AMT, нам не удалось выявить значимых различий (p=0,143). При анализе показателей параметров ниши были получены следующие результаты: наибольшая ширина ниши составила 7 и 11 мм (p<0,001), наибольшая глубина – 6 и 8 мм (p=0,018) и наибольшая длина – 11 и 13 (p=0,101) мм в основной и контрольной группах, соответственно. Объем ниши в интервенционной группе был достоверно меньше – 459 против 983 мм3 в группе контроля (p<0,001). Параметры миометрия в области рубца на матке после метропластики представлены в таблице 2.
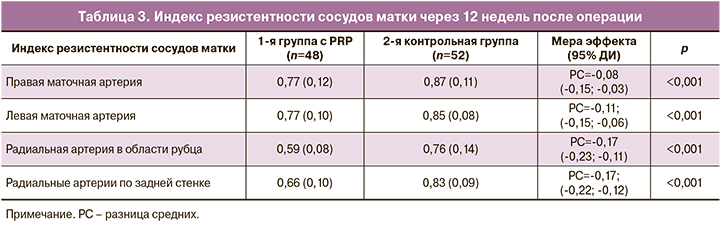
Анализируя показатели кровотока при допплерометрии (рис. 7) через 12 месяцев после оперативного родоразрешения и метропластики при врастании плаценты, мы выявили меньшие значения индексов резистентности в правой маточной артерии, в левой маточной артерии, в радиальной артерии области рубца и радиальной артерии по задней стенке матки, в сравнении с аналогичными показателями группы без применения PRP (табл. 3).
Осложнения, связанные с деформацией рубца на матке после кесарева сечения, побудили ученых углубиться в эту проблему и изучить данную область шире [17]. В последнее время в некоторых исследованиях особое внимание уделялось образованию ниш или тонкого остаточного миометрия в области рубца [18]. Техника операции: зашивание матки (однослойным или двухслойным швом), шовный материал – являются одними из важных факторов, определяющих заживление рубца и возникновения последующих осложнений [19, 20]. Еще более актуальной и малоизученной проблемой является образование ниш после метропластики, когда иссекается большой участок миометрия и, естественно, сопоставление тканей и их регенерация значительно снижается.
На протяжении многих лет PRP рассматривалась в качестве безопасной терапии и заживления тканей. PRP состоит из факторов роста, цитокинов, хемокинов и фибринового каркаса, что в свою очередь стимулирует заживление ран. Тот факт, что тромбоциты секретируют факторы роста и активные метаболиты, означает, что их прикладное использование может иметь положительное влияние в клинических ситуациях, требующих быстрого эффекта и регенерации ткани [21].
В эпоху стремительного развития регенеративной медицины, применение PRP-технологии в акушерской практике стало особенно актуальным. Результаты нашей работы в значительной степени совпадают с похожей работой рандомизированного двойного плацебо-контролируемого исследования, опубликованного Chaichian S. et al. (2021), где частота формирования состоятельного рубца после кесарева сечения в группе, получившей терапию препаратами PRP, была статистически значимо больше, чем у женщин из контрольной группы. В исследуемой когорте пациентов проводили интрамиометральное введение PRP после зашивания разреза на матке [21, 22].
Несмотря на несколько публикаций о влиянии PRP на регенерацию миометрия после кесарева сечения, целостность рубца и RMT после метропластики при врастании плаценты не исследовали ни в одной работе. В настоящем исследовании мы оценили эффективность и безопасность PRP в отношении целостности и толщины рубца на матке. Наши результаты показали благоприятное влияние инъекционного введения PRP в область рубца на матке после метропластики на целостность и толщину рубца. В группе вмешательства было зарегистрировано меньшее количество ниш с меньшим количеством осложнений и большей RMT, по сравнению с контрольной группой. В настоящем исследовании образование ниш в группе, получавшей PRP, составило почти одну треть от контрольной группы, и это различие было статистически значимым. Не было зарегистрировано никаких побочных эффектов от инъекции PRP в исследуемой популяции [23].
Эти результаты согласуются с результатами предыдущих исследований, предполагающих положительное влияние инъекционного введения PRP в качестве эффективного терапевтического метода для улучшения заживления ран при гинекологических операциях, из-за его способности стимулировать ангиогенез и инициировать воспалительные реакции [12, 21]. Тем не менее, по мнению авторов, ни в одном исследовании не оценивали эффективность PRP при рубцах на матке после метропластики при врастании плаценты, которую можно было бы сравнить с нашим исследованием. Следовательно, этот вопрос требует проведения в будущем новых хорошо спланированных, рандомизированных контролируемых исследований.
Заключение
Проведенное в «НМИЦ АГП им. В.И. Кулакова» рандомизированное исследование по применению PRP технологии, доказало высокую эффективность и безопасность метода по сравнению с отсутствием использования данной технологии. Впервые примененный метод введения PRP после метропластики при врастании плаценты позволяет точечно воздействовать на область миометрия, позволяя добиться улучшения процессов регенерации, качественного заживление рубца, что обусловлено развитием ангиогенеза и пролиферацией клеток под воздействием факторов роста. Полученные нами результаты – более низкие значения индексов резистентности кровотока в сосудах матки, особенно в области рубца, свидетельствуют об эффективном процессе васкуляризации и регенерации в области рубца на матке после метропластики при использовании PRP.
Результаты этого пилотного исследования подтвердили эффективность PRP как перспективного и безопасного средства для профилактики образования ниш и несостоятельности рубца. Поэтому инъекционное введение PRP может использоваться в качестве потенциальной профилактической меры и быть включено в рутинную практику акушеров-гинекологов. Необходимы дальнейшие исследования для подтверждения эффективности PRP в различных условиях.



