Эндометриоз поражает до 15% женщин репродуктивного возраста [1, 2]. Наиболее частыми локализациями очагов эндометрий-подобной ткани (эпителиальный и стромальный компонент) являются брюшина и тазовые органы, а также яичники [3]. Очаги эндометриоза обладают признаками, свойственными раку яичников, такими как мультифокальность, генетическая нестабильность, повышенная пролиферативная активность, способность к инвазии в окружающие ткани. Промежуточным этапом в процессе трансформации эндометриоза в рак является атипический эндометриоз, гистологически характеризующийся гиперклеточностью, увеличенными ядрами, а также признаками плеоморфизма [4].
Рассматривать данную нозологию в аспекте онкологической настороженности позволяют данные о развитии эндометриоз-ассоциированных новообразований (ЭАН) яичников. Развитие опухолей яичника, патогенетически связанных с очагами эндометриоза, является редким, но весьма значимым осложнением. В одном из исследований было показано, что более чем в 19% случаях рак яичников ассоциирован с эндометриозом [5], результаты исследования L. Saraswat и соавт., в свою очередь, также подтвердили повышенный риск развития рака яичников у женщин с наружным генитальным эндометриозом [6].
ЭАН яичников чаще всего поражают женщин репродуктивного возраста и включают как доброкачественные, так и пограничные, и злокачественные опухоли [7]. Также необходимо отметить, что присутствие первично-множественных злокачественных новообразований чаще встречается у пациентов с эндометриоз-ассоциированным раком [8]. Однако на момент выявления большинство опухолей являются локализованными (ограничены тканью яичника, 1-я стадия) и поэтому характеризуются благоприятным прогнозом в целом [9].
Наиболее распространенными ЭАН среди злокачественных опухолей являются эндометриоидный и светлоклеточный рак. Довольно редко встречаются пограничные эндометриоидные и светлоклеточные опухоли. В нашей статье мы наиболее подробно рассмотрим серомуцинозные опухоли (СМО) – наименее изученную группу эпителиальных опухолей, на которую приходится около 15% в группе всех опухолей яичников промежуточной степени злокачественности [9].
СМО – это группа эпителиальных новообразований, для которых характерно сочетание нескольких видов клеток, в связи с чем в литературе встречается аббревиатура ММ/МЕ (Müllerian mucinous/mixed epithelial) – опухоли смешанного строения [1]. Категория серомуцинозных овариальных новообразований была впервые включена в классификацию опухолей женской половой системы в 2014 году [1, 10, 11]. Однако предпосылки к этому формировались давно, в частности в 1976 году Fox и Langley предложили обозначать этим термином образования яичников, состоящие из эндоцервикального и серозного эпителия [12]. Позднее другие авторы сообщили о пограничных цистаденомах яичников, сочетающих различные типы эпителия [10, 11]. Kurman и соавт. описали серомуцинозную карциному, которая по гистологическому строению была аналогична пограничной СМО, но отличалась наличием стромальной инвазии в виде «сливающихся» желез [13]. На сегодняшний день СМО объединяет новообразования смешанного типа, представленные несколькими видами эпителия, имеющих происхождение из остатков Мюллерова протока – серозным, эндоцервикальным, переходноклеточным и плоским (преобладает), при этом второй по представительности компонент должен занимать не менее 10% объема опухоли [1].
СМО подразделяются на доброкачественные, пограничные и злокачественные по аналогии с остальными нозологическими подгруппами эпителиальных опухолей (табл. 1).
По данным разных авторов, СМО ассоциированы с эндометриозом в 30–50% случаев. Доброкачественные СМО составляют не более 1% опухолей яичника и характеризуются благоприятным прогнозом [2].
Развитие пограничных СМО до определенного времени бывает сложно диагностировать, поскольку появившаяся клеточная атипия может быть замаскирована сосочковым строением [10]. Пограничные СМО ранее относились к эндоцервикальному варианту пограничных муцинозных опухолей яичника. В настоящее время они вместе с эндометриоидными и светлоклеточными карциномами составляют группу опухолей, патогенетически связанных с очагами эндометриоза [13].
Возникновение данных опухолей ассоциируют с соматической мутацией гена-супрессора опухолевого роста ARID1A (AT rich interactive domain 1A), кодирующего белок BAF250a комплекса SWI-SNF-A, участвующего в ремоделировании хроматина [14]. При взаимодействии с р53 ARID1A подавляет клеточную пролиферацию посредством р53-зависимой транскрипционной регуляции некоторых опухолевых супрессоров. Инактивирующие мутации ARID1A и p53 являются функциональными синонимами, поскольку любая из них упраздняет транскрипцию таргетных опухолевых супрессоров и приводит к бесконтрольной клеточной пролиферации в овариальных неоплазиях, развитие которых связанно с эндометриозом. В качестве причин мутации рассматривают специфическое микроокружение эпителия эндометриоидных кист, богатое свободными радикалами кислорода (результат окисления железа). Доказано, что инактивация гена в связи с его соматической мутацией является ранним молекулярным событием, предшествующим опухолевой прогрессии эндометриоидных кист в агрессивный светлоклеточный или эндометриоидный рак яичников. Это событие – один из ранних этапов канцерогенеза и развития опухолей из очагов эндометриоза, вероятно, обозначающее новый генетический паттерн опухолей яичника. Мутации ARID1A были обнаружены в 41–57% случаях при светлоклеточной карциномой яичниках, в 30–48% при эндометриоидном раке, приблизительно в 40% случаях при эндометриозе и у 15–20% пациентов с доброкачественной эндометриоидной кистой. Wu и соавт. обнаружили потерю экспрессии гена ARID1A в трети серомуцинозных опухолей [15]. Молекулярно-генетические исследования, а также иммуногистохимические исследования показывают потерю экспрессии гена ARID1A в очагах эндометриоза, смежных к первичному очагу озлокачествления, при этом соматической мутации данного гена-онкосупрессора в остальных очагах эдометриоза обнаружено не было. Данный факт позволяет предположить, что источником опухолей яичников I типа является эдометриоз. В статье E. Nakamura и соавт. описывался случай обнаружения светлоклеточого рака и пограничной серомуцинозной опухоли яичников, возникших, как предполагается, из очагов эндометриоза. При этом ни в очагах эндометриоза, ни в пограничной серомуцинозной опухоли и светлоклеточной карциноме не было обнаружено мутации гена ARID1A [16].
Необходимо отметить, что наличие только одной мутации гена, отвечающего за канцерогенез, недостаточно для злокачественной трансформации эндометриоза. Другими генетическими мутациями, играющими большую роль в процессах канцерогенеза, являются мутации в генах PIK3CA, PPP2R1A, KRAS, CTNNB-1, PTEN, RUNX3, PTCH2, ERBB2, FOXM1B, FOLR1 и др. [9].
При описании морфологии пограничных СМО подчеркивается их сходство с пограничными серозными опухолями: возможно наличие участков микропапиллярного строения, интраэпителиальной карциномы; в 10–20% наблюдается стромальная микроинвазия, которая, однако, не влияет на прогноз. Однако для серомуцинозных пограничных опухолей характерны билатеральное поражение (20–30% случаев), стромальная нейтрофильная инфильтрация, подтверждение связи с эндометриозом и отсутствие перстневидных, нейроэндокринных и клеток Панета. При иммуногистохимическом исследовании наблюдается негативное окрашивания для выявления экспрессии маркеров CK20 и CDX2 [10, 11].
Серомуцинозные карциномы встречаются относительно редко, и их развитие часто ассоциировано с пограничными опухолями. Авторы раздела новой классификации ВОЗ ссылаются на единственную работу H. Shappell и соавт., в которой описано 7 серомуцинозных карцином, среди которых преобладали папиллярные опухоли с экспансивным типом инвазии [11]. Следует отметить, что авторы допускают классификацию смешанных опухолей по преобладающему компоненту, например: «Низкодифференцированная серозная карцинома яичника с эндометриоидной дифференцировкой».
В настоящей работе представлены морфологические и иммуногистохимические особенности доброкачественных, пограничных и злокачественных СМО у женщин репродуктивного возраста, в том числе беременных.
Материал и методы исследования
Материалом для настоящего исследования послужили гистологические препараты и парафиновые блоки 15 пациенток с СМО яичников, отобранные среди 1179 образцов овариальных опухолей, которые были в дальнейшем проанализированы в патологоанатомическом отделении НМИЦ АГП им. академика В.И. Кулакова в 2012–2016 гг. Гистологические препараты были повторно исследованы, из сохранившихся парафиновых блоков (часть из них была безвозвратно выдана пациенткам для консультации и дальнейшего наблюдения в онкологическом диспансере) были приготовлены дополнительные срезы и проведено иммуногистохимическое исследование с использованием биомаркеров эстрогеновых рецепторов (ER) (clone 1D5, DAKO), прогестероновых рецепторов (PR) (clone 636, DAKO) и маркера клеточной пролиферации ki-67 (30-9, VENTANA). Оценка экспрессии ki-67 проводилась с помощью подсчета позитивно окрашенных ядер на 3000 клеток, оценка экспрессии стероидных гормонов проводилась по формуле H-score=3a+2b+3c, где а – доля выраженно окрашенных ядер клеток, b – доля умеренно окрашенных, с – доля слабо окрашенных. При этом выраженная экспрессия отмечалась при значении H-score более 200 баллов. Ядерная экспрессия ER и PR считалась позитивной при наличии более 45% окрашенных клеток. Иммунореактивность ER, PR, а также пролиферативную активность эпителия серомуцинозных опухолей рассчитывали на основании числа ядер эпителия с экспрессией указанных биомаркеров на 100 клеток (при учете не менее 500 клеток) и выражали в процентах. Низкий уровень экспрессии соответствовал наличию 5–25% окрашенных клеток, промежуточный – 25–75% клеток, высокий – более 75% клеток.

Результаты исследования
Доброкачественные серомуцинозные опухоли обнаружены у 7 пациенток 29,8±6,3 года, у двух из них опухоль была двусторонней. Две пациентки во время оперативного пособия находились на сроках 37–38 и 15–16 недель гестации. Пограничные СМО диагностированы у 6 женщин 35,1±4,6 года, у всех – односторонние. Серомуцинозная карцинома обнаружена у 1 пациентки 31 года.
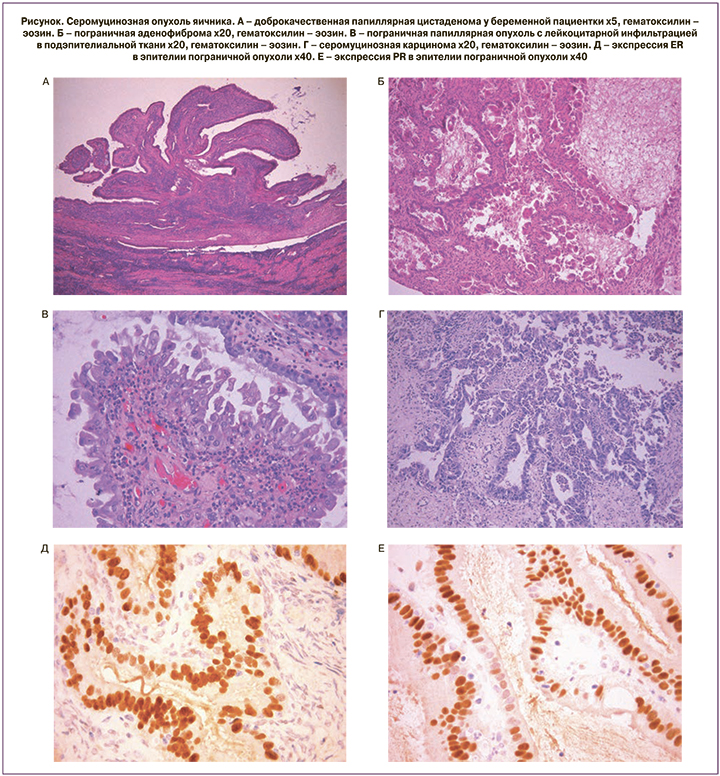
Доброкачественные опухоли представлены цистаденомами, диаметр которых у небеременных пациенток составил от 1,5 до 6 см, толщина стенки до 0,5 см. Новообразования характеризовались гладкой наружной поверхностью, внутренняя поверхность отличалась бархатистым видом, была покрыта слизью, у одной пациентки визуализировался темный налет, едва заметные папиллярные разрастания обнаружены у 1 женщины. У одной из беременных женщин опухоль была размером 13×15 см с папиллярными разрастаниями на внутренней поверхности высотой 0,2 см, расположенными на участке диаметром 0,5 см, у другой наблюдалась цистаденома размером 3×4 см с многочисленными отечными папиллярными разрастаниями на внутренней поверхности высотой до 0,8 см (рисунок А). При микроскопическом исследовании стенка характеризовалась овариальной тканью с фиброзными изменениями, местами с отеком, очагами обызвествления, выстилающий эпителий однорядный, в 1 наблюдении исключительно эндоцервикального типа, в остальных – эндоцервикального с участками серозного типа.
Пограничные опухоли представляли кистозные образования диаметром 2–8 см с вариабельным количеством папиллярных разрастаний на внутренней поверхности высотой 1–2 см. У одной пациентки папиллярные разрастания диаметром 0,4 см выявлены на наружной поверхности опухоли и спаяны с серозной поверхностью тела матки. При микроскопическом исследовании папиллярные разрастания были аналогичны сосочкам серозных пограничных новообразований, покровный эпителий одно- или многорядный эндоцервикального, серозного или светлоклеточного типа с легкой ядерной атипией, фиброзно-отечной стромой, также присутствовали изолированно расположенные комплексы атипических эпителиальных клеток. У одной пациентки 44 лет наблюдался очаг пограничной аденофибромы с многочисленными железами, расположенными неравномерно, окруженными фиброзной стромой, железистый эпителий преимущественно однорядный, уплощенный, вместе с тем определялись участки пролиферации эпителия и изолированно расположенные в просвете желез комплексы атипических эозинофильных клеток (рисунок Б). У четырех женщин в образцах опухоли наблюдалась лейкоцитарная инфильтрация (рисунок В), у одной из них в отдельных единичных мелких сосочках обнаружен некроз. Вне папиллярных разрастаний стенка опухоли имела сходство с доброкачественными серомуцинозными цистаденомами.
Серомуцинозная карцинома оказалась кистозной опухолью диаметром 4 см с папиллярными разрастаниями на внутренней поверхности диаметром 1,2 см, высотой 0,5 см. При морфологическом изучении папиллярные разрастания имели криброзное строение с небольшим числом «желез», вне папиллярных разрастаний в стенке также отмечалось формирование железоподобных структур из атипического эпителия, присутствовали участки, покрытые эндометриоидным эпителием с прилежащей эндометриальной стромой, что указывало на развитие карциномы на фоне эндометриоидной кисты. Эпителий, образующий карциному, отличался умеренным и тяжелым дискариозом, имел сходство с серозным, эндоцервикальным и эндометриальным эпителием. Выраженная лейкоцитарная инфильтрация наблюдалась на всем протяжении стенки новообразования (рисунок Г).
Эндометриоз, диагностированный у девяти женщин, сопровождал доброкачественные серомуцинозные цистаденомы (n=4), пограничные опухоли (n=4) и карциному (n=1). Все новообразования были доставлены во вскрытом виде, при этом в 1 доброкачественной цистаденоме и 2 пограничных опухолях, со слов хирургов, визуализировалось густое коричневатое содержимое. У одной из 4 пациенток с доброкачественными СМО определялись эндометриоидные гетеротопии в прилежащей овариальной ткани, у двух других установлено развитие опухоли на фоне эндометриоидной кисты, причем у одной из них наблюдался псевдодискариоз, представляющий реактивные изменения эпителия в виде его уплощения, появления увеличенного размера клеток с полиморфными, несколько гиперхромными ядрами, с равномерно распределенным хроматином, отсутствием митозов; четвертая женщина была беременна, у нее в стенке опухоли обнаружены децидуальные изменения. У четырех женщин с пограничными СМО и пациентки с серомуцинозной карциномой наблюдалось развитие новообразований на фоне эндометриоидных кист, у 2 из них установлен псевдодискариоз эндометриоидного эпителия, аналогичный вышеописанным изменениям в доброкачественных цистаденомах.
Иммунофенотип СМО характеризовался низкой экспрессией ki-67: от 1 до 15% (образцы серомуцинозной карциномы не были подвергнуты иммуногистохимическому исследованию), высокой позитивной иммунореактивностью ER: от 250 до 280 баллов (рисунок Д) и PR (рисунок Е).
Всем пациенткам с пограничными опухолями было выполнено срочное интраоперационное гистологическое исследование, по данным которого была выполнена операция в объеме аднексэктомии на стороне поражения с резекцией большого сальника, биопсией противоположного яичника и забором смывов с брюшины. Пациентке с карциномой проведено органосохраняющее оперативное пособие для реализации репродуктивной функции в дальнейшем. При гистологическом исследовании в материале пациенток с пограничными опухолями и карциномой опухолевых имплантов или метастазов не обнаружено, что свидетельствовало об 1а стадии по классификации FIGO у всех пациенток, за исключением женщины с пограничной опухолью поверхности яичника, спаянной с маткой – 1с стадия.
Обсуждение
В результате настоящей работы установлено, что доброкачественным СМО свойственна гладкая внутренняя поверхность, папиллярные разрастания, покрытые однорядным эпителием, обнаружены у 3 женщин, 2 из которых были беременны. Подобные морфологические особенности описали Massicot и соавт. [17], исследуя СМО у 23 девочек, средний возраст которых составил 11,5 года. Исследователи установили сосочковые структуры внутри цистаденом лишь у 4 девочек, находящихся в пубертатном периоде, что позволило предположить необходимость гормональной стимуляции. Несмотря на рецидив опухоли у 4 девочек через 1–3,5 года после тотальной резекции кистозного образования, авторы пришли к выводу о благоприятном исходе данной опухоли [18].
Выявленные морфологические признаки пограничных СМО и серомуцинозной карциномы аналогичны данным литературы. Shappell и соавт. [19], изучая клиникоморфологические особенности пограничной СМО у 34 женщин, интраэпителиальной карциномы у 5, микроинвазивной карциномы со стромальной инвазией менее 5 мм у 7, карциномой у 8, обнаружили характерное папиллярное строение, имеющее сходство с серозными опухолями, и гетерогенность популяции эпителиальных клеток, включающей не только серозные (реснитчатые) и эндоцервикальные, а также эндометриоидные, светлоклеточные и недифференцированные клетки с эозинофильной цитоплазмой. Изредка встречались опухоли, выстланные лишь эпителием эндоцервикального типа [19]. Следует отметить, что в настоящей работе пограничные опухоли также состояли из разных типов эпителиальных клеток, в отличие от доброкачественных цистаденом, представленных преимущественно эпителием эндоцервикального типа с примесью клеток серозного типа.
Иммуногистохимическое исследование препаратов опухолей выявило высокую экспрессию ER и PR у всех пациенток. Vang и соавт. при сравнении иммунопрофилей муцинозных опухолей кишечного типа и серомуцинозных (эндоцервикального типа) новообразований яичников также установили высокую экспрессию ER и PR в серомуцинозных опухолях, в отличии от муцинозных цистаденом кишечного типа [15]. Помимо данных маркеров, СМО также позитивны при окрашивании на CK7, PAX8 и виментин [20].
Вместе с тем Rambau и соавт. проанализировали воспроизводимость диагноза серомуцинозной карциномы и молекулярно-генетическое строение этой опухли на образцах, полученных от 32 женщин. Воспроизводимость диагнозов серомуцинозной карциномы составили 39–56% среди 4 патологов, совокупные результаты морфологического, иммуногистохимического и генетического исследований привели к реклассификации серомуцинозных карцином в эндометриоидную карциному у 23 пациенток, серозную карциному низкой степени злокачественности у 8, муцинозную – у 1. Результаты своей работы авторы обосновали неспецифичностью экспрессии ER и PR в СМО, а также возможностью присутствия клеток плоского, светлоклеточного и муцинозного эпителия в эндометриоидных и серозных карциномах низкой степени злокачественности [21].
Известно, что выраженная лейкоцитарная инфильтрация присутствует почти во всех серомуцинозных опухолях и является их отличительной особенностью по сравнению с другими пограничными новообразованиями [16, 21]. Taylor и соавт., описавшие структурные особенности серомуцинозной карциномы у 19 женщин, также отметили присутствие нейтрофильного инфильтрата во многих образцах [22]. В настоящем исследовании лейкоцитарная инфильтрация обнаружена в препаратах 4 женщин с пограничной опухолью, у 1 из них выявлены мелкие очаги распада, которые, вероятно, не ухудшают прогноз, поскольку имеют микроскопические размеры. Об этом свидетельствует данные исследования взаимосвязи между инфарктами в папиллах и наличием микроинвазии в 32 образцах серозных и серомуцинозных пограничных опухолей яичников 26 женщин (у 6 пациенток с двусторонним поражением). Авторы выявили микроинвазию в 50% препаратов опухолей с инфарктами по сравнению с 7% образцов без инфарктов и заключили, что средний размер инфарктов, наблюдаемых одновременно с участками микроинвазии, составляет 5,9 мм, а инфаркты диаметром менее 2,2 мм не сопровождаются микроинвазивным ростом [23].
В процессе крупных исследований были получены данные о том, что в 5–10% наблюдений эндометриоз сочетается со злокачественными новообразованиями яичников. Однако другие авторы представляют данные об опухолевой трансформации эндометриоза (с железами с признаками атипии) не более чем в 0,7–1,6% [5]. Вместе с тем признаков атипического эндометриоза в исследованном материале нами не обнаружено. С другой стороны, Wu и соавт., при изучении образцов пограничных СМО у 7 из 17 женщин обнаружили сосуществующий эндометриоз, однако не имеющий признаков атипии [15]. Атипическим эндометриозом обозначают неопластическую трансформацию эпителия эндометриоидной кисты, возникающую при накоплении повреждений ДНК, что обусловлено образованием свободных радикалов при окислении железа, а также неоднократным повреждением, воспалением, восстановлением эпителия и длительным эстрогенным воздействием [23].
Следует отметить, что в настоящем исследовании все пациентки были репродуктивного возраста. Противоположно этому, Wu и соавт. указали средний возраст пациенток с пограничными СМО 51,3 года [15], Karpathiou и соавт. описали наблюдения пограничной серомуцинозной опухоли у женщин 63,2 года и серомуцинозной карциномы у пациенток 68,3 года [20]. Данное различие, вероятно, связано со специфической направленностью лечебной деятельности НМИЦ АГП и ЦПСиР и подтверждает возможность развития СМО в любом возрасте. Возраст пациентки с серомуцинозной карциномой составил 31 год, что входит в возрастной диапазон, доложенный Taylor и McCluggage в исследовании 19 пациенток с серомуцинозной карциномой – 16–79 лет [22].
За исключением одной пациентки с пограничной СМО 1с стадии по FIGO все остальные пациентки имели 1а стадию, что, согласно сведениям литературы, является типичным для этой опухоли. 24.26. Dubé и соавт., исследуя 17 образцов опухолей (n пограничных СМО = 12; n интраэпителиальных карцином = 2; n микроинвазивных карцином = 2 и n инвазивных карцином = 1), установили у 14 женщин 1-ю стадию, у 1 – 2а стадию, у 1 – 3с стадию, у 1 стадирование выполнено не было. У всех пациенток был отмечен благоприятный исход (отсутствие рецидива, смерти), несмотря на высокую митотическую активность, признаки интраэпителиальной карциномы, микроинвазии, билатеральное поражение, консервативное лечение или выраженную стадию [24]. Shappell и соавт. заключили, что большинство пограничных СМО обнаруживаются на 1-й стадии и являются доброкачественными, подчеркнув, что интраэпителиальная карцинома или наличие микроинвазии не ухудшают прогноза. Однако авторами было отмечено, что две из семи женщин, имеющих стромальную инвазию или микропапиллярное строение, в последующем умерли [19].
Заключение
Таким образом, доброкачественные СМО – это преимущественно гладкостенные кистозные образования, выстланные эпителием эндоцервикального типа с небольшим количеством серозного, в то время как пограничные опухоли отличаются папиллярным строением, в эпителии которых помимо вышеперечисленных присутствуют клетки эндометриоидного, светлоклеточного и недифференцированного эозинофильноклеточного типа. Лейкоцитарная инфильтрация в стенке опухоли и сочетание с эндометриозом являются специфическими признаками СМО. Данные факты говорят о этиологической роли эндометриоза в возникновения СМО.
У подавляющего числа исследованных опухоль диагностирована на 1а стадии по классификации FIGO, что свидетельствует о преимущественно благоприятном течении рассмотренного заболевания у пациенток репродуктивного возраста. Для ЭАН характерны специфические и частично идентичные механизмы молекулярной альтерации, что может быть использовано в последующем для применения таргетной терапии распространенных или рецидивирующих опухолей данного типа.



