За последние несколько лет наблюдается растущий интерес к методам сохранения фертильности онкологических больных, что связано с улучшением показателей выживаемости при раке, повышением внимания к качеству жизни онкологических больных в ремиссии, постоянным прогрессом в области вспомогательных репродуктивных технологий (ВРТ), а также большей осведомленностью врачей и больных о возможностях сохранения репродуктивного материала [1].
Из 100 000 случаев гинекологических злокачественных новообразований, диагностируемых каждый год, 15–20% обнаруживается у женщин до 40 лет [2]. Раннее выявление и улучшение протоколов лечения значительно увеличило выживаемость. Так, 5-летняя выживаемость при онкозаболеваниях всех типов и локализаций у женщин в репродуктивном и пубертатном периодах достигает 75% [3]. Вместе с тем откладывание деторождения на поздний репродуктивный возраст, что характерно для современного общества, привело к тому, что у значительной части женщин рак диагностируется раньше, чем рождается первый ребенок, и эта тенденция, к сожалению, усугубляется.
В этой связи сохранение репродуктивного материала молодых женщин для отсроченного материнства является актуальной и крайне сложной проблемой современной медицины.
Сегодня в мире используют и апробируют ряд методик, призванных сохранить репродуктивный материал и защитить репродуктивную функцию пациентов от негативного влияния гонадотоксичной терапии [4]. Некоторые из них все еще носят экспериментальный характер, другие, несомненно, клинически эффективны [5].
Используемые методы можно представить в виде:
- предварительная криоконсервация ооцитов/эмбрионов (клинический метод с доказанной эффективностью);
- предварительная криоконсервация сперматозоидов (клинический метод с доказанной эффективностью);
- криоконсервация ткани яичников/яичек с последующей аутотрансплантацией (метод недостаточно разработан);
- получение незрелых ооцитов при трансвагинальной пункции в нестимулированном цикле, дозревание in vitro, криоконсервация ооцитов/эмбрионов (не продемонстрировал достаточную клиническую эффективность);
- получение незрелых ооцитов из ткани удаленного яичника или его части, дозревание in vitro, криоконсервация ооцитов/эмбрионов (экспериментальный метод);
- медикаментозная защита яичников назначением аГнРГ (клинический метод, эффективность недостаточно ясна);
- транспозиция яичников при хирургическом вмешательстве (клинический метод, неясна эффективность в плане реализации репродуктивной функции);
- комбинация методов (используется индивидуально).
Указанная градация в значительной степени является условной, т.к. в каждом индивидуальном случае в рамках междисциплинарного консилиума решается вопрос о возможности и способах сохранения репродуктивного материала у конкретной пациентки. Тем не менее вектор принятия решения базируется на первостепенном использовании клинических методов, если это возможно, и поиске альтернативных, часто экспериментальных, при невозможности применения клинических методик.
Рядом публикаций определены основные показания проведения стимуляции яичников для забора и криоконсервации ооцитов/эмбрионов перед гонадотоксичным лечением [6]. Это молодые женщины с любой локализацией рака I стадии, кроме рака и рецидивирующих пограничных опухолей яичников. Условиями являются заключение онколога о возможности проведения стимуляции яичников, сохраненные показатели овариального резерва, добровольное информированное согласие пациентки. Методика: индивидуальные модифицированные программы, сочетание эффективности (достаточное число ооцитов/эмбрионов), снижение уровня половых стероидов в процессе стимуляции, длительность лечения не более 14–16 дней [7–9]. Таким образом, злокачественные новообразования яичников являются противопоказанием к стимуляции и пункции яичников, так же как и для криоконсервации ткани яичников, что обосновало необходимость разработки новой методики OTO IVM (Ovarian Tissue Oocyte In Vitro Maturation) – выделение ооцит-кумулюсных комплексов (ОКК) из ткани яичника после овариэктомии с последующим их дозреванием in vitro. Технология OTO IVM подразумевает выделение и работу с ОКК экстракорпорально, она не несет дополнительных рисков для пациенток в плане переноса атипических клеток, что не исключено при аутотрансплантации ткани яичника [10, 11]. Методика является экспериментальной и выполняется в тех случаях, когда отсутствует возможность использовать другие методы, в основном при раке яичников, который, согласно данным Национального института здоровья США, диагностируется в 12% случаев у женщин репродуктивного возраста [12]. Публикаций, оценивающих эффективность метода по получению и криоконсервации ооцитов/эмбрионов в результате ОТО IVM, немного [10, 11]. Закономерно единичными являются сообщения о рождении детей после использования методики ОТО IVM [13].
Имея определенный опыт применения методики ОТО IVM, мы хотели бы определить показания, ограничения, методику выполнения и эффективность указанного метода, что явилось целью настоящей работы.
Материалы и методы
Данное исследование одобрено этическим комитетом «НМИЦ АГП им. В.И. Кулакова» Минздрава РФ (протокол № 11 от 13.12.2018 г.). Все пациентки подписали добровольное информированное согласие на участие в исследовании и обработку персональных данных. Метод ОТО IVM применен у 72 пациенток, которым проведено хирургическое лечение по поводу: рака яичников – у 60/72 (83,3%) больных, пограничных опухолей яичника – у 12/72 (16,7%) пациенток. В лабораторию эмбриологии было доставлено 89 удаленных яичников и 3 биоптата яичников.
Яичники доставляли из операционной в стерильных контейнерах, ОКК выделяли из ткани яичника путем аспирации при помощи 21G иглы, подсоединенной к 10 мл шприцу, или путем измельчения овариальной ткани при помощи скальпелей.
Полученные ОКК дозревали в условиях in vitro в течение 30–48 ч в среде для дозревания ооцитов. В стандартном протоколе IVM дозревание незрелых ОКК проводили в среде IVM (Origio, Дания) с добавлением человеческого альбумина (Албурекс, Германия), гормонов ФСГ и ЛГ в течение 48 ч. Проводили идентификацию зрелости и качества полученных ооцитов, зрелые ооциты криоконсервировали по общепринятой методике методом витрификации. В случае желания пациентов оплодотворить полученные ооциты проводили оплодотворение методом ИКСИ, оценивали оплодотворение по наличию двух пронуклеусов, культивировали эмбрионы до стадии бластоцисты в одношаговой среде GTL (Vitrolife), покрытой маслом Ovoil (Vitrolife), в инкубаторе при 37°C, 6% CO2 и 5% О2 до 5-х суток развития. Оценивали наличие и качество полученных бластоцист по критериям Гарднера, витрифицировали бластоцисты, пригодные для криоконсервации. Всего криоконсервировано 92/141 (65,2%) ооцита стадии МII у 26/72 (36,1) больных и 11 эмбрионов у 6/72 (8,3%) пациенток.
Работа эмбриолога складывалась из нескольких этапов, первым из которых являлась заблаговременная подготовка сред и расходных материалов до планируемой работы с яичником. Препарирование макропрепарата, поиск и извлечение из яичника ОКК занимают приблизительно 1,5 ч и требуют определенных навыков. Культивирование в среде дозревания в среднем занимает 35 ч, тогда как идентификация ооцитов, отбор зрелых и последующая их криоконсервация занимают не более 1 ч. Далее по желанию пациентки проводится оплодотворение зрелых ооцитов биологическим материалом мужа, партнера или донора методом ИКСИ и культивирование эмбрионов в течение 5 суток. Указанные сведения приведены для того, чтобы подчеркнуть трудоемкость работы высококвалифицированного эмбриолога.
Статистический анализ
Статистическую обработку данных проводили в программной среде R [14]. Для нахождения связи между двумя количественными переменными использовали коэффициент корреляции Спирмена (Rs). Для нахождения связи между двумя качественными переменными использовали точный тест Фишера. Для количественных переменных проверяли нормальность распределения с помощью теста Колмогорова–Смирнова. В случае ненормального распределения для сравнения групп использовали непараметрические критерии Манна–Уитни (для сравнения двух групп) или Краскела–Уоллиса (для сравнения более двух групп). Для сравнения групп с нормально распределенными признаками использовали двухвыборочный t-критерий Стьюдента. В случае нормального распределения данные представлены как среднее (SD), в случае ненормального распределения указана медиана (Q1; Q3).
Результаты и обсуждение
Исходя из цели исследования, предполагающей определение показаний для проведения программы ОТО IVM, пациентки были разделены на 2 группы. 1-ю группу составили 17/72 (23,6%) женщин, у которых программу расценили как успешную, было консервировано не менее 5 зрелых ооцитов или 1 и более эмбриона хорошего качества, во 2-ю группу вошли 55/72 (76,4%) пациенток с безуспешной попыткой получения и криоконсервации ооцитов, когда яйцеклетки не были получены, не дозрели или же для криоконсервации были пригодны лишь 1–2 ооцита.
Подобное разделение обусловлено трудоемкостью метода, о чем было сказано выше, и целью предотвращения возможной дискредитации этого направления, когда неполучение необходимого материала чаще всего связано не с дефектами метода, а с неправильным подбором больных.
Из общей группы пациенток, вошедших в исследование, у 60/72 (83,3%) женщин диагностирован рак яичника, у 12/72 (16,7%) – пограничные опухоли яичников. Возраст пациенток колебался от 14 до 43 лет, составив в среднем 33 (6,25) года. В таблице представлено сравнение анамнестических и клинико-лабораторных характеристик пациенток с успешной и безуспешной программой OTO IVM.
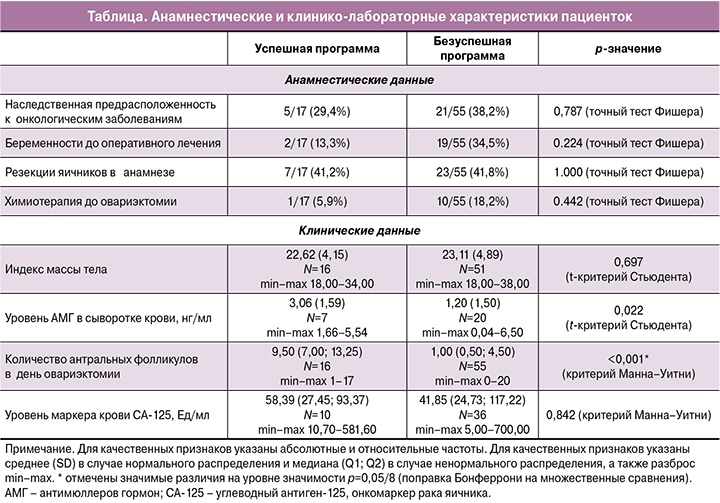
Из данных анамнеза выявлена наследственная предрасположенность к онкологическим заболеваниям у 26/72 (36,1%) опрошенных пациенток. Беременности до диагностики заболевания были у 21/72 (29,1%) женщины, и 13/72 (18%) из них родили ребенка. Корреляция между ИМТ и ОКК оказалась незначимой (Rs=-0,160; p=0,196).
У 31/72 (43%) пациентки проведена резекция яичников, при этом у 19/72 (26,4%) из них первоначальным диагнозом было наличие образования в яичнике, при гистологическом исследовании которого диагностирована злокачественная или пограничная опухоль, что потребовало повторной радикальной операции.
Средний возраст пациенток составил 33 (6,25) года, что соответствует активному репродуктивному периоду, но диапазон возраста варьировался от 14 до 43 лет. То же относится к уровням АМГ в сыворотке крови, который составил в среднем 1,68 (1,7) нг/мл со значениями от 0 до 6,5 нг/мл соответственно, среднее количество антральных фолликулов составило 4,52 (4,88) c диапазоном колебаний от 0 до 20.
Как следует из представленных данных, группа больных была весьма неоднородной по анамнестическим и клиническим характеристикам. Для оценки успеха/неуспеха программы OTO IVM мы определили криоконсервацию 5 и более ооцитов стадии MII и/или 1 и более эмбриона как успех программы. По нашим данным, эти показатели были достигнуты лишь у 17/72 (23,6%) женщин, у остальных 55/72 (76,4) программа была неудачной. Мы попытались определить предикторы положительного результата и, соответственно, те факторы, которые ограничивают использование методики OTO IVM.
Возраст пациенток, уровень АМГ, число антральных фолликулов
Группы с успешной и безуспешной программой значимо различались по возрасту (р=0,008; t-критерий Стьюдента): средний возраст пациенток с полученными ОКК был значимо ниже и составил 28,9 (6,9) года по сравнению с 34,3 (5,5) года у пациенток с неблагоприятным исходом.
Также у пациенток с успешным исходом было значимо выше (р=0,022; t-критерий Стьюдента) среднее значение АМГ, которое составило 3,06 (1,59) по сравнению с 1,20 (1,50) нг/ мл у пациенток с неудачным исходом программы.
Группы с успешной и безуспешной программами значимо различались по числу антральных фолликулов (р<0,001; критерий Манна–Уитни): медиана (Q1; Q3) числа антральных фолликулов у пациентов с успешным исходом была выше и составила 9,50 (7,00; 13,25) против 1,00 (0,50; 4,50) у больных с безуспешной программой.
Таким образом, возраст пациентки, сопряженные с ним показатели овариального резерва обнаружили сильную связь с исходом программы OTO IVM, что закономерно. Обнаружена значимая отрицательная корреляция средней силы между количеством полученных ОКК и возрастом (Rs=-0,442; p<0,001): чем старше пациентка, тем меньше ОКК. Также количество полученных из ткани яичника ОКК значимо коррелирует с АМГ (Rs=0,822; p<0,001): чем выше уровень АМГ, тем больше ОКК.
Резекция яичников и химиотерапия в анамнезе
Известно, что как резекция яичников, так и химиотерапевтическое лечение негативно влияют на состояние овариального резерва и возможность получения достаточного количества ооцитов [15–17].
В проведенном нами исследовании не установлена значимая связь между успехом программы OTO IVM и между успехом/неуспехом программы OTO IVM и наличием/отсутствием резекции яичников в анамнезе (p=1; точный тест Фишера). Между группами пациенток с резекцией 1 яичника, 2 яичников и отсутствием резекций нет значимых различий по количеству ОКК (р=0,458; критерий Краскела–Уоллиса).
Однако обнаружена слабая, но значимая отрицательная корреляция между полученными ОКК и проведением химиотерапевтического лечения в анамнезе (Rs=-0,340; p=0,003): чем больше проведенных курсов химиотерапии, тем меньше полученных ОКК (было всего 11/72 (15,3%) пациенток, подвергавшихся химиотерапии).
Выявлены значимые различия (р=0,004; критерий Манна–Уитни) между пациентками с проведенным лечением в анамнезе, где медиана (Q1; Q3) количества полученных ОКК составила 0,6 (1,5), и пациентками без гонадотоксичного лечения – 3,0 (0,0; 8,0).
День менструального цикла
В некоторых публикациях имеются сведения о том, что эффективность получения ОКК и последующее дозревание незрелых ооцитов не зависят от дня менструального цикла [18]. Мы попытались сравнить результаты лечения у пациенток в зависимости от дня цикла, в который проведен забор яичника.
Все пациентки оперировались в различные фазы цикла, из них 42/72 (58,3%) – в фолликулярную, 20/72 (27,8%) – в овуляторную и 10/72 (13,9%) – в лютеиновую фазы. Между успехом программы OTO IVM и фaзой цикла нет значимой зависимости (p=0,720; точный тест Фишера). Мы не выявили значимых различий по числу полученных ОКК между тремя группами пациенток, у которых забор яичника был произведен в разные фазы цикла (р=0,885; критерий Краскела–Уоллиса), а также не обнаружено влияния фазы цикла на количество MII (р=0,779; критерий Краскела–Уоллиса).
Неблагоприятные факторы, ограничивающие возможность получения ОКК
В ходе проведения работы были определены факторы, неблагоприятные для проведения программы ОТО IVM.
К сожалению, зачастую при овариэктомии используется значительная коагуляция яичника, в том числе монополярным током. Естественно, это обусловлено хирургической ситуацией, кровотечением и трудностями выделения яичника, однако коагуляция яичника фатально влияет на возможность получения яйцеклеток (рис. 1).
В 3 случаях в лабораторию ЭКО была доставлена ткань яичника размерами 0,5×0,5 см после резекции яичника. Ни в одном случае не удалось получить ОКК, т.к. функциональная ткань была замещена фиброзной и склерозированной. Также ни в одном случае не удалось получить клетки из биоптатов яичника.

В предыдущем изложении показано, что не установлена значимая связь между успехом программы OTO IVM и резекциями яичников в анамнезе (p=1 в точном тесте Фишера). Однако дальнейший анализ убедительно доказал связь между размером доставленного образца яичника и возможностью выделения ОКК. Соответственно, чем меньше ткань яичника, тем меньше вероятность получения ооцитов, и, хотя сам факт резекции не показал достоверной корреляции с возможностью получения ооцитов, объем яичника после резекции играет решающую роль.
При наличии в обоих или в единственном яичнике опухоли больше 4 см (рис. 2 и 3) также не удалось выделить ОКК, т.к. функциональная ткань яичника была поражена опухолью.
Всего было криоконсервировано 92/141 (65,2%) зрелых ооцитов у 26/72 (36,1%) больных. Дозревание незрелых клеток произошло в 47,96% случаев.
Хорошо известно, что эмбрионы 5-го дня культивирования лучше переживают криоконсервацию и последующее размораживание, имея большие шансы обеспечить наступление беременности [19]. В настоящем исследовании 14/72 (19,4%) пациенток выразили желание оплодотворить полученные ооциты спермой мужа/партнера.
Проведено оплодотворение 49/141 (34,7%) зрелых ооцитов методом ИКСИ. Сперма партнеров была фертильной или имела незначительную степень патозооспермии. Оплодотворение диагностировано в 27,6% случаев, однако формирование бластоцист наблюдали лишь у 17,95% из оплодотворенных эмбрионов. Полученные в данном исследовании результаты были значительно ниже, чем общепринятые показатели в программах ЭКО [20].
На рисунке 4 представлены макропрепарат больной раком яичника стадии Т3сNxM1b согласно классификации FIGO и полученная у данной супружеской пары эуплоидная бластоциста после проведения программы OTO IVM.
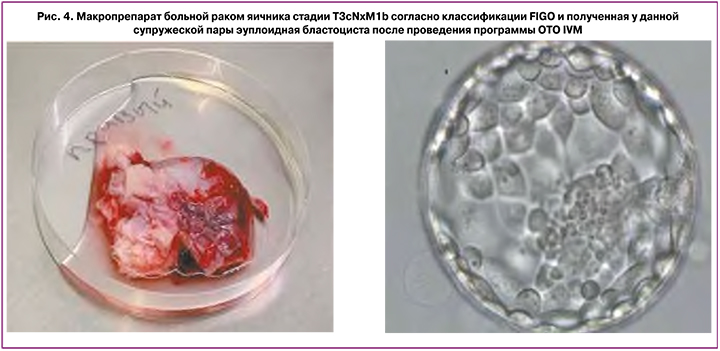
Представленные данные показали, что, несмотря на эффективность этапов выделения и дозревания незрелых ооцитов, полученных из ткани удаленного яичника, неудовлетворительными являются процессы оплодотворения, раннего эмбриогенеза, количество и качество бластоцист. Это может быть связано с генетическими факторами, например, анеуплоидией, нарушающей развитие эмбриона, и, что более вероятно, с эпигенетическими причинами, ведущими к аресту раннего эмбриогенеза.
В любом случае первый и очень важный шаг в развитии метода ОТО IVM сделан, но предстоит большая работа, оценивающая эффективность и безопасность метода. Согласно рекомендациям Европейского общества репродуктивной медицины (ESHRE), требуются дальнейшие исследования, посвященные изучению качества ооцитов после IVM, а также долгосрочные наблюдения за детьми, рожденными после применения указанной технологии [10, 13]. Кроме того, требуются дальнейшая разработка и стандартизация протоколов дозревания и криоконсервации ооцитов для повышения эффективности программы IVM.
Несомненно, технология дозревания незрелых ОКК in vitro имеет большие перспективы применения в клинической практике как метод сохранения фертильности у онкологических пациенток. Следует еще раз подчеркнуть тот факт, что метод используется в тех случаях, когда нет альтернативных вариантов иметь генетически родного ребенка, прежде всего у молодых женщин, имеющих рак яичников. Этот метод – их единственная надежда, и несомненна необходимость дальнейшей работы в этом направлении.
В этой связи важно определить критерии отбора пациентов с перспективным прогнозом использования метода ОТО IVM. К сожалению, на данном этапе целесообразно исключать неперспективных больных, что необходимо для дальнейшего совершенствования метода.
Заключение
Проведенное исследование позволило определить критерии отбора пациенток для использования метода ОТО IVM. Неперспективными следует считать женщин старше 40 лет с уровнем АМГ ниже 1,0 нг/мл, наличие резекции яичников и полихимиотерапии в анамнезе, использование коагуляции яичника при его удалении, направление в лабораторию ЭКО биоптата яичника и ткани размерами меньше 3 см. Также при наличии опухоли больше 4 см в обоих или единственном яичнике получить ОКК затруднительно. Благоприятной ситуацией следует считать те случаи, когда овариэктомия производится у молодых женщин с хорошими показателями овариального резерва, размеры опухоли не превышают 2–3 см, желательно не использовать коагуляцию яичника. Следует сказать, что метод продолжает оставаться экспериментальным, при достаточном успехе извлечения ОКК и доращивании незрелых ооцитов in vitro качественные бластоцисты образуются с гораздо меньшей частотой, чем в общей практике ВРТ, что может ограничивать конечный результат лечения, достижение беременности у этого контингента больных. Но, как было сказано выше, это единственная возможность у многих молодых женщин надеяться на деторождение в будущем.



