Папилломавирусная инфекция (ПВИ) является самой распространенной инфекцией среди сексуально активных молодых женщин. Так, в США ежегодно у 6,2 млн человек выявляется вирус папилломы человека (ВПЧ) [1]. В настоящее время существуют доказательства, свидетельствующие о том, что ВПЧ являются основным этиологическим фактором развития предрака и рака аногенитальной области. Высокоонкогенные типы ВПЧ ассоциированы в первую очередь с плоскоклеточными интраэпителиальными поражениями шейки матки (CIN), вульвы (VIN), влагалища (VaIN), ануса и злокачественными опухолями [2]. Биология этих вирусов широко изучается с позиции возникновения и прогрессирования неопластических процессов. Согласно данным C.M. Wheeler (2006), в 9–10% случаев ВПЧ-инфекция развивается в течение нескольких лет, во время которых высока вероятность развития предраковых состояний аногенитальной области. Так, высокоонкогенные типы вируса папилломы человека (ВПЧ) являются причиной 91% случаев рака шейки матки и ануса, 69% – вульвы, 75% – влагалища, 63% – пениса [3–8]. Ежегодно 21 300 случаев ВПЧ-ассоциированных раков диагностируется среди женщин и 12 100 – среди мужчин. Рак шейки матки является наиболее распространенной формой ВПЧ-ассоциированного рака среди женщин. Так, в США в 2014 г. зарегистрировано 12 900 новых случаев РШМ, в России – 14 536 случаев [9]. Анальная интраэпителиальная неоплазия (АIN), как правило, предшествует развитию инвазивного плоскоклеточного рака ануса [10]. Значительное увеличение заболеваемости и смертности от рака анального канала в США наблюдается с 1975 по 2014 г.; было выявлено 7270 новых случаев рака анального канала, из которых 62% (4640 человек) – женщины в возрасте от 35 до 60 лет [9]. Результаты проведенного статистического исследования в США также показали, что частота анального рака имеет тенденцию к росту и увеличивается ежегодно на 2–5%, особенно среди населения с факторами риска, в первую очередь с ВПЧ-ассоциированными поражениями генитальной области (CIN, VIN, VaIN) [11]. Пациентки с наличием дисплазии шейки матки подвержены риску развития AIN и анального рака [12].
Распространенность анальной ВПЧ-инфекции среди лиц с наличием анальных половых контактов является высокой в возрастных группах от 18 до 50 лет и составляет 50–60% [13]. Есть данные, что анальная ВПЧ-инфекция может самостоятельно элиминировать, но сексуальное поведение высокого риска может привести к развитию новых случаев инфицирования ВПЧ [13].
В настоящее время тропность типов ВПЧ к эпителию шейки матки и ануса не изучена и представляет большой интерес с точки зрения персистенции инфекции и развития CIN и AIN [14]. С продолжающимся ростом частоты анального рака скрининг AIN стал темой обсуждений. В настоящее время клинические рекомендации по профилактике и скринингу анального рака среди пациентов высокого риска находятся в стадии разработки [15].
Цель исследования: изучить распространенность различных типов ВПЧ аногенитальной области у пациенток с ВПЧ-ассоциированными CIN различной степени тяжести.
Материал и методы исследования
В одномоментное проспективное исследование были включены 159 женщин в возрасте от 18 до 60 лет, обратившихся в научно-поликлиническое отделение ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России, по поводу патологии шейки матки.
Критерии включения: СIN различной степени тяжести, подтвержденные морфологическими методами исследования; подписанное информированное согласие на участие в исследовании.
Критерии исключения: беременность, послеродовый период и лактация, отсутствие возможного следования протоколу, рубцовые изменения анальной области.
Методы исследования: клинические (клинический осмотр, сбор клинико-анамнестических данных, определение гинекологического статуса, консультация проктолога); расширенная кольпоскопия; аноскопия с высоким разрешением; цитологическое исследование мазков с шейки матки и анальной области; прицельная биопсия шейки матки; гистологическое исследование биопсийного материала; типирование и количественная оценка ВПЧ.
ВПЧ тестирование 21 типа ВПЧ (6, 11, 16, 18, 26, 31, 33, 35, 39, 44 (55), 45, 51, 52, 53, 56, 58, 59, 66, 68, 73, 82) с определением вирусной нагрузки осуществлялось методом мультиплексной полимеразной цепной реакции с детекцией результатов в режиме реального времени (HPV квант-21, ДНК-Технология, Россия) в цервикальном канале и в анальной области. При оценке вирусной нагрузки в качестве меры центральной тенденции определяли медиану, в качестве интервальной оценки – межквартильный размах. Достоверность межгрупповых различий определяли с помощью критерия Манна–Уитни.
Изменения анального эпителия были описаны в соответствии с кольпоскопической терминологией Международной ассоциации по патологии шейки матки и кольпоскопии (IFCPC,2011), предназначенные для анального эпителия [16].
Аноскопия с высоким разрешением (anHRA) представляет метод прямой визуализации перианальной области и дистальной части прямой кишки при помощи кольпоскопа с применением 5% раствора уксусной кислоты.
Из-за сходства эпителиев шейки матки и анальной области у женщин с CIN аноскопия проводится при помощи кольпоскопа и позволяет оценить состояние эпителия анальной области, выявить участки поражения, определить участки для последующего гистологического исследования. Основными анализируемыми характеристиками являются: цвет эпителия, размеры поражения, сосудистый рисунок, наличие ацето-белого эпителия, мозаики, пунктации и степени их выраженности.
Для интерпретации результатов анальной цитологии использовалась классификация по системе Бетесда (TBS-Terminology Bethesda System) [17, 18].
В процессе статистической обработки данных применены методы описательной статистики, расчеты проводились на базе прикладных программ Microsoft Excel и Statistica 6.0. Отношение шансов (OR) и значимость различий в частоте встречаемости качественных признаков проводили по критерию χ2 и рассчитывали с помощью программного продукта Winpepi. OR приведено с 95% доверительным интервалом.
Результаты и обсуждение
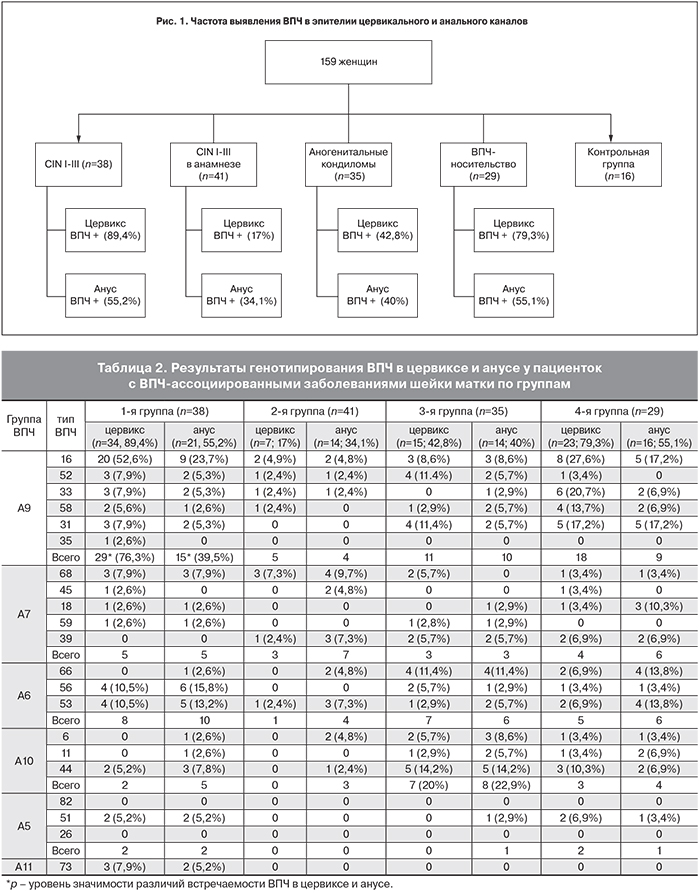
Были обследованы 159 женщин в возрасте от 18 до 60 лет (средний возраст 30±12 лет). По результатам обследования было сформировано 5 групп: 1-я группа – 38 (23,9%) пациенток с наличием CIN I–III на данный момент, 2-я группа – 41 (25,8%) пациентка с CIN I–III в анамнезе, 3-я группа – 35 (22,0%) женщин с аногенитальными кондиломами, 4-я группа – 29 женщин (18,2%) с ВПЧ-носительством, 5-я группа – 16 (10,1%) здоровых женщин (рис. 1).
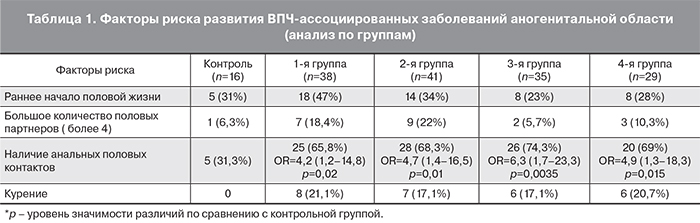
Анализ клинико-анамнестических данных показал, что 53 женщины (33,3%) отметили раннее начало половой жизни (до 18 лет), 22 (13,8%) – большое количество половых партнеров (более 4), 104 (65,4%) практиковали анальный секс, 79 (49,7%) имели в анамнезе CIN и/или CIN в настоящее время (табл. 1).
При обследовании наличие цервикального ВПЧ выявлено у 79 (49,7%) пациенток, наличие анального ВПЧ – у 65 (40,9%) пациенток. Данные с распределением по группам представлены на рис. 1.
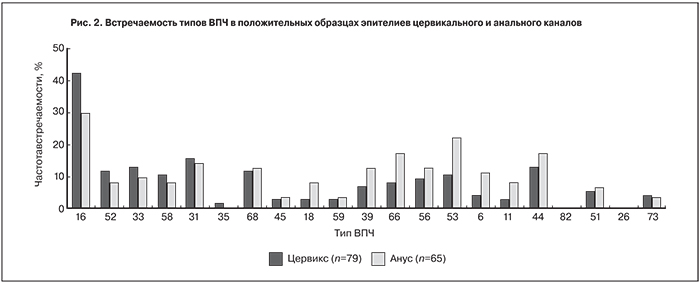
Наиболее часто встречающимися типами в цервиксе были 16-й тип (41,7%), 31 (15,1%), 44, 33 (12,6%), 52, 68 (11,3%). Другие типы ВПЧ встречались менее чем в 7% случаев. В анальном канале чаще встречались 16-й тип (29,2%), 53 (21,5%), 66 и 44 (16,9%), 31 (13,8%), 56 и 39 (12,3%), 6 (10,7%) (рис. 2). Полученные данные отличаются от представленных ранее, согласно которым наиболее распространенными типами ВПЧ у пациентов группы риска в анусе считались 16-й и 18-й типы [19].
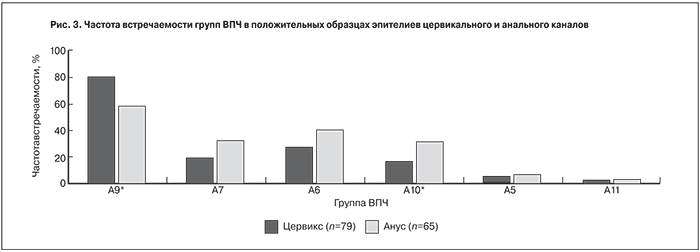
В результате проведенного сравнительного анализа было установлено, что в цервикальном канале достоверно чаще по сравнению с анусом встречались ВПЧ группы А9 (79,7% vs 58,5%, OR=2,8 (1,3–5,9), p=0,005); а в анусе – ВПЧ группы А10 (30,8% vs 15,2%, OR=2,5 (1,1–5,6), p=0,025) (рис. 3). Для групп А7 и А6 выявлены тенденции более частой встречаемости в эпителии анальной области (р=0,067 и р=0,088 соответственно), однако установленные тенденции для этих групп ВПЧ требуют дальнейшего исследования. Полученные данные могут свидетельствовать о различии в тропности эпителиев цервикального и анального канала к типам ВПЧ. В настоящее время эпителий анального канала остается вне поля зрения как проктолога, так и гинеколога до момента выраженных поражений. По полученным нами данным установлено, что анальную область можно рассматривать как резервуар ВПЧ-инфекции в первую очередь вирусов групп А10, А7 и А6.
Помимо этого, мы предполагаем, что о разной тропности вируса могут свидетельствовать различия в уровне вирусной нагрузки в эпителии цервикального канала и анальной области. Например, вирусная нагрузка в эпителии цервикального канала составила для типов 16, 31 и 33 соответственно 106,2 (межквартильный размах 105,2–107,0); 106,4 (105,7–106,9) и 105,2 (104,8–106,5) копий в образце. В сравнении аналогичные показатели в эпителии анальной области соответственно составили 102,9 (102,7–104,0); 103,6 (103,0–104,2) и 102,8 (102,7–104,4) копий в образце. В то время как для ВПЧ 6-го типа показатели вирусной нагрузки в эпителии цервикального канала и анальной области были схожими и составили 105,4 (103,7–107,1) и 105,3 (103,5–105,9) [14].
Результаты генотипирования ВПЧ по группам представлены в табл. 2.
В 1, 2, 3, 4-й группах наиболее часто в цервиксе выявлялись ВПЧ 16-го типа – 52,6%, 4,9%, 8,6%, 27,6% соответственно; 33-го типа – 7,9%, 2,4%, 0, 20,7%. В анальной области в 1, 2, 3, 4-й группах чаще встречались ВПЧ 16-го типа – 23,7%, 4,8%, 8,6%, 17,2%; 31-го типа – 5,3%, 0, 5,7%, 17,2%; 66-го типа – 2,6%, 4,8%, 11,4%, 13,8%; 56-го типа – 15,8%, 0, 2,9%, 3,4%; 53-го типа – 13,2%, 7,3%, 5,7%, 13,8% соответственно. ВПЧ группы А9 достоверно чаще встречались в эпителии цервикального канала, чем в анусе у пациенток с CIN на момент исследования (76,3% vs 39,5%, OR=9,1 (2,5 – 25), p=6,9×10-5), что позволяет рассматривать наличие CIN как фактор риска поражения анальной области данными типами вируса, а эпителий цервикального канала – как доминирующий резервуар ВПЧ группы А9.
Следует отметить, что, несмотря на деструктивные методы лечения CIN (2-я группа), персистенция ВПЧ в цервикальном канале выявлена у 17% пациенток, в анальном канале – у 34,1%. Учитывая сходство цервикального и анального эпителия, а также наличие анальной ВПЧ-инфекции у 34,1% пациенток, анальную область можно рассматривать как источник инфекции и реинфекции ВПЧ в первую очередь у пациенток, имеющих анальные половые контакты.

Результаты нашего исследования показали, что в 3-й группе ВПЧ в цервиксе и в анусе встречался почти в равных случаях (42,8 и 40% соответственно). Наличие остроконечных кондилом аногенитальной области обычно связывают с низкоонкогенными типами ВПЧ группы А10. В результате исследования выявлена относительно невысокая частота выявления данной группы вирусов в эпителиях цервикального и анального канала (около 20%), что может быть связано с наличием других низкоонкогенных типов ВПЧ, ассоциированных с остроконечными кондиломами. Однако обращает на себя внимание сопутствующая инфекция другими высокоонкогенными типами ВПЧ (39, 31, 58). Помимо этого, низкоонкогенные типы ВПЧ вызывают кондиломы не только наружных половых органов и перианальной области, но и анальной и интраанальной области. Учитывая высокую частоту встречаемости кондилом и высокую тропность эпителия анальной области к низкоонкогенным типам ВПЧ, можно предположить, что высокая частота рецидивирования остроконечных кондилом влагалища, шейки матки, наружных половых органов и перианальной области может быть связана с наличием не диагностированной анальной ВПЧ-инфекции и интраанальными кондиломами.
С нашей точки зрения женщины с персистенцией ВПЧ инфекции в цервикальном канале (4-я группа) представляют интерес с позиции риска развития не только предрака шейки матки, но и предрака ануса. В цервикальном канале ВПЧ выявлен у 79,3%, чаще встречались 16, 33 и 31-й типы – 27,6%, 20,7%, 17,2% (табл. 2). Нами впервые получены данные не только о высокой частоте встречаемости анальной ВПЧ-инфекции у данной группы – 55,1% (чаще: 16, 31, 66, 53 – 17,2%, 17,2%, 13,8%, 13,8%), но и об аномальной картине при аноскопии с высоким разрешением (у 41,3%). Пациенток с персистенцией ВПЧ в цервикальном канале и анальной области можно рассматривать как группу риска развития ВПЧ-ассоциированных заболеваний аногенитальной области. У данной группы женщин требуется динамическое наблюдение не только за состоянием шейки матки, но и состоянием эпителия анальной области.
В результате проведенного аноскопического исследования установлено, что у пациенток контрольной группы во всех случаях была выявлена нормальная аноскопическая картина. У пациенток исследуемых групп достоверно чаще по сравнению с контрольной группой отмечены слабо выраженные изменения эпителия анальной области (нежный ацето-белый эпителий, остроконечные кондиломы), соответственно по группам в 71%, 65,8%, 81,2%, 50% (табл. 3). Выраженные изменения эпителия анальной области были выявлены у 10,5%, 14,6%, 9,3%, 8,3% соответственно в группах исследования.
Нами были проанализированы клинико-анамнестические параметры для установления зависимости типов ВПЧ и поражения аногенитальной области с учетом факторов риска (табл. 1).
Наши результаты показали, что наиболее значимым фактором риска развития ВПЧ-ассоциированных заболеваний аногенитальной области было наличие анальный половых контактов (р<0,05). Аналогичные данные были получены в исследовании A.C. ElNaggar, J.T. Santoso в США, по результатам которого наиболее значимыми факторами риска развития AIN стали наличие анальных контактов, большое количество половых партнеров, иммуносупрессивные состояния и дисплазия вульвы [12].
Заключение
Таким образом, у пациенток с ВПЧ-ассоциированными заболеваниями аногенитальной области выявлены различия типов ВПЧ в цервикальном канале и анальной области. В цервикальном канале достоверно чаще встречаются ВПЧ группы А9, в анальном – А10 (низкоонкогенные типы ВПЧ). У пациенток с CIN ВПЧ группы А9 достоверно чаще встречались в эпителии цервикального канала, чем в анусе, что позволяет рассматривать наличие CIN как фактор риска поражения анальной области данными типами вируса. Несмотря на деструктивные методы лечения CIN, пациентки подвержены персистенции ВПЧ-инфекции в анальной области и возможной последующей реинфекции цервикального канала. Низкоонкогенные типы ВПЧ вызывают не только кондиломы наружных половых органов и перианальной области, но и анальные и интраанальные кондиломы. Учитывая высокую частоту встречаемости кондилом, можно говорить об определенной тропности эпителия анальной области к низкоонкогенным типам ВПЧ. Персистенцию ВПЧ-инфекции в цервикальном канале и в анальной области можно рассматривать как риск развития неоплазий аногенитальной области, требующую динамического наблюдения не только состояния шейки матки, но и эпителия анальной области. ВПЧ-ассоциированные заболевания шейки матки создают риск инфицирования и развития ВПЧ-ассоциированных заболеваний анальной области. Наиболее значимым фактором риска является наличие анальных половых контактов. Аноскопия улучшает диагностическую точность выявления ВПЧ-ассоциированных заболеваний анальной области у пациенток группы риска. Использование современных молекулярно-биологических методов диагностики ВПЧ-ассоциированных заболеваний аногенитальной области открывает новые возможности в совершенствовании тактики ведения пациенток группы риска, имеет практическое значение и может служить основанием для дальнейших исследований на большом клиническом материале.



