На сегодняшний день заболеваемость раком шейки матки (РШМ) среди женщин репродуктивного возраста продолжает неуклонно расти во всем мире. Согласно данным глобального ресурса эпидемиологии рака Международного агентства по изучению рака (МАИР, IARC) GLOBOCAN в 2020 г. в мире было зарегистрировано 604 127 новых случаев РШМ. В России же по заболеваемости РШМ занимает второе место среди женщин в возрасте до 45 лет и первое место в структуре смертности от рака женщин данной возрастной группы [1].
Инфицирование вирусом папилломы человека (ВПЧ) рассматривается, как основной фактор канцерогенеза шейки матки, так как именно данный вирус способен вызывать предопухолевую и опухолевую трансформацию клеток экзоцервикса. На международном уровне по результатам эпидемиологических исследований из 220 известных генотипов ВПЧ отмечено 13 высоко онкогенных генотипов вируса (4 вида α рода, α9-ВПЧ 16, 31, 33, 35, 52 и 58, α7-ВПЧ 18, 39, 45 и 59, α5-ВПЧ51 и α6-ВПЧ56), интегрирование в хромосому хозяина которых считается приоритетным в индукции канцерогенеза [2–4]. Самым высоким канцерогенным потенциалом обладает ВПЧ 16 типа и выявляется в 60% всех случаев РШМ [2, 5]. ВПЧ обладает уникальным жизненным циклом, в котором важнейшая роль отводится «ранним» вирусным белкам (Е1, Е2, Е6, Е7) [6]. При первичном проникновении вирус инфицирует клетки базального слоя многослойного плоского эпителия, не проникая в нижележащие слои. Вирусные геномы сохраняются в виде эписом в базальном слое; при этом экспрессия вирусных генов жестко контролируется по мере продвижения инфицированных клеток к поверхности эпителия [7]. Онкобелок Е2 регулирует репликацию вирусного генома и транскрипцию онкогенов ВПЧ Е6 и Е7 [8]. В результате интеграции вируса в клеточный геном происходит нарушение открытой рамки считывания E2, потеря функции данного белка, усиление экспрессии онкобелков Е6, Е7, и прогрессирование папилломавирусной инфекции [7]. Сохранение злокачественного фенотипа, нестабильность генома и трансформация первичных кератиноцитов человека в основном обусловлены непрерывной экспрессией белков Е6 и Е7 высоко онкогенных типов ВПЧ.
Таким образом, инфицирование шейки матки высоко онкогенными типами ВПЧ с последующей интеграцией вируса в геном клетки-хозяина, морфологически выражается в развитии преинвазивных повреждений эпителия (цервикальная интраэпителиальная неоплазия (Cervical Intraepithelial Neoplasia, CIN) или плоскоклеточные интраэпителиальные поражения (Squamous Intraepithelial Lesion, SIL): LSIL (low grade squamous intraepithelial lesion – низкая степень интраэпителиального повреждения плоского эпителия) и HSIL (high grade squamous intraepithelial lesion – высокая степень интраэпителиального повреждения плоского эпителия) с возможным прогрессированием в инвазивный РШМ.
От момента первичного инфицирования до прогрессирования в CIN различной степени тяжести проходит от нескольких месяцев до нескольких лет, что в свою очередь доказывает важность своевременного и эффективного мониторинга женщин с папилломавирусной инфекцией. Вместе с тем, нередко процесс перехода в РШМ протекает достаточно стремительно, не укладываясь в четкую структуру поэтапного развития канцерогенеза [9]. С другой стороны, нельзя забывать, что 15–45 лет – это возраст молодых, сексуально активных фертильных женщин, для которых крайне важным является вопрос предохранения от нежелательной беременности, а значит и необходимости эффективного и безопасного метода контрацепции. В настоящее время комбинированные оральные контрацептивы (КОК) продолжают оставаться самым распространенным методом предохранения от нежелательной беременности. По разным оценкам, более 150 млн женщин во всем мире принимают препараты гормональной контрацепции. Эта доля составляет примерно 13% женщин в возрасте от 15 до 49 лет [10]. Проблема онкологической настороженности при назначении, определении длительности приема и динамическом наблюдении женщин, принимающих препараты гормональной контрацепции, по-прежнему остается актуальной.
Целью настоящей работы явилось: оценить частоту и степень тяжести CIN среди ВПЧ-позитивных женщин репродуктивного возраста, принимающих препараты гормональной контрацепции.
Материалы и методы
Исследование проводилось на базе ФГАУ «Лечебно-реабилитационный центр» Министерства здравоохранения Российской Федерации с 2020 г. по май 2021 г. В исследование были включены 163 женщины с папилломавирусной инфекцией в возрасте от 19 до 45 лет, у которых при ВПЧ-типировании были выявлены ВПЧ высокого канцерогенного риска (16, 18, 31, 33, 35, 51, 52, 56, 58). По наличию в анамнезе указаний на прием препаратов гормональной контрацепции было выделено 2 группы: в основную группу были включены 84 (51,5%) ВПЧ-позитивных женщин с подтвержденным контрацептивным анамнезом различной продолжительности; группу сравнения составили 79 (48,5%) ВПЧ-позитивных женщин, которые никогда не принимали препараты гормональной контрацепции.
По результатам анализа контрацептивного анамнеза основной группы, все женщины принимали низкодозированные монофазные пероральные комбинированные (30–35 мкг этинилэстрадиола + гестаген) контрацептивные препараты.
Критерии включения женщин в основную группу: репродуктивный возраст, регулярный менструальный цикл, количество половых партнеров не более трех, отсутствие указаний в анамнезе на инфекции передающиеся половым путем, рецидивирующие воспалительные заболевания шейки матки, наличие позитивного ВПЧ ВКР-теста, гистологически верифицированный диагноз цервикальной неоплазии, прием препаратов гормональной контрацепции (низкодозированные комбинированные оральные контрацептивы, содержащие до 35 мкг этинилэстрадиола+гестаген) 6 и более месяцев в непрерывном режиме, отсутствие в анамнезе указаний на патологию шейки матки, отсутствие позитивного ВПЧ ВКР-теста на момент назначения препаратов гормональной контрацепции, а также заболеваний эндокринной системы.
Критерии включения женщин в группу сравнения те же, что и для основной группы, за исключением отсутствия в анамнезе приема гормональных контрацептивов.
Письменное информированное согласие женщин являлось обязательным условием для участия в исследовании.
Критерии невключения: возраст моложе 18 и старше 45 лет, нерегулярный менструальный цикл, количество половых партнеров более трех, наличие в анамнезе инфекций передающихся половым путем, рецидивирующих воспалительных заболеваний шейки матки, беременность, наличие гормонозависимых заболеваний женских половых органов, заболеваний эндокринной системы, наличие в анамнезе указаний на патологию шейки матки, позитивного ВПЧ ВКР-теста на момент назначения препаратов гормональной контрацепции в основной группе, отказ женщины от участия в исследовании.
Комплексное обследование включало сбор анамнеза, гинекологический осмотр, кольпоскопию, цитологическое исследование соскобов шейки матки и гистологическое исследование биоптатов шейки матки для верификации диагноза, забор материала для ВПЧ-тестирования методом полимеразной цепной реакции (ПЦР). Соскобы эпителия цервикального канала для ПЦР собирали дакроновыми щеточками в пробирки «Эппендорф» объемом 1,5 мл с транспортной средой.
Выявление и генотипирование ДНК ВПЧ проводили методом мультиплексной ПЦР в режиме реального времени (тест-система «АмплиСенс ВПЧ ВКР генотип-FL»; тест-система «АмплиСенс ВПЧ ВКР скрин-титр -FL»). Значение вирусной нагрузки рассчитывали в геномных эквивалентах ДНК ВПЧ/105 клеток в цервикальном соскобе, порог ревалентного количества вируса принимали равным ДНК ВПЧ/105 клеток в цервикальном соскобе. Физический статус ВПЧ был определен у 81 женщины с диагностированной моноинфекцией ВПЧ 16 типа. Эписомальную форму вируса интерпретировали в случае отсутствия области Е6 при наличии области Е1/Е2, смешанную форму – в случае выявления области Е6 при наличии области Е1/Е2, интеграцию ВПЧ в ДНК человека – при выявлении области Е6 и отсутствии области Е1/Е2.
Для верификации CIN была проведена оценка результатов гистологического исследования биоптатов шейки матки у женщин двух групп. По степени тяжести верифицированной CIN в двух группах было выделено по 2 подгруппы – LSIL (CIN I) и HSIL (CIN II–III). В основной группе средний возраст женщин, у которых была верифицирована CIN, – 32,3 (4,9) лет, в подгруппах LSIL – 35,1 (6,5) лет; HSIL – 31,8 (4,5) лет. В группе сравнения средний возраст женщин с верифицированной CIN составил 33,2 (5) лет, в подгруппах LSIL – 28,2 (4,3) лет; HSIL – 35,6 (3,5) лет.
Статистический анализ
Статистический анализ полученных данных проводился с использованием компьютерной программы STATISTICA 6.1 (StatSoft), IBM SPSS Statistics 20.0, а также статистических функций программы Microsoft Office Excel 2010. При проверке выборки на нормальное распределение было выявлено, что выборка не является нормальной. Поэтому, при описании количественных данных, использовали медианы (Ме) и интерквартильные интервалы (Q1–Q3). Обработка полученных данных с целью оценки статистической значимости различий в распределении качественных признаков между исследуемыми группами проводили с помощью статистических методов: χ2-тест использовался для определения статистически значимых различий по частоте встречаемости ВПЧ 16 типа в подгруппе женщин с HSIL между основной и группой сравнения; для определения различий частоты выявления 16 типа ВПЧ в форме моноинфекции в подгруппе женщин с HSIL между основной и группой сравнения; для определения различий частоты выявления высокой вирусной нагрузки в подгруппе женщин с HSIL между основной и группой сравнения. Сравнение частоты встречаемости 16 типа ВПЧ среди женщин с HSIL относительно женщин с LSIL, как в основной, так и в группе сравнения определяли с помощью χ2-теста. Для оценки статистически значимых различий частоты развития цервикальной неоплазии между основной и группой сравнения проводился расчет относительного риска (ОР) при 95% доверительном интервале (ДИ).
Критерий Краскела–Уоллиса (Н) использовали для сравнения 3 и более независимых групп по количественным признакам, а именно распределения степени дисплазии и длительности приема препаратов гормональной контрацепции. При проверке статистических гипотез критический уровень значимости р=0,05.
Для оценки статистической значимости различий между двумя независимыми группами применялся непараметрический критерий Манна-Уитни (U критерий). Данный статистический метод применялся для оценки статистической значимости различий распространенности эписомальной, смешанной и интегрированной форм моноинфекции 16 типа ВПЧ в основной и группе сравнения. При проверке статистических гипотез критический уровень значимости р=0,05.
Результаты и обсуждение
Результаты гистологического исследования биоптатов шейки матки у женщин двух групп представлены в таблице 1.
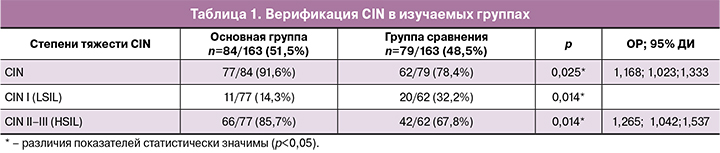
Как видно из представленной таблицы, сравнительный анализ показал статистически значимые различия по частоте развития CIN между основной и группой сравнения (ОР 1,168; 95% ДИ 1,023;1,333; р=0,025).
В ходе изучения контрацептивного анамнеза установлено, что в основной группе средняя длительность приема препаратов гормональной контрацепции в непрерывном режиме среди женщин с LSIL составила 2 года 5 месяцев; среди женщин с HSIL – 3 года 1 месяц. Распределение степени тяжести CIN в зависимости от длительности приема препаратов гормональной контрацепции представлено на рисунке.
В таблице 2 представлены результаты сравнительного анализа распределения степени CIN в зависимости от длительности приема гормонального препарата.
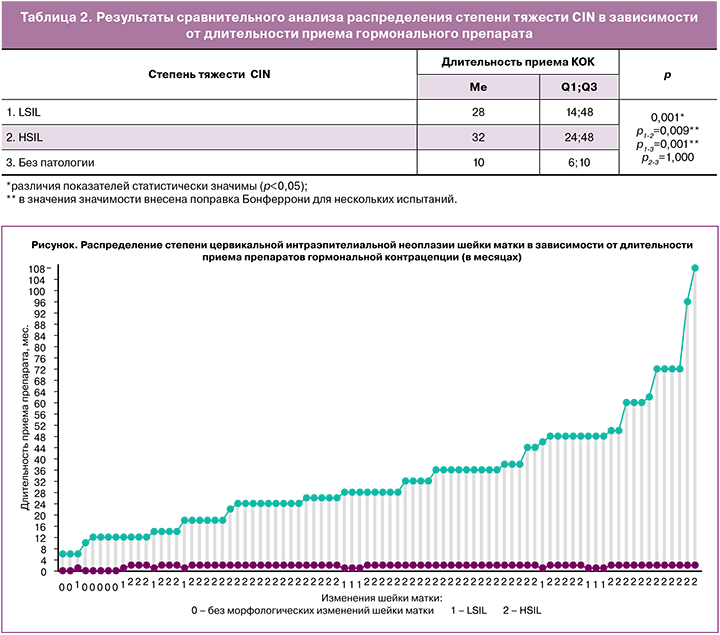
В результате сравнительного анализа были получены достоверные различия по длительности приема гормонального препарата. Была обнаружена достоверная взаимосвязь между длительностью приема гормонального препарата и степенью тяжести CIN; у женщин с CIN тяжелой степени длительность приема гормонального контрацептива была достоверно больше, по сравнению с женщинами, имеющими CIN легкой степени и составила 32 и 28 месяцев, соответственно (р=0,001).
В процессе неопластической прогрессии важно учитывать не только инфицирование онкогенными типами ВПЧ, но и ряд других факторов, которые могут усиливать агрессивное течение данной инфекции, способствуя быстрому развитию злокачественной трансформации инфицированных клеток шейки матки. Одним из таких факторов, вероятно, является гормональная контрацепция. Возможный механизм ассоциации использования КОК и цервикального канцерогенеза заключается в том, что стероидные гормоны, как эстрогены, так и прогестагены, связываются с соответствующими рецепторами шейки матки и меняют течение папилломавирусной инфекции, индуцируя механизм онкогенной трансформации инфицированных клеток [11]. Можно предположить, что прием препаратов данной группы в течение 3-х лет и более способствует ускорению прогрессирования CIN у ВПЧ-позитивных женщин. Наши результаты соответствуют данным литературы: еще в 2000 г. эксперты ВОЗ по вопросам медицинских критериев приемлемости методов контрацепции установили, что длительный прием оральных контрацептивов может ускорять прогрессирование цервикальной неоплазии в микроинвазивную карциному [12]. Данные исследования Bright P.L. et al. (2011) продемонстрировали корреляцию между увеличением диаметра эктопии шейки матки и использованием КОК в течение 12 месяцев [13], что, в свою очередь, способствует мультифокальному поражению штаммами ВПЧ эндоцервикальных крипт [14]. Важно отметить, что сочетание ВПЧ с длительным использованием КОК выделяется, как особенно отрицательный фактор. Smith J.S. et al. обнаружили, что при наличии ВПЧ риск РШМ увеличивался через 5 лет приема КОК с 0,9 до 1,3, а через 10 лет приема КОК составлял уже 2,5. В сравнении, в группе ВПЧ-негативных женщин данный риск увеличивался только через 10 лет приема КОК с 0,9 до 1,3 [15]. Отношение исследователей по всему миру к результатам генотипирования ВПЧ нельзя назвать однозначным. Согласно данным зарубежных авторов J.Sakamoto et al. (2018), Huang et al. (2020), распространенность высоко онкогенных типов ВПЧ встречается с различной частотой среди женщин всех стран, однако, 16 тип ВПЧ доминирует у женщин с CIN высокой степени. Обладая самым высоким канцерогенным потенциалом, 16 тип ВПЧ обуславливает развитие до 70% всех случаев предраковых поражений шейки матки и инвазивных форм РШМ [2, 16]. Корреляция между частотой обнаружения ДНК ВПЧ 16, 18 типов и степенью неопластических изменений шейки матки не вызывает сомнений и увеличивается прямо пропорционально степени неопластических изменений в цервикальном эпителии, составляя при LSIL 16–32%; при HSIL – 41–67% [17]. Полученные нами результаты по распространенности 16 типа ВПЧ при цервикальных поражениях согласуются с общепринятыми: как в основной, так и в группе сравнения отмечалось четкое превалирование 16 типа ВПЧ среди женщин с HSIL относительно женщин с LSIL (табл. 3).
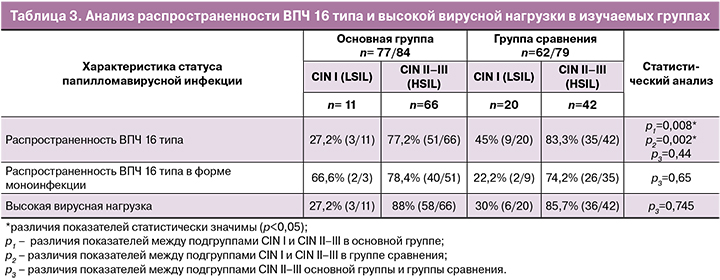
Статистически значимых различий по частоте встречаемости ВПЧ 16 типа в подгруппе женщин с HSIL между основной и группой сравнения не получено (р3=0,44). При этом, во всех исследуемых группах 16 тип ВПЧ был выявлен в форме, как моноинфекции, так и в сочетании с другими типами; однако в изучаемых подгруппах женщин с HSIL было отмечено доминирование ВПЧ 16 типа в форме моноинфекции. Статистически значимых различий по частоте выявления 16 типа ВПЧ в форме моноинфекции в подгруппе женщин с HSIL между основной и группой сравнения не получено (р3=0,65). В результате определения вирусной нагрузки было выявлено: в основной группе частота высокой вирусной нагрузки для женщин из подгруппы HSIL, по сравнению с LSIL увеличивается; аналогичная тенденция прослеживалась в группе сравнения.
В ходе анализа не было выявлено статистически значимых различий по частоте выявления высокой вирусной нагрузки для женщин из подгруппы HSIL между основной и группой сравнения (р3=0,745). Учитывая тот факт, что эпителий шейки матки является эстрогенчувствительной тканью, было высказано предположение, что компоненты оральных контрацептивов способны изменять метаболическую и пролиферативную активность инфицированных клеток эпителия шейки матки. Samir R. et al. обнаружили, что механизм цервикального канцерогенеза при использовании КОК может быть спровоцирован сверхпродукцией циклооксигеназы-2 и повышением уровня интерлейкина-10 [18]. Избыточная экспрессия циклооксигеназы-2 является плохим прогностическим маркером при РШМ, который связан с повышенным риском развития рецидива и метастазирования опухоли [19], поскольку обуславливает подавление апоптоза и усиление инвазии опухоли в лимфатические узлы и параметрий [20]. Изучение изменения метаболической активности инфицированных клеток цервикального эпителия под воздействием оральных контрацептивов показало, что в клетках с активной экспрессией онкобелков ВПЧ наблюдается высокий уровень синтеза 16α-гидроксистерона, сравнимый с таковым в раковых клетках молочной железы. Один из основных путей малигнизации цервикальных клеток, инфицированных ВПЧ, заключается в том, что вирус модифицирует клеточный метаболизм и клетка приобретает способность обеспечивать конверсию эстрадиола в «агрессивный метаболит» 16α-гидроксистерон, который является непосредственным активатором экспрессии онкогена Е7, ответственного за злокачественную трансформацию цервикальных клеток [21].
В настоящее время большинство исследователей сходятся во мнении, что препараты гормональной контрацепции действуют как промоторы ВПЧ-индуцированного канцерогенеза, так как под действием половых стероидов происходит усиление экспрессии ВПЧ 16 онкогенов Е6 и Е7, которые инактивируют супрессорные белки р53 и белок ретинобластомы, повышая способность вирусной ДНК трансформировать клетки и индуцировать процесс онкогенной трансформации инфицированных клеток [11, 22].
Для анализа распределения частот эписомальной, смешанной и интегрированной форм ВПЧ была обследована 81 женщина с моноинфекцией ВПЧ 16 типа: в основной группе 4/84 (4,7%) женщины без морфологических изменений шейки матки, 2/84 (2,4%) женщины с LSIL и 40/84 (47,6%) женщин с HSIL; в группе сравнения 7/79 (8,8%) женщин без морфологических изменений шейки матки, 2/79 (2,5%) женщины с LSIL и 26/79 (33%) женщин с HSIL. Мы провели сравнительный анализ распространенности физического статуса ВПЧ 16 типа в форме моноинфекции: эписомальной формы, смешанной и интегрированной форм в основной группе и в группе сравнения. Результаты сравнительного анализа по распространенности эписомальной формы ВПЧ 16 типа в форме моноинфекции в обеих группах представлены в таблице 4.
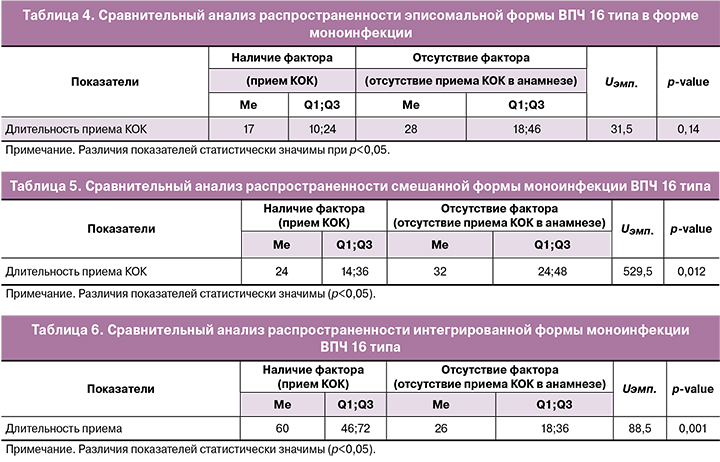
Значимых различий по распространенности эписомальной формы ВПЧ 16 типа между основной и группой сравнения не было получено. Таким образом, длительность приема препарата гормональной контрацепции не влияет на развитие эписомальной формы моноинфекции ВПЧ 16 типа.
При проведении сравнительного анализа распространенности смешанной формы моноинфекции ВПЧ 16 типа нами были получены иные результаты. Как видно из таблицы 5, наличие смешанной формы ВПЧ 16 типа в форме моноинфекции зависит от длительности приема контрацептивного препарата (Uэмп.=529,5, при р=0,012). Таким образом, можно предположить, что при длительном приеме КОК реже встречается смешанная форма ВПЧ 16 типа.
Распространенность интегрированной формы моноинфекции ВПЧ 16 типа зависит от длительности приема препарата гормональной контрацепции (Uэмп.=88,5, при р=0,001) (табл. 6).
Таким образом, по итогам проведенного нами исследования можно предположить, что длительный прием препаратов гормональной контрацепции среди женщин, инфицированных ВПЧ 16 типа в форме моноинфекции, способен влиять на физический статус папилломавирусной инфекции и ускорять ее прогрессирование до интегрированной формы.
Заключение
Частота выявления тяжелой степени CIN у женщин, инфицированных высоко онкогенными типами ВПЧ, была достоверно выше при длительном приеме препаратов гормональной контрацепции. В связи с чем, остается актуальной проблема внедрения в широкую клиническую практику профилактических мероприятий в отношении папилломавирусной инфекции и РШМ, которые включают качественную и количественную диагностику ВПЧ, онкоцитологическое исследование соскобов шейки матки перед назначением препаратов гормональной контрацепции, а также динамически в период приема препаратов данной группы. Данные мероприятия, в свою очередь, обеспечат возможность своевременного и эффективного контроля за возможным инфицированием ВПЧ ранее ВПЧ-негативных женщин, динамикой течения данной инфекции среди ранее инфицированных пациенток, принимающих препараты гормональной контрацепции, для снижения рисков неопластической прогрессии и развития инвазивных форм РШМ.



