По данным ВОЗ 2020 г., рак шейки матки (РШМ) занимает 4-е место по распространенности среди злокачественных образований женской репродуктивной системы. Ежегодно в мире регистрируется более 50 млн новых случаев и 27 млн смертей, связанных с РШМ [1]. Согласно рекомендациям Российского общества клинической онкологии (RUSSCO) и Ассоциации онкологов России (АОР), оценка стадии РШМ проводится по рекомендациям Международной федерации гинекологии и акушерства (FIGO, 2018) и Международной классификации стадий злокачественных новообразований (TNM, 2016).
Стандартом ранней диагностики РШМ являются цитологическое исследование цервикальных мазков и гистологическое исследование биоптатов шейки матки. Выживаемость пациенток с РШМ тесно связана с распространенностью опухолевого процесса, а стадия заболевания определяет метод лечения [2]. Благодаря усовершенствованию диагностических инструментов все чаще РШМ выявляется на ранних стадиях у более молодых пациенток, желающих сохранить фертильность, позволяя проводить менее радикальные операции. Лучевая неинвазивная визуализация играет важную роль в планировании лечения.
Наиболее часто используемые методы диагностики при РШМ – ультразвуковое исследование (УЗИ), магнитно-резонансная томография (МРТ), мультиспиральная компьютерная томография (МСКТ), позитронно-эмиссионная томография (ПЭТ-КТ). Современные методы лучевой диагностики дают возможность с высокой достоверностью оценивать распространенность опухолевого процесса на дооперационном этапе [3, 4].
Обновленная версия стадирования FIGO (2018) по возможности позволяет определять/изменять стадию заболевания на основе результатов визуализации. Руководство ESUR (European Society of Urogenital Radiology, Европейское общество урогенитальной радиологии) 2019 г. определяет место и роль МРТ в диагностике РШМ с учетом этих изменений.
Многие авторы подчеркивают значимость МРТ как предпочтительного метода в диагностике РШМ ввиду его высокой информативности в оценке распространенности опухолевого процесса, наличия и глубины инфильтрации стромы шейки матки, поражения параметральной клетчатки, инфильтрации мочевого пузыря и прямой кишки, а также наличия метастатически измененных лимфатических узлов (ЛУ) [5].
Визуализация на этапе первичной диагностики рака шейки матки
УЗИ является широкодоступным методом визуализации в диагностике РШМ. При этом надежность ультразвуковой диагностики зависит от опыта и навыков специалиста; проводится трансвагинальным, трансабдоминальным и трансректальным способом. Общепризнанным является преимущество трансвагинального метода.
В проспективном многоцентровом клиническом исследовании Epstein E. et al. определили диагностическую точность УЗИ в предоперационной оценке РШМ. В работе проанализировали следующие параметры: размер опухоли, глубину инвазии, параметральную инвазию. УЗИ продемонстрировало хорошие результаты в выявлении опухоли, оценке стромальной и параметральной инвазий (kappa values 0,82, 0,81 и 0,75 соответственно) и показало высокую информативность в оценке остаточной опухоли после проведенного лечения (p<0,001) [6]. При этом УЗИ имеет ограничения в выявлении глубокого поражения таза, метастатических ЛУ. Так, в исследовании Testa A.C. et al. УЗИ не выявило до 91% метастазов в ЛУ [7].
Согласно рекомендациям мировых сообществ (АОР, RUSSCO, ESGO, ESMO, ESR, ASTRO, ACR), МРТ является «золотым стандартом» оценки местной распространенности РШМ при первичном стадировании, планировании и оценке эффективности химиолучевой терапии.
МСКТ имеет ограниченную информативность в оценке степени опухолевого процесса, локального поражения и метастатических ЛУ ввиду низкого разрешения мягких тканей, основанной на рентгенологической плотности (шкала единиц Хаунсфилда). Чувствительность и специфичность МСКТ в оценке параметральной инвазии и поражения ЛУ не превышает 14–55% (77–100%) и 31–58% (92–97%) соответственно [8, 9]. При этом установлено, что МСКТ надежна при выявлении инвазии мочевого пузыря с чувствительностью 100% и специфичностью 92% [10].
Анализ данных диагностической эффективности МСКТ и МРТ с целью изучения параметральной инвазии, инвазии мочевого пузыря и прямой кишки, а также поражения ЛУ показал более высокую чувствительность в оценке параметральной инфильтрации с использованием МРТ, чем с МСКТ: 74% (95% ДИ: 68–79%) и 55% (95% ДИ: 44–66%) соответственно; чувствительность МРТ выше при поражении ЛУ по сравнению с МСКТ: 60% (95% ДИ: 52–68%) и 43% (95% ДИ: 37–57%) соответственно; чувствительность МРТ в оценке инвазии мочевого пузыря и прямой кишки также была выше, чем при МСКТ: 75% (95% ДИ: 66–83%) и 71% (95% ДИ: 53–83%) для МРТ по сравнению с 64% (95% ДИ: 39–82%) и 45% (95% ДИ: 20–73%) для МСКТ [11].
Ввиду ограниченного пространственного разрешения ПЭТ-КТ имеет значительные ограничения в оценке локальной распространенности опухоли в рамках стадирования РШМ, но рекомендуется пациенткам с размером опухоли более 4 см (T1b3) в связи с высоким риском метастатического поражения ЛУ и наличия отдаленных метастазов. ПЭТ-КТ обладает более высокими показателями диагностической информативности для первичной оценки отдаленного опухолевого процесса по сравнению с МСКТ. Около 15% пациенток с РШМ имеют отдаленные метастазы на этапе первичного выявления, наиболее распространенными локализациями являются легкие, кости, печень и головной мозг. Диагностические показатели ПЭТ-КТ в литературе варьируют от умеренных до высоких, при этом показатели специфичности стабильно высоки; так, в исследовании Gee M.S. et al. специфичность ПЭТ-КТ составила 98%, положительная прогностическая ценность – 79% при чувствительности 55% в выявлении отдаленных метастазов (поражение злокачественным процессом брюшной полости, легких костей и т.д.) у пациенток с местно распространенным РШМ.
Эти показатели были стратифицированы по стадии заболевания, чувствительность и специфичность на поздних стадиях заболевания составляют 75% и 95% соответственно, в отличие от 53–73% и 90–97% на ранней стадии заболевания [12].
Возможности магнитно-резонансной томографии в первичной оценке рака шейки матки
Задачами МРТ в диагностике РШМ являются: уточнение распространенности опухолевого процесса для первичного планирования лечения, контроль эффективности проводимого лечения, динамическое наблюдение после его окончания.
В силу высокого естественного мягкотканного контраста МРТ является наиболее информативным методом визуализации в оценке первичной опухоли, а также в оценке промежуточного результата в период лечения [13].
Европейской ассоциацией урогенитальных радиологов (ESUR) (2019) [14] разработаны рекомендации по проведению МР-исследований у пациенток с РШМ. Т2-взвешенные изображения (Т2-ВИ) являются одной из основных последовательностей в протоколе сканирования и выполняются в трех плоскостях (сагиттальной, аксиальной, корональной, последние по оси цервикального канала), что позволяет четко отграничивать опухолевую ткань от стромы шейки матки и окружающих тканей при распространенных процессах. На Т2-ВИ шейка матки характеризуется гиперинтенсивным сигналом слизистой оболочки цервикального канала и гипоинтенсивным сигналом от внутренней фиброзно-мышечной стромы шейки (рис. 1).

При этом реактивные изменения шейки матки, например, перитуморальный отек, характеризуются гиперинтенсивным сигналом на Т2-ВИ и могут быть схожи с опухолью, что приводит к переоценке размеров и определению неправильной стадии заболевания.
Использование диффузно-взвешенных изображений (ДВИ) позволяет дифференцировать злокачественный процесс и реактивные изменения вследствие более выраженного, истинного ограничения диффузии в опухолевой ткани [15].
Характеристику активности диффузии (движения молекул воды) в тканях отражает измеряемый коэффициент диффузии (ИКД). В неизмененных тканях молекулы воды свободно диффундируют, что отражается в виде зон высокой интенсивности на ИКД-картах, следовательно, низкого МР-сигнала на ДВИ с высоким b-фактором. Опухолевая же ткань ввиду компактности расположения клеток, высокого ядерно-цитоплазматического индекса характеризуется ограничением движения молекул воды и зонами пониженной интенсивности на ИКД-картах [16]. Следует помнить, что геморрагический и септический компоненты, а также гранулематозное воспаление тоже характеризуются зонами истинного ограничения диффузии [17, 18].
Для оценки максимального размера опухоли рекомендуется использовать Т2-ВИ и ДВИ. Опухоль следует измерять в плоскости, которая отражает наибольший ее размер. В оценке распространенности опухолевого процесса одним из ключевых критериев помимо определения размеров новообразования является вовлечение верхней и средней трети влагалища и параметральной клетчатки. В оценке параметральной инвазии чувствительность и специфичность МРТ составляют 71–75% и 91–99% соответственно. Интактный ободок стромы шейки матки с низкой интенсивностью сигнала (ИС) вокруг опухоли на Т2-ВИ с высокой достоверностью свидетельствует об отсутствии параметральной инвазии. Специфичность оценки инвазии в параметрий в комбинации Т2-ВИ и ДВИ выше, чем при Т2-ВИ (97–99% и 85–89% соответственно) [19, 20]. Благодаря этому различию можно дифференцировать опухоль в пределах параметрия от перитуморального отека или фиброза [21, 22].
Вовлечение в опухолевый процесс верхней и средней третей влагалища классифицируется как IIА стадия, тогда как поражение нижней трети влагалища – как IIIA стадия. МР-признаком поражения влагалища считается визуализация опухолевой инфильтрации с более высокой ИС по сравнению со стенкой влагалища, имеющей низкую ИС на Т2-ВИ [23]. Для детальной оценки вовлечения и глубины инфильтрации стенки влагалища можно использовать контрастирование ультразвуковым гелем, при этом, согласно рекомендациям ESUR, его применение опционально.
Распространение опухоли на стенку таза и/или гидронефроз и нефункционирующая почка свидетельствуют о IIIB стадии. Поражение стенки таза определяется при наличии гидронефроза (вследствие нарушения оттока, вызванного опухолевой инфильтрацией мочеточника, с формированием супрастенотического расширения) либо инфильтрации опухолью мышц таза или подвздошных сосудов, визуализация контура опухоли на расстоянии 3 мм и менее от стенки. Инвазия слизистой оболочки мочевого пузыря или прямой кишки соответствует IVA стадии.
Вовлечение ЛУ является важным прогностическим фактором при РШМ, что привело к изменениям в системе стадирования FIGO (2018) – выделению стадии IIIC, которая отражает поражение парааортальных и/или тазовых ЛУ, независимо от размера опухоли и степени локальной инвазии, и подразделяется на IIIC1 – поражение тазовых ЛУ и IIIC2 – поражение парааортальных ЛУ. Индексы «r» и «p», внедренные в обновленную версию классификации, свидетельствуют о способе оценки ЛУ («r» – при визуализации, «p» – при патоморфологическом исследовании) [24].
Невзирая на то, что МРТ является наиболее надежным методом в оценке размера опухоли и локальной инвазии, она имеет ограниченную чувствительность в выявлении метастатических ЛУ. В оценке ЛУ обращают внимание на форму и контуры узла, толщину и однородность кортекса, наличие некроза. Причиной умеренной чувствительности МРТ является то, что изменения структуры не всегда специфичны, достоверно пораженные ЛУ можно оценить по их размеру, который может быть нормальным при начальной инфильтрации [25]. Чувствительность и специфичность МРТ в выявлении опухолево-измененных ЛУ варьирует в широких пределах и составляет 38–89% и 78–99% соответственно, существенно уступая ПЭТ-КТ [26].
Виды, критерии выбора метода лечения, оценка возможности выполнения органосохраняющей операции
Лечение пациенток с РШМ включает в себя изолированное использование и различные комбинации хирургического вмешательства, лучевой и химиотерапии. В большинстве случаев пациентки с ранними стадиями заболевания (IAI–IIAI) имеют хорошие результаты лечения как при радикальных хирургических методах, так и при использовании сочетанной лучевой терапии; показатель общей 5-летней выживаемости составляет более 93% [27].
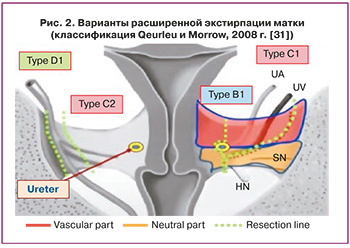
При этом, согласно данным современной литературы, проведение радикального хирургического лечения при ранних стадиях РШМ имеет значительные преимущества перед лучевой терапией. Ведущие мировые онкологические сообщества рекомендуют хирургическое вмешательство на первом этапе лечения при ранних стадиях РШМ [28, 29]. Стандартом хирургического лечения является расширенная экстирпация матки (операция Вертгейма), целью которой является полное удаление опухоли с окружающей соединительной тканью и клетчаточными структурами [30]. Классификация Qeurleu D. и Morrow C.P. (2008) подразделяет гистерэктомии на 4 типа (тип А – минимальная резекция параметриев, тип В – резекция параметриев на уровне мочеточников, тип С – резекция параметриев на уровне внутренних подвздошных сосудов, тип D – расширенная резекция параметриев, рис. 2) [31].
Выбор тактики лечения определяется индивидуально и зависит от распространенности опухолевого процесса, сопутствующей патологии, возраста и желания сохранить репродуктивную функцию [32]. Возможность сохранения фертильности является одной из важных тем в онкогинекологии, и в частности при РШМ (таблица). Так, у пациенток репродуктивного возраста, желающих сохранить фертильность, возможно проведение органосохраняющих операций, которые могут быть выполнены без ущерба для онкологических и акушерских исходов. При РШМ in situ и IA1 стадии возможно проведение петлевой электроэксцизии или ножевой конизации с последующим выскабливанием цервикального канала при условии, что максимальная глубина инвазии опухоли составляет ≤3 мм, при отсутствии инвазии в лимфоваскулярное пространство [33].
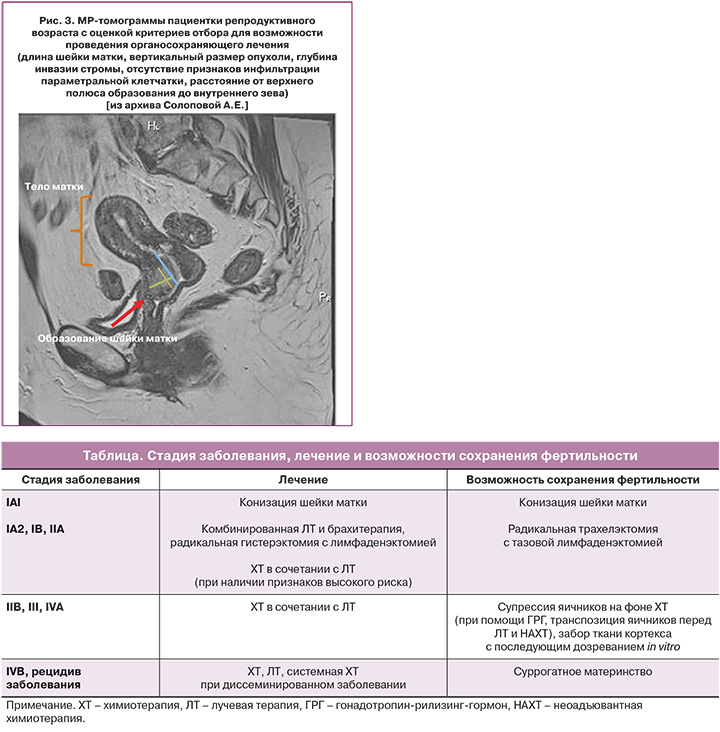
При наличии лимфоваскулярной инвазии возможно проведение радикальной трахелэктомии с удалением тазовых ЛУ. Критериями отбора при РШМ для проведения органосохраняющего лечения являются размер опухоли ≤2 см при длине шейки матки >2,5 см, расстояние от опухоли до внутреннего зева ≥1 см, гистологический тип опухоли (аденокарцинома, плоскоклеточный рак) (рис. 3).
Оценка эффективности и мониторинг после проведенного лечения
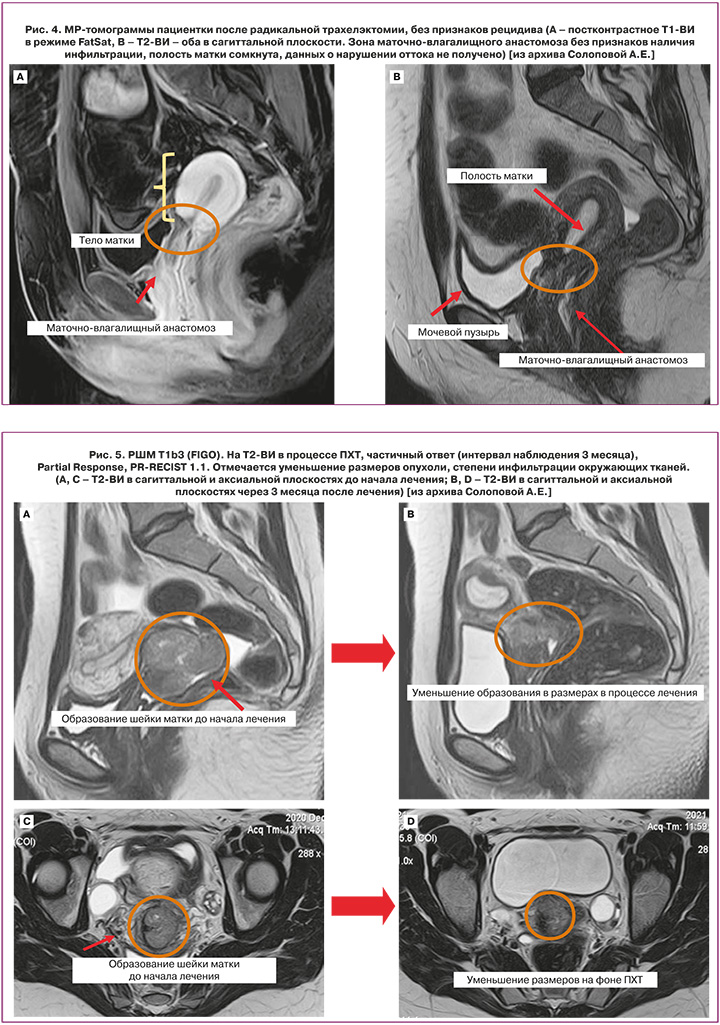
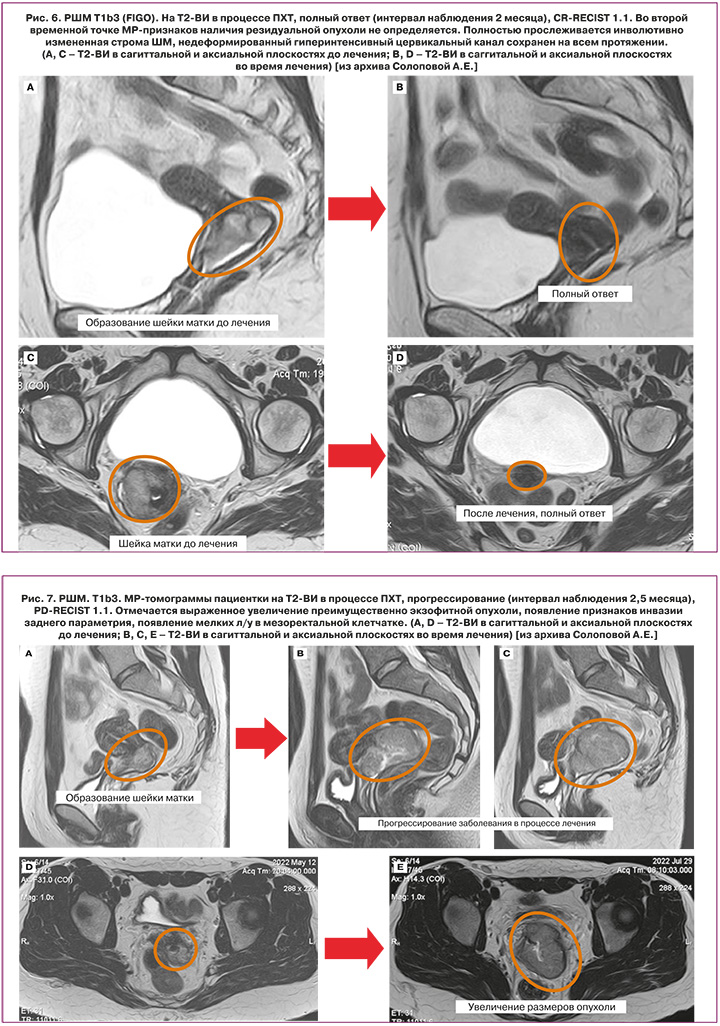
Оценка эффекта от проведенного лечения во многом зависит от его характера, причем точные сроки определены не для всех его вариантов. Согласно рекомендациям ESUR, NCCN, после проведения органосохраняющего хирургического лечения МР-контроль проводится каждые 6 месяцев. При оценке маточно-влагалищного анастомоза после расширенной абдоминальной трахелэктомии помимо исключения рецидива заболевания необходимо исключить наличие осложнений, наиболее важными из которых являются: формирование свищей, стеноз неоцервикса; кроме того – исключение возникновения лимфокист в зоне подвздошной лимфаденэктомии (рис. 4.) В ряде случаев (как один из возможных методов терапии при IB2, IIA2, IIB стадиях) тактика лечения подразумевает проведение НАХТ с последующим выполнением радикального лечения. На рисунках 5–7 представлены варианты ответа опухоли на полихимиотерапию.
Оценка эффективности химиолучевой терапии
Пациенткам, отобранным для химиолучевой терапии (ХЛТ), выполнение МРТ облегчает планирование лучевой терапии. МРТ в период ХЛТ (после 5 недель одновременной химиотерапии цисплатином с внешней лучевой терапией, перед брахитерапией) позволило корректировать дозу брахитерапии пропорционально объему остаточной опухоли. Такая возможность снижает токсичность и улучшает выживаемость [34].
МРТ после проведения ХЛТ выполняют через 3–6 месяцев после завершения ХЛТ. Восстановление стромы шейки матки с низкой ИС на Т2-ВИ указывает на полный ответ; при этом сохраняющаяся повышенная ИС в ряде случаев свидетельствует не о наличии остаточной опухоли, а о присутствии отека, реактивного воспаления на фоне развивающихся некротических изменений после проведения лечения, которая может сохраняться до и более 6 месяцев, что определяет ограничения по срокам оценки ответа [35, 36]. При оценке ответа на ХЛТ МРТ позволяет на ранних стадиях прогнозировать неэффективность терапии и в последующем может использоваться для выявления местного рецидива опухоли. Объективный ответ определяется путем оценки размера опухоли и ИС шейки матки. Ответившая на лечение опухоль шейки матки сокращается и замещается зонами фиброзирования и некрозов, что отражается изменением ИС, отсутствием ограничений диффузии в структуре. Некоторые авторы рекомендуют выполнение МРТ через 4 недели после ХЛТ с целью ранней оценки ответа, но большинство учреждений, в т.ч. согласно рекомендациям ESUR, NCCN, рекомендуют проводить ее после завершения лечения через 3–6 месяцев [37].
Прогнозирование ответа на терапию
Эффективность лечения РШМ зависит от многих прогностических факторов, к которым относятся стадия заболевания, размер опухоли, наличие лимфоваскулярной и стромальной инвазий, метастатически измененные ЛУ. Влияние гистологического типа опухоли на течение заболевания остается спорным вопросом, однако доказано, что редкие опухоли, например, нейроэндокринный рак, характеризуются неблагоприятным прогнозом.
Возможности ДВИ МРТ являются областью активных исследований в оценке ответа опухоли на лечение. ДВИ может улучшить выявление остаточной опухоли, которая проявляется высокой ИС (при оценке нативных изображений с высоким b-фактором) и низким ИКД. На сегодняшний день авторами опубликован ряд работ (9 исследований с 2013 г.) об оценке значения ИКД до начала лечения как предиктора развития рецидива и выживаемости.
Крайне ограниченными в количестве, но очень перспективными являются исследования возможностей прогнозирования непосредственного ответа РШМ на лечение. В одном из них (2021 г.) пороговые значения ИКД до начала лечения ниже 0,936 и выше 1,197 достоверно коррелировали с высокой и низкой чувствительностью к ПХТ соответственно (р<0,05) [38].
Параметры динамического контрастного усиления (ДКУ) также имеют прогностическое значение – низкая перфузия опухоли (отражающая гипоксию) как до, так и во время лечения коррелирует с худшим прогнозом, а увеличение перфузии во время ХЛТ, по сравнению с исходным уровнем, связано с благоприятным исходом.
В исследовании Lu H. et al. проводилась оценка параметров ДКУ и их изменений в раннем ответе на лечение. Пациенткам выполнялась ДКУ-МРТ до (pre), во время (mid) и после (post) лучевой терапии с последующей количественной оценкой параметров перфузии в опухоли: объемный коэффициент переноса из кровеносного сосуда во внеклеточный матрикс – Ktrans (англ. volumetric transfer coefficient), коэффициент, определяющий обратное перераспределение контрастного препарата между кровеносным сосудом и внеклеточным внесосудистым пространством, – Kep (англ. the rate constant) и внеклеточное объемное соотношение – Ve (англ. extracellular volume). По результатам работы были выявлены значительные различия в показателях ΔKtrans-post-preTx, ΔKtrans-post-midTx, ΔKep-post-preTx, ΔKep-mid-preTx и ΔKep-post-midTx в группах с полным и неполным ответом на лечение. Эффективность данных параметров оценивалась с помощью ROC-анализа. Модель логистической регрессии анализа роли комбинированных параметров, включая Ktrans-postTx, Kep-postTx, Ve-midTx, ΔKtrans-post-preTx, ΔKtrans-post-midTx, ΔKep-post-preTx, ΔKep-mid-preTx и ΔKep-post-midTx, показала AUC 0,952 с чувствительностью 87,1% и специфичностью 96,1% соответственно [39].
Однако на сегодняшний день нет единого мнения о стандартизации параметров и анализа ДКУ; в связи с этим использование ДКУ является опциональным (ESUR, 2021).
В настоящее время проводятся работы по оценке потенциала радиомики как новой области научных интересов, которая обеспечивает выделение множественных количественных характеристик, визуальных характеристик тканей на основе клинических изображений. Развитие радиомики может способствовать повышению воспроизводимости и точности использования данных: от технических аспектов непосредственно к клиническим исходам, в перспективе дополняя фундаментальные знания о биологии опухоли и ее молекулярном окружении и позволяя разрабатывать персонализированные стратегии лечения на основе прогнозирования ответа опухоли на терапию [40].
Характеристика рецидивов опухолевого процесса и оценка осложнений после лечения рака шейки матки
Частота возникновения рецидивов при IB и IIA стадиях РШМ составляет 11–22%, а при IIB и IVA стадиях – 30–64%. Большая их часть приходится на первые 2 года после первоначального лечения, до 40% – на первый год [41]. К факторам неблагоприятного прогноза и высокого риска развития рецидива РШМ относятся: распространенная стадия опухолевого процесса, наличие метастазов в регионарных и отдаленных ЛУ, гистологический вариант опухоли (такие редкие опухоли, как нейроэндокринный рак), глубина стромальной инвазии, размер опухоли, состояние линии резекции, наличие параметральной инвазии, наличие периневральной, лимфоваскулярной инвазии, особенности проведенного лечения [27]. Для выявления тазовых рецидивов наиболее предпочтительным методом является МРТ. Сроки проведения зависят от метода лечения: через 6 месяцев после хирургического лечения либо через 3–6 месяцев после завершения ХЛТ и далее 1 раз в год в течение 3 лет [36].
Выделяют следующие виды рецидивов: локальный центральный рецидив РШМ (рис. 8), возникающий в месте расположения первичной опухоли; локорегиональный и отдаленное метастазирование. Наиболее частыми локализациями рецидивов являются свод влагалища/купол культи влагалища, шейка матки (после лучевой терапии), ЛУ и отдаленные метастазы.

Рецидивная опухоль, как правило, характеризуется промежуточной ИС на Т2-ВИ, в то время как фиброз/рубцовые изменения после лечения определяют низкую ИС на T2-ВИ (близкую к скелетным мышцам). Отек, воспаление и постнекротические изменения после лечения могут сохраняться в течение нескольких месяцев после ХЛТ, что затрудняет интерпретацию T2-ВИ. Комбинация Т2-ВИ и ДВИ может обеспечить более надежную диагностику рецидива опухоли по сравнению только с T2-ВИ, при визуализации мелких рецидивных зон инфильтрации значение приобретают постконтрастные серии.
Не менее актуальными задачами лучевой диагностики являются исключение и корректная оценка осложнений после лечения. Одним из важных осложнений после лучевой терапии является цервикальный стеноз; как правило, это случается через 6–9 месяцев после начала лечения и проявляется болями в животе и выделениями из влагалища. Стеноз цервикального канала, как правило, является результатом фиброзирования стромы шейки матки после лучевой терапии, что характеризуется диффузно низкой интенсивностью Т2-взвешенного сигнала без ограничения диффузии в структуре в отличие от стеноза ввиду инфильтрации опухолью. Цервикальный канал определяется парциально или не визуализируется вовсе, развивается нарушение оттока из полости матки, вызывая формирование гемато/серозометры.
Фиброз и некротические изменения в зоне воздействия лучевой терапии могут привести к образованию свищей; их также важно дифференцировать с рецидивом заболевания и инфильтрацией соседних органов. Наиболее распространенными типами свищей после лучевой терапии РШМ являются пузырно-влагалищные и ректовагинальные свищи. При этом МРТ является методом выбора для точного определения течения, степени и сложности вагинальных свищей, а также для определения основной причины их формирования (рис. 9).
Заключение
Неинвазивная визуализация занимает одну из ключевых ролей в комплексном диагностическом алгоритме до и в процессе противоопухолевого лечения больных РШМ. Задачи МРТ на этапе первичной диагностики состоят в оценке местного распространения опухолевого процесса и метастатического поражения на уровне малого таза, в то время как роль ПЭТ-КТ определяется оценкой наличия и характеристикой отдаленного метастазирования, поражения ЛУ для выбора оптимальной тактики ведения пациенток.
Вместе с тем у молодых женщин, желающих сохранить фертильность, может быть выполнено органосохраняющее лечение; основной задачей МРТ при этом становится детальная оценка размеров, степени инфильтрации, локализации опухоли для определения возможностей радикального ее удаления и условий для формирования полноценного маточно-влагалищного анастомоза.
На этапе планирования ХЛТ МРТ позволяет корректировать дозу брахитерапии пропорционально объему опухоли, что снижает токсичность и влияет на выживаемость; кроме того, помимо оценки эффективности, перспективной представляется возможность прогнозировать неэффективность терапии на ранних этапах лечения.
Пересмотренная версия FIGO (2018) предусматривает детальную оценку опухоли с целью точного определения распространения заболевания, оценки факторов прогноза, необходимой для планирования лечения. В соответствии с внесенными изменениями визуализация приобретает ведущую роль в определении стадии процесса.
Кроме того, дальнейшее изучение диагностических возможностей, и в частности прогнозирование ответа на проводимую терапию до ее начала, определяет новые перспективы использования, однако требует дальнейшего всестороннего изучения.



