Рак шейки матки (РШМ) занимает 2-е ранговое место в структуре онкогинекологической патологии и 5-е ранговое место в структуре злокачественных образований среди женского населения [1].
Рак тела матки (РТМ) находится на 6-м месте среди злокачественных новообразований женского населения в мире, и его доля составляет 4,8% [1].
В связи с неуклонным ростом данных заболеваний важнейшей задачей современной онкогинекологии является повышение качества доклинической диагностики прогрессирования и рецидивирования РШМ и РТМ.
По данным Нечушкиной В.М., частота рецидивирования РТМ при I стадии заболевания составляет 15,9%, а при II стадии — 30,1% [2].
Доклиническая диагностика рецидивов и метастазов РШМ и РТМ после оперативного лечения крайне важна для повышения выживаемости пациенток, а также для улучшения качества их жизни [3, 4].
Ультразвуковое исследование (УЗИ) является одним из распространенных методов диагностики онкогине- кологической патологии благодаря неинвазивности, доступности и многократности применения.
Благодаря применению комплексного УЗИ у пациенток с заболеванием шейки и тела матки становится возможным визуально оценить эхографическую структуру, форму, контуры шейки и тела матки, определить размер и объем; при наличии местнораспространенного процесса оценить степень вовлеченности в опухолевый процесс близлежащих структур, а также степень васкуляризации и жесткость тканей в зоне интереса.
Постоянно в арсенале ультразвуковых технологий появляются новые методики, позволяющие расширить и повысить качество визуализации. К одной из таких методик относится эластография (ЭГ), позволяющая оценить жесткость тканей путем «ультразвуковой пальпации» в режиме реального времени неинвазивным способом.
Цель исследования: определить ультразвуковые критерии прогрессирования РШМ и РТМ у пациенток после хирургического и комплексного лечения в процессе динамического наблюдения.
Материалы и методы
В настоящее исследование включены 102 пациентки, находящиеся под контрольным наблюдением в течение 5 лет после оперативного лечения. РШМ диагностирован в 56 (54,9%) случаях, РТМ — в 46 (44,1%).
Средний возраст пациенток с диагнозом РШМ составил 48,9±4,5 года, с диагнозом РТМ — 57,8±3,2 года.
Учитывая выбор проведенного лечения, у пациенток с РШМ, включенных в исследование, в большинстве наблюдений — 56 (54,9%) — выставлена стадия T1b1 (IB1), с диагнозом РТМ — 46 (45,1%) — T1b (IB) стадия.
Преобладающему числу больных — 48 (47,1%) проведено хирургическое лечение в объеме экстирпации матки с придатками и региональной лимфодиссек- ции, комбинированное лечение получили 40 (38,9%) пациенток и комплексное — 14 (13,7%) пациенток.
В процессе динамического мониторинга у 61 (59,8%) пациентки выявлено прогрессирование заболевания. В 41 (30,2%) наблюдении достигнута ремиссия в течение периода наблюдения (более 6 месяцев).
Минимальный срок рецидивирования РШМ и РТМ составил 6 месяцев (n=9 (15,2%)), максимальный период — 6 лет и более (n=4 (6,8%)) после лечения. В среднем у половины наблюдаемых нами пациенток прогрессирование заболевания выявлено в первые 3 года от окончания лечения.
По данным литературы, рецидивы и метастазы РШМ подразделяют на локальные (тазовые), локо- регионарные с наличием опухолевого поражения в малом тазу и в зонах регионарного метастазирования, к которым относятся забрюшинные лимфатические узлы, расположенные вдоль общих, наружных и внутренних подвздошных сосудов [4, 5].
В нашем исследовании в большинстве случаев (38 больных, 62,3%) диагностированы локальные рецидивы РШМ и РТМ, у 12 (19,6%) из этих пациенток вместе с локальной опухолью выявлены метастатически пораженные лимфатические узлы вдоль подвздошных (общих, наружных, внутренних) и поясничных (парааортальных и паракавальных) сосудов.
В 21 (34,4%) наблюдении диагностированы только метастазы в забрюшинных лимфатических узлах. В 18
(29,5%) случаях выявлены отдаленные метастазы (печень, шейно-надключичные лимфатические узлы).
Все выявленные нами рецидивы были цитологически и морфологически подтверждены.
В 9 (27,3%) случаях проведена пункционная биопсия региональных метастазов под ультразвуковым наведением с последующей верификацией. В 22 (66,7%) случаях данные УЗИ подтверждены другими методами визуализации (магнитно-резонансная томография, позитронно-эмиссионная томография).
УЗИ проводили на аппаратах экспертного класса (Hitachi Arietta V70, Toshiba Aplio 500) с высоким качеством визуализации, с применением цветового допплеровского картирования (ЦДК), ЭГ и оценки коэффициента жесткости.
Нами определены следующие зоны исследования с целью оценки эффективности проведенного лечения.
- Забрюшинное пространство, включающее почки с оценкой чашечно-лоханочной системы и мочеточников и забрюшинные лимфатические узлы, расположенные вдоль брюшного отдела аорты, нижней полой вены и по ходу группы подвздошных сосудов.
- Область малого таза (стенки влагалища, прикульте- вая область и прилежащая клетчатка).
Пациентки проходили обследование согласно установленным
временным интервалам: до начала лечения, через 1 месяц, через 3-6 месяцев после лечения, через 1, 1,5 и далее каждый год после окончания лечения.
Оценка ЭГ проведена по классификации, состоящей из 5 эластограмм, адаптированной для гинекологической патологии (табл. 1) [6]. В соответствии с данными классификации жесткие структуры, соответствующие опухоли, картируются 5-м эластотипом (синим цветом).
В дополнение к графическому изображению нами проанализирован коэффициент жесткости, позволяющий получить цифровое значение плотности ткани, что также является важным дополнением в дифференциальной диагностике визуализируемых объемных образований. Для произведения расчета коэффициента жесткости на рабочей сенсорной панели ультразвукового аппарата выбирается соответствующая опция. Вручную устанавливают зону А в патологическом очаге с максимальным ее охватом или нормальной ткани, затем, желательно на том же уровне, устанавливают зону «В» в референтной ткани. Полученный результат диагностический прибор рассчитывает автоматически. Важно отметить, что при применении эластометрии необходимо получить воспроизводимость результата.
Результаты и обсуждение
В ходе нашего исследования выявлено, что для РШМ характерны локальные и локорегионарные рецидивы, в то время как для РТМ специфичны регионарные метастазы. Отдаленные метастазы диагностировались с одинаковой частотой при РШМ и РТМ (табл. 2).
При этом локальные рецидивы РШМ и РТМ после хирургического и/или комплексного лечения имеют схожие ультразвуковые признаки; следовательно, главной задачей диагноста является идентификация наличия опухолевого процесса или подозрения на него.
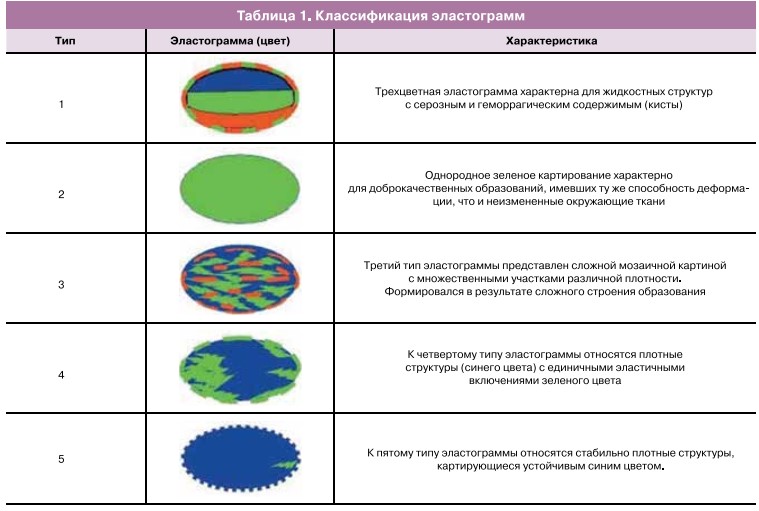
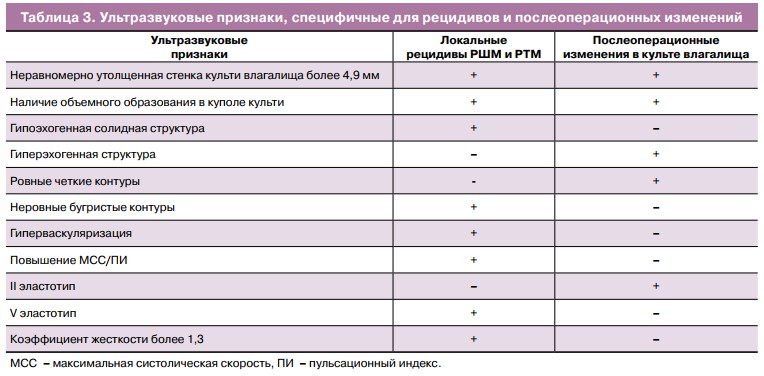
При визуализации изменений, указывающих на наличие локальных рецидивов, характерна неравномерно утолщенная стенка культи влагалища более 5,1 мм. Определяемое объемное образование имеет солидную, гипоэхогенную структуру (рис. 1).
Для сравнения — средняя толщина неизмененной стенки культи влагалища при трансвагинальном исследовании с опорожненным мочевым пузырем составляет 4,1±0,85 мм и имеет четкие ровные контуры.
По результатам исследования, чаще всего локальные рецидивы РШМ и РТМ после хирургического лечения локализуются в куполе культи влагалища — 30 (78,9%). В серошкальном режиме контуры образования в большинстве наблюдений — 31 (81,6%) неровные, нечеткие, в 4 (10,5%) наблюдениях — бугристые и в 3 (7,8%) случаях — лучистые.
При оценке степени васкуляризации в режиме ЦДК наличие диффузной или периферической гиперваскуляризации в области культи влагалища и/или в объемном образовании в прикультевой области во всех наблюдениях (100%) указывало на наличие злокачественных изменений в малом тазу.
При этом в неизмененной стенке культи влагалища в большинстве наблюдений — 30 (73,2%) — регистрировались единичные сосудистые локусы с сохраненным анатомическим ходом сосудов, что соответствовало нормальной ультразвуковой картине.
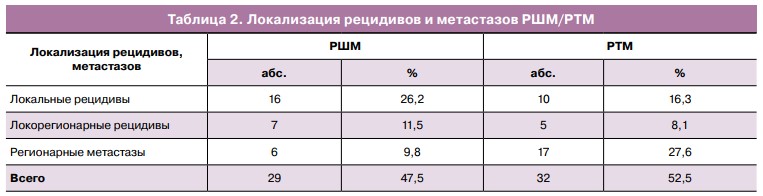
Следующим этапом в процессе мониторинга эффективности проведенного хирургического лечения была оценка в режиме ЭГ с получением эластограмм в соответствии с приведенной выше классификацией. Выявленные нами локальные рецидивы РШМ и РТМ в большинстве наблюдений — 29 (76,3%) — картировались синим цветом (5-й тип эластограммы), это указывало на наличие патологического образования высокой плотности, что специфично для злокачественных процессов (рис. 2).
У пациенток, находящихся в ремиссии, в 22 (73,3%) случаях неизмененная в серошкальном режиме культя влагалища окрашивалась зеленым цветом, что соответствует 2-му типу эластограммы в соответствии с классификацией.
Оценка коэффициента жесткости в локальных рецидивах РШМ и РТМ проведена в 29 (52,1%) наблюдениях. При этом отмечено выраженное отличие числовых значений, полученных при сравнении коэффициента жесткости в опухоли и рядом расположенных тканях. Так, для опухолевой ткани характерны цифровые значения от 4,0 до 5,1 (4,7±0,37), что соответствует высокой жесткости опухоли и подтверждалось синим картированием в режиме ЭГ (5 эластотип).
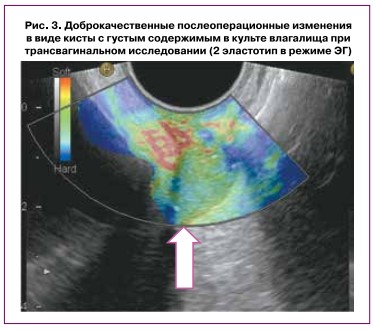
Послеоперационные изменения, такие как кисты с прозрачным и густым содержимым, грануляции, которые увеличили толщину стенки культи влагалища и были подозрительны в плане злокачественного процесса, всегда имели ровные, четкие контуры, правильную форму. В режиме ЦДК васкуляризация не определялась, а в режиме ЭГ всегда был отмечен 2-й эластотип (рис. 3). Все вышеперечисленные ультразвуковые признаки указывали на то, что объемное образование имело доброкачественную природу, что было подтверждено цитологическим исследованием. Наглядно все вышеописанные признаки, характерные для локальных рецидивов и послеоперационных изменений после хирургического (комплексного) лечения, представлены в таблице 3.
В процессе визуализации забрюшинного пространства выявленные нами лимфатические узлы, подозрительные в плане метастатического поражения, имели специфичные признаки: приобретали округлую форму, отсутствовало деление на корковый и мозговой слои, эхо-струкутра была преимущественно гипоэхогенной. Нами были выявлены как единичные патологически измененные узлы, так и цепочки, сливающиеся в конгломераты, расположенные вдоль сосудистых пучков забрюшинного пространства.
Измененные лимфатические узлы чаще всего располагались на уровне I поясничного позвонка (LI) слева от брюшного отдела аорты и/или в аортокавальном промежутке. Их размеры могли варьировать от 0,9 см до 7,6 см.
Наиболее часто метастатически измененные тазовые лимфатические узлы визуализируются в области бифуркации общих подвздошных сосудов и кзади от наружных подвздошных сосудов.
Использование регистрации кровотока в режиме цветовой ангиографии в забрюшинных лимфатических
узлах не дало дополнительной информации. Вероятно, из-за глубины их расположения, скудной васкуляризации кровоток в них не регистрировали. Применение ЭГ также не дополнило результаты серошкального исследования, что, вероятно, также связано с глубиной расположения описанных лимфатических узлов. Ультразвуковые данные были подтверждены гистологическим исследованием метастазов.
При осмотре чашечно-лоханочной системы почек в случае выраженного опухолевого процесса в малом тазу с распространением на прилежащую клетчатку определялось расширение как мочеточников, так и лоханок почек в зависимости от стороны поражения. Данная ультразвуковая картина выявлена нами у 10 (9,8%) пациенток.
Заключение
Таким образом, в ходе нашего исследования выявлены специфичные ультразвуковые признаки как в серошкальном режиме, так и с использованием современных ультразвуковых методик, характерные для локальных рецидивов РШМ и РТМ у пациенток после хирургического и/или комплексного лечения. Данные признаки позволяют как минимум заподозрить и направить на дальнейшее обследова
ние или выявить прогрессирование заболевания до клинических проявлений, что, безусловно, повышает выживаемость данной категории больных.
Помимо вышеописанных признаков, нами приведена дифференциальная диагностика с послеоперационными изменениями, а также нормальная ультразвуковая картина неизмененной стенки культи влагалища, что помогает специалистам снизить уровень ложноположительных результатов.
- Локальные рецидивы РШМ и РТМ утолщают культю влагалища более 5 мм, при этом имеется образование гипоэхогенной солидной структуры с неровными контурами, неправильной формы, при ЦДК с гиперваскуляризацией.
- В режиме ЭГ для рецидивов характерен 5-q эластотип, высокие значения коэффициента жесткости в диапазоне 3,5—5,6.
- Для послеоперационных изменений типичны наличие гиперэхогенных включений (грануляций) в утолщенной культе влагалища либо объемного изо- или анэхогенного образования в прикультевой области (кисты с прозрачным и густым содержимым), при ЦДК описанные изменения аваскуляр- ны. В режиме ЭГ специфичен 2-q эластотип, коэффициент жесткости — 0,9—1,2.
- Неизмененная стенка влагалища не превышает толщину 4,6 мм, могут регистрироваться единичные сосуды в режиме ЦДК, 2-q эластотип, коэффициент жесткости — 0,9—1,2.
- Для регионарных метастазов характерны округлая форма, гипоэхогенная структура, нарушение дифференцировки на анатомические слои (корковый и мозговой). При визуализации данных изменений рекомендовано назначить дополнительный уточняющий метод визуализации (магнитно-резонансная томография с внутривенным контрастированием).
Следовательно, комплексный динамический ультразвуковой мониторинг каждые 3 месяца в течение 2 лет после хирургического лечения в стандартном серошкальном режиме, а также с включением методик ЦДК, ЭГ и эластометрии является надежным способом повышения качества доклинической диагностики локальных рецидивов и регионарных метастазов РШМ и РТМ.



