Рак шейки матки (РШМ) является быстропрогрессирующим заболеванием, которое поражает женщин в различные периоды жизни, включая репродуктивный возраст. Основными этиологическими факторами развития РШМ являются высокоонкогенные типы вируса папилломы человека (ВПЧ) (16, 18, 31, 33, 35, 39, 45, 51, 56, 52, 59, 68) [1]. Персистенция ВПЧ высокого онкогенного риска (ВПЧ ВР) первоначально вызывает плоскоклеточные интраэпителиальные поражения низкой степени (LSIL), которые обусловлены репликацией вируса и обычно устраняются иммунной системой в течение 1 года. Персистенция вируса высокого канцерогенного риска более 24 месяцев может приводить к развитию цервикальной интраэпителиальной неоплазии (CIN). При дальнейшей персистенции ВПЧ-инфекции риск прогрессии заболевания до CIN III в течение 5 лет составляет: при нормальных результатах цитологического заключения (NILM) – 5–7,4%, при ASCUS – 8–10%, при LSIL – 15–17% [2].
Персистенция вируса с длительной активной экспрессией вирусных онкобелков инициирует многостадийный процесс, в результате которого клетки эпителия шейки матки претерпевают изменения, способствующие опухолевой прогрессии [3, 4]. Важную роль в развитии РШМ играют онкобелки Е6 и Е7, которые необходимы для поддержания вирусного генома в клетке. Персистенция является следствием снижения клеточного иммунитета, дефицита местного и общего интерферонов. По данным V. Colmenares et al. [5], ВПЧ способен ингибировать секрецию гамма-интерферона (IFN-γ) и экспрессию некоторых рецепторов иммунных врожденных клеток. Иммуноглобулиноподобный транскрипт 2 (immunoglobulin-like transcript 2, ILT2) является регуляторным рецептором, который, возможно, участвует в патогенезе вирусной инфекции. Индукция иммуносупрессивных цитокинов (IL-10 или TGF-b) является дополнительным механизмом, с помощью которого инфицированные ВПЧ клетки могут избежать иммуноопосредованной элиминации. Значимым фактором является то, что ВПЧ инактивирует опухолевый супрессор p53, играющий одну из ведущих ролей в предотвращении развития рака. Ранее, в исследованиях Гусакова К.И. и соавт., продемонстрированы статистически значимые различия экспрессии 9 белков цервиковагинальной жидкости (ЦВЖ), непосредственно участвующих в реализации иммунного ответа (APOB, FABP5, GRN, HP, MUC5AC, OLFM4, PKP1, QSOX1, S100A8) у вакцинированных от ВПЧ женщин [6–10]. Понимание роли персистенции ВПЧ является ключом к поиску и разработке эффективных иммунных средств, которые могли бы полностью устранять вирусную инфекцию.
Глицирризинат аммония (AMGZ, Glycyram, аммониевая соль глицирризина, аммониевая соль глицирризиновой кислоты) – это вещество, содержащееся в корне солодки. Его можно получить в форме глицирризина аммония и глицирризина моноаммония при экстракции из растения. Глицирризиновую кислоту получают из технического сухого экстракта солодки с содержанием глицирризиновой кислоты 26–28% путем экстрагирования ацетоном, содержащим 0,1% серную кислоту, при комнатной температуре с получением трикалиевой соли гликозида и переводом ее в однокалиевую соль путем перекристаллизации последней из водного этанола дважды при соотношении, соответственно равном (5:1, V/V), и далее переводом в глицирризиновую кислоту путем обработки однокалиевой соли 1% раствором серной кислоты при 98–100°C и хлороформом при комнатной температуре. Глицирризинат аммония обладает широким спектром фармакологической и биологической активности, он является ингибитором HMGB1 белка, а также обладает противовоспалительным, противоопухолевым и антидиабетическим действиями. В частности, введение глицирризината аммония и доксорубицина позволило уменьшить кардиотоксичность, вызванную введением доксорубицина, за счет усиления эндогенной антиоксидантной активности. Глицирризинат аммония обладает антиоксидативным свойством, он способен блокировать экспрессию генов, участвующих в апоптозе (GDF15, ATF3, TNFRSF10A, NALP1), в том числе индуцированном окислительным стрессом (HMOX1). Противовирусное действие АГК было продемонстрировано на примере вируса гепатита. Было показано, что терапия с использованием глицирризина усиливает пролиферацию лимфоцитов через 4 дня после начала лечения.
A. Farooqui et al. изучали влияние глицирризина на линию раковых клеток шейки матки HeLa [11]. Анализ жизнеспособности клеток показал, что воздействие глицирризина на клетки HeLa значительно снижало жизнеспособность раковых клеток шейки матки в зависимости от времени и дозы. Было продемонстрировано, что глицирризин оказывает цитотоксическое действие на раковые клетки шейки матки без значительного влияния на нормальные клетки. Результаты позволили установить, что глицирризин проявлял антипролиферативные и апоптотические свойства в отношении раковых клеток шейки матки, вызывая нарушение митохондриального мембранного потенциала, увеличение генерации активных форм кислорода, активацию каспаз как внешнего, так и внутреннего пути гибели клеток, а также индукцию остановки клеточного цикла в фазе G0/G1. В связи с этим чрезвычайно актуальной является задача изучения протеомного состава ЦВЖ в когорте ВПЧ-инфицированных пациенток с «малыми» поражениями шейки матки, применяющих длительно активированную глицирризиновую кислоту (АГК).
Целью данного исследования явилась оценка протеома ЦВЖ при применении АГК в проспективной когорте ВПЧ-позитивных женщин для снижения риска развития и прогресии CIN.
Материалы и методы
В исследование были включены 80 пациенток в возрасте от 18 до 49 лет (средний возраст 30 лет), обратившихся в научно-поликлиническое отделение ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России.
Критерии включения: возраст от 18 до 49 лет, ВПЧ ВР, интраэпителиальные поражения низкой степени тяжести (ВПЧ-ассоциированный хронический цервицит и LSIL), половая жизнь с презервативом в течение всего периода исследования, способность выполнять требования протокола, предоставление подписанного письменного информированного согласия на участие в исследовании.
Критерии исключения: желание пациента прекратить участие в исследовании, аллергические реакции или индивидуальная непереносимость препарата АГК, выявленная в ходе исследования, некомплаентность, нарушение больным протокола исследования.
Критерии невключения в исследование: выявление инфекций, передающихся половым путем, в период проведения исследования (гонореи, хламидиоза, трихомониаза, сифилиса, кандидоза, генитального герпеса); злокачественные новообразования органов репродуктивной системы; беременность и лактация; тяжелые соматические заболевания, онкологические заболевания, сахарный диабет, первичные и вторичные иммунодефицитные состояния; проведение системной или местной антибактериальной терапии в течение 1 месяца до начала исследования; использование оральных контрацептивов во время текущего лечения; непереносимость назначаемых в исследовании препаратов.
Участники были разделены на 2 группы в зависимости от цитологического заключения: группа I (n=40) – хронический цервицит с персистенцией ВПЧ и группа II (n=40) – LSIL с наличием ВПЧ. Все пациентки получали АГК интравагинально в форме спрея 0,1% («Эпиген Интим» спрей) 3 раза в день 14 дней ежемесячно на протяжении 3 месяцев, затем перерыв 3 месяца, затем снова АГК по той же схеме. Контрольные временные точки – до начала терапии и через 6, 12 и 18 месяцев в соответствии с клиническими рекомендациями Минздрава ведения пациенток.
Комплексное обследование женщин включало сбор клинико-анамнестических данных, определение гинекологического статуса, цитологическое исследование, ВПЧ-типирование, липидомный и протеомный анализ соскоба эпителия шейки матки. Для проведения цитологического исследования эпителия шейки матки взятие материала проводили с помощью щетки со съемной головкой типа Cervix-brush по стандартной методике. Цитологическая оценка мазков с шейки матки осуществлялась по системе Bethesda (2014).
Взятие биологического материала (соскоб эпителия шейки матки) для ВПЧ-типирования осуществляли в пробирки с физиологическим раствором. При выделении ДНК вируса использовали наборы «Проба ГС» («ДНК-Технология», Россия). Метод основан на использовании для лизиса клеток сильного хаотропного агента с последующей сорбцией нуклеиновых кислот на твердом носителе, последующих отмывках сорбента и элюции ДНК с сорбента. Объем образцов после выделения составил 100 мкл. Амплификацию типоспецифических фрагментов ДНК ВПЧ и человеческой ДНК (контроль адекватности взятия биоматериала) проводили с помощью комплекта реагентов для выявления, типирования и количественного определения 21 типа ВПЧ методом ПЦР HPV «Квант-21» («ДНК-Технология», Россия). Амплификацию осуществляли в режиме «реального времени» на приборе «ДТ-964» («ДНК-Технология», Россия). Измерение уровня флуоресценции проводили на каждом цикле амплификации по каналам FAM, HEX, ROX и Cy5. Обработка результатов осуществлялась автоматически с помощью программного обеспечения к приборам.
Для кольпоскопического исследования использовался кольпоскоп Leisegang (Германия), обеспечивающий 7–15–30-кратное увеличение. Слизистую шейки матки исследовали как без обработки, так и с последующим нанесением 3% раствора уксусной кислоты и затем 2% водного раствора Люголя (проба Шиллера). При выполнении кольпоскопии намечались участки для прицельного взятия последующей биопсии и гистологического исследования биопсийного материала. При оценке кольпоскопической картины использовали единую Международную кольпоскопическую классификацию, одобренную на 14-м Всемирном конгрессе IFCPC в Рио-де-Жанейро (2011 г., дополненная в 2017 г.). Документацию кольпоскопических картин осуществляли у всех пациенток графически в соответствии с условным циферблатом.
Для получения образца ЦВЖ проводилось орошение влагалища и шейки матки физиологическим раствором до каких-либо манипуляций с целью минимизации риска контаминации образца кровью. Затем проводились центрифугирование для удаления клеток эпителия и заморозка надосадочной жидкости с хранением при -80°С. После быстрого размораживания проводили восстановление белков 100 мМ дитиотреитолом с последующим алкилированием 50мМ йодацетамидом, осаждением белковой смеси ледяным ацетоном с 0,1% трифторуксусной кислотой и трипсинолизом [9, 10]. Анализ смеси триптических пептидов проводился методом нано-поточной высокоэффективной хроматографии с тандемной масс-спектрометрией (ВЭЖХ-МС/МС) на Dionex Ultimate 3000 (Thermo Fisher Scientific, США), соединенном с TIMS TOF Pro (Bruker Daltonics, США), с использованием метода сбора данных с помощью параллельного накопления и последовательной фрагментации (PASEF) в режиме DDA (сбор данных в зависимости от данных).
Полученные данные были проанализированы с использованием программного обеспечения PEAKS Studio 8.5 с применением следующих параметров: погрешность измерения массы родительского иона – 20 ppm; погрешность массы фрагмента – 0,03 Да. Окисление метионина было установлено как возможные вариабельные модификации. Поиск проводился с использованием базы данных Swissprot белков человека. Пороговые значения FDR для всех этапов были установлены на уровне 0,01 (1%) или ниже.
Исследование было одобрено Комиссией по этике ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России. Пациентки, включенные в исследование, подписали добровольное информированное согласие.
Результаты и обсуждение
Были сформированы 2 группы ВПЧ-позитивных женщин с результатами цитологии: NILM, хронический цервицит (группа I, n=40) и LSIL (группа II, n=40).
Нами была произведена сравнительная оценка встречаемости ВПЧ высокого и низкого риска в исследуемых группах. В исходной точке у пациенток группы I преобладал ВПЧ ВР 16 типа (38%). Через 18 месяцев после применения АГК ВПЧ ВР элиминировал у 87,5% женщин, а ВПЧ низкого риска (НР) – в 77% случаев.
В группе II исходно также наиболее встречаемым являлся ВПЧ ВР 16 типа (40%). После применения препарата АГК в форме спрея 0,1% для местного и наружного применения через 18 месяцев отмечалась элиминация ВПЧ ВР в 88% случаев, ВПЧ НР – в 80%.
При динамическом наблюдении пациенток с «малыми» поражениями шейки матки применение АГК способствовало улучшению цитологической картины в группе II в 62,5% случаев. В обеих группах не отмечено прогрессирования процесса до CIN II+.
Всем пациенткам, включенным в исследование, проводилась кольпоскопия. Область стыка многослойного плоского и цилиндрического эпителия полностью визуализировалась у 67 (58%) пациенток, полностью не визуализировалась – у 49 (42%). Нормальная кольпоскопическая картина наблюдалась у 22% пациенток. Ненормальная кольпоскопическая картина была обнаружена у большинства женщин – 61 (78%). Слабовыраженные изменения эпителия шейки матки при кольпоскопии отмечались в 64,4% случаев и включали наличие тонкого ацетобелого эпителия с нежной мозаикой и пунктацией (рис. 1). Слабовыраженные изменения чаще всего встречались у пациенток в группах I и II. Выраженные изменения встречались в 3,3% случаев (группа II). Следует отметить, что в указанных случаях была произведена биопсия шейки матки с гистологической верификацией диагноза LSIL (CIN I). За период наблюдения (18 месяцев) отрицательной динамики при кольпоскопии в исследуемых группах отмечено не было.
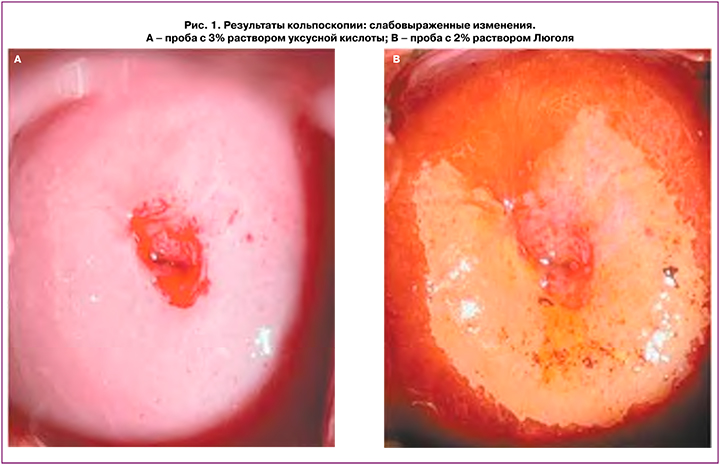
Биопсия шейки матки через 18 месяцев наблюдения была произведена при персистенции ВПЧ и изменениях эпителия шейки матки, подозрительных в отношении CIN, в 33 (42,3%) случаях. Гистологический диагноз LSIL (CIN I) выявлен у 26 пациенток, доброкачественные заболевания шейки матки – у 6 (хронический цервицит – у 4 (5,1%), лейкоплакия шейки матки – у 2 (2,6%)).
Для определения особенностей протеомного состава ЦВЖ при использовании АГК в процессе динамического наблюдения были исследованы образцы от 10 пациенток 2 группы (LSIL) репродуктивного возраста (средний возраст 26 лет). Было проведено сравнение при «положительной» динамике (n=5) – элиминация ВПЧ и улучшение цитологической картины и «без динамики» (n=5) – дальнейшая персистенция ВПЧ. Выявлено изменение 48 белков (FDR=0,01). Уровень 27 белков повышался в группе с «положительной» динамикой, в то время как уровень 21 белка снижался относительно группы «без динамики» (рис. 2).
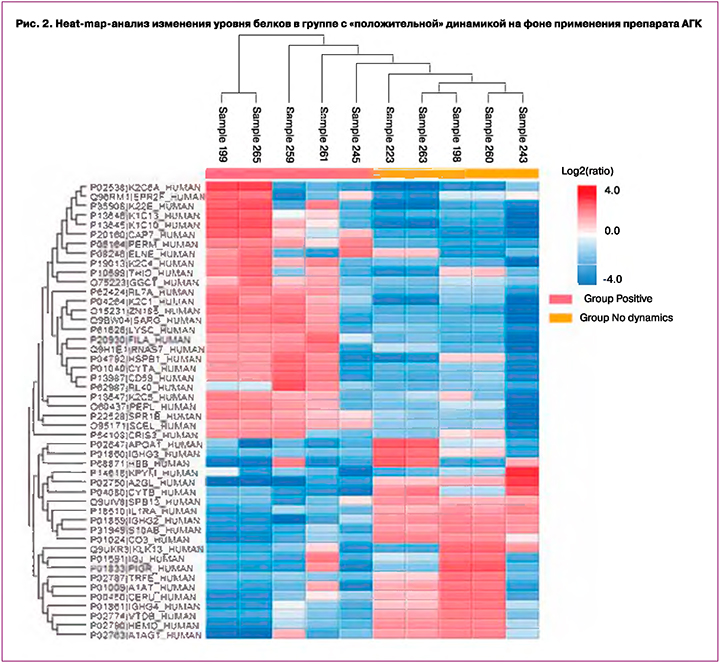
Аннотация белков, увеличивающих свой уровень (рис. 3), по базе Gene Ontology выявила их участие в процессах иммунной системы (MPO, AZU1, LYZ, RNASE7, PPL, TXN, CD59, UBA52, CRISP3, ELANE), в частности, во врожденном иммунном ответе (MPO, AZU1, LYZ, RNASE7, TXN, CD59, UBA52, CRISP3, ELANE), а также в процессе дегрануляции нейтрофилов (MPO, AZU1, LYZ, CD59, CRISP3, ELANE). Белки AZU1, ELANE имеют антимикробную активность [12]. Так, AZU1 является частью врожденной защиты – нейтрофилов человека. В ранее опубликованных работах сообщалось, что он играет роль в увеличении проницаемости сосудов, индуцированном нейтрофилами [13]. Кроме того, следует отметить увеличение уровня белков, участвующих в формировании ороговевающего эпителия (CSTA, SPRR1B, PPL, FLG, SPRR2F), а также кератинов (K1C10, K1C13, K22E, K2C1, K2C4, K2C5, K2C6A). Повышение уровня кератина 13 в ЦВЖ при аденокарциноме было подтверждено методом iTRAQ в 2020 г. группой Zhifang Ma [14]. Изменение уровня синтеза кератинов 10 и 13 в клетках эпителия было также показано при цервикальных неоплазиях шейки матки и вульвы [15, 16].

Аннотация белков, уменьшающих свой уровень (рис. 4), по базе Gene Ontology также выявила их участие в процессах иммунной системы (C3, IGJ, IL1RN, ORM1, S100A11, CSTB, LRG1, PKM, HBB, PIGR, SERPINA1), однако их снижение, по-видимому, обусловлено элиминацией вируса и снижением провоспалительной активности иммунных клеток в эпителии шейки матки.
В ранее проведенных коллективом авторов исследованиях, анализировавших динамику белкового состава ЦВЖ пациенток с ВПЧ-ассоциированными «малыми» поражениями шейки матки, также было выявлено значительное изменение уровней белков, участвующих в реализации иммунного ответа – более чем в 2 раза изменялся уровень 13 белков: A1BG, ACTR3, C4A, CAMP, CAP1, CSTB, GSTP1, HSPA8, LTA4H, LTF, MMP9, PPIA и S100A11 [9, 10]. Следует особенно отметить, что при оценке протеомного состава ЦВЖ женщин, вакцинированных от ВПЧ, изменялся уровень белков, в основном принимающих участие в реализации процессов врожденного иммунитета (APOB, FABP5, GRN, HP, MUC5AC, OLFM4, PKP1, QSOX1, S100A8). Уменьшение уровня белков из группы S100 (S100A8 и S100A11) в данном исследовании может быть ассоциировано со снижением провоспалительной активности иммунных клеток эпителия ввиду элиминации ВПЧ. Дальнейшие исследования должны подтвердить данную точку зрения.
Всего в семействе кальций-связывающих белков (S100) известно более 21 представителя [17]. Данное семейство белков выполняет множество внутри- и внеклеточных функций, таких как регуляция фосфорилирования белков, гомеостаза Ca2+, активности ферментов, дифференцировки клеток и воспалительный ответ [18]. Некоторые из белков S100 в клинической практике в настоящее время используются в качестве маркеров опухолей, например меланомы, шванномы и нейрофибромы [17], и являются маркерами воспалительных заболеваний [18].
В динамике наблюдения статистически достоверно изменялся уровень белков HSPB1, IGHG2 и PIGR. На фоне применения АГК уровни белков IGHG2 и PIGR снижались, в то время как уровень HSPB1 повышался. Белок IGHG2 является частью тяжелой цепи иммуноглобулинов и, соответственно, участвует в фазе распознавания при гуморальном иммунном ответе. Секретируемые иммуноглобулины опосредуют эффекторную фазу гуморального иммунитета, что приводит к устранению связанных антигенов. PIGR также является иммуноглобулиновым рецептором и опосредует селективный трансцитоз полимерных IgA и IgM через эпителиальные клетки слизистой оболочки. Снижение уровня данных белков после применения препарата АГК, возможно, ассоциировано с уменьшением воспалительного процесса при элиминации вируса ВПЧ.
Данное исследование подтверждает влияние длительного местного применения препарата АГК на протеом ЦВЖ при «малых» поражениях шейки матки, в частности, отмечается снижение провоспалительных белков при элиминации ВПЧ.
В связи с широким распространением папилломавирусной инфекции перед исследователями стоят несколько задач: первая – выявление «тяжелых» форм поражения шейки матки; вторая – определение в когорте ВПЧ-позитивных женщин с «малыми» формами поражения пациенток, подверженных риску прогрессии патологического процесса до CIN III; третья – определение групп белков ЦВЖ методом масс-спектрометрии и выявление их роли в иммунопатогенезе ВПЧ-инфекции и оценке эффективности применения локальной иммунотерапии для профилактики прогрессирования ВПЧ-инфекции. На решение данных задач и была направлена настоящая работа. Полученные предварительные данные указывают на то, что местное длительное применение АГК в форме спрея 0,1% связано со значительным снижением экспрессии провоспалительных белков ЦВЖ, которые могут участвовать в защитном действии, предупреждать развитие и прогрессию CIN и определялись у пациенток с элиминацией ВПЧ.
Заключение
Таким образом, исследования эффективности лекарств путем оценки протеомного состава ЦВЖ как на фундаментальном, так и на прикладном уровнях являются важными для внесения вклада в будущие инновации для широкого внедрения иммунотерапии ВПЧ-ассоциированных заболеваний путем длительного локального применения препарата АГК.



