Вирус папилломы человека (ВПЧ) на данный момент является самым распространенным в мире из всех инфекций, передающихся половым путем, с пиком инфицирования в молодом репродуктивном возрасте [1]. Проблема ВПЧ-ассоциированных заболеваний является социально значимой, поскольку реализация онкогенного потенциала вируса с развитием злокачественных заболеваний различных локализаций составляет 11,5–12% всех онкозаболеваний в Российской Федерации [2]. Репродуктивно значимой проблема ВПЧ-ассоциированных неоплазий определяется влиянием ВПЧ на фертильность, период гестации с развитием фетоплацентарной недостаточности, невынашивания и недонашивания, возможностью вертикальной передачи вируса плоду с поражением нервной трубки, увеличенным риском в 200 раз развития папилломатоза гортани в постнатальном периоде [3]. Следует отметить значительный рост ВПЧ-ассоциированных неоплазий за последние годы на фоне пандемии и социально-стрессовых воздействий, особенно у женщин молодого репродуктивного возраста [4]. Персистенция большого количества вирусов (виром) в организме женщины способствует возникновению эндотелиальных и эндометриальных дисфункций, что ставит проблемы вирусных инфекций в ряд наиболее значимых на фоне неблагоприятной демографической ситуации в стране [5]. И ВПЧ в этом оркестре вирусов играет значительную роль за счет влияния на иммунный статус как на системном, так и на местном уровне [6]. Результатом вирусной агрессии становится изменение характера цервико-вагинального цитокинового профиля с угнетением синтеза интерферонов и провоспалительного компонента цитокинового спектра, торможением моноцитарно-макрофагального звена иммунного профиля, что приводит к иммортализации незрелых эпителиальных клеток с переходом в неоплазию [7]. На фоне локальной иммунологической толерантности ВПЧ становится триггером размножения условно-патогенной цервико-вагинальной микробиоты, изменения кислотности среды с различными клиническими проявлениями иммунопатологических реакций [8]. В то же время активация ВПЧ может происходить на фоне уже имеющегося нарушения иммунного ответа, возникшего в результате генетических полиморфизмов иммунокомпетентных клеток [9], а также постгеномных эпигенетических воздействий [10]. В результате стандартная оперативная терапия неоплазий, проводимая на фоне субкомпенсации или декомпенсации локального иммунитета, может спровоцировать на постоперативном этапе размножение ВПЧ, сохранившегося в области неиссеченных эндоцервикальных крипт, с реактивацией или рецидивированием неопластического процесса, появлением ближайших или отдаленных осложнений и последствий оперативного лечения [11].
Принятая в ВОЗ Глобальная стратегия борьбы с раком шейки матки (РШМ) предполагает к 2030 г. достичь следующих целевых показателей «90–70–90»:
- 90% девочек должны быть вакцинированы против ВПЧ к 15 годам;
- 70% женщин в возрасте 35 лет должны пройти высококачественный скрининг на ВПЧ (повторно в 45 лет);
- 90% женщин, у которых диагностировано заболевание шейки матки, должны быть обеспечены лечением (лечение 90% женщин с предраковыми поражениями; ведение 90% пациенток с инвазивным раком) [12].
Недостаточно эффективные результаты стандартной оперативной терапии с развитием рецидивирования предракового процесса с частотой до 45% случаев и дальнейшей персистенцией ВПЧ у 60% пациенток на фоне различных иммунопатологических реакций на местном и системном уровне беспокоят мировое научное сообщество [13]. На этом фоне в Российской Федерации в Клинических протоколах и рекомендациях учтен негативный опыт традиционного лечения, и в комплексном лечении продуктивного компонента ВПЧ-инфекции при неоплазии в РФ рекомендована иммуномодулирующая терапия дииндолилметаном, инозин пранобексом и аллофероном (гистидил-глицил-валил-серил-глицил-гистидил-глицил-глутаминил-гистидил-глицил-валил-гистидил-глицин) [14, 15].
В ряде работ отечественных ученых уже была предложена схема иммуномодулирующей терапии [16, 17]. Однако, несмотря на многочисленные исследования, посвященные данной проблеме, классическая иммуномодулирующая терапия к значительному снижению рецидивирования HSIL не привела, поскольку ВПЧ обладает способностью ускользать от воздействия иммунокомпетентных клеток [18–20].
В этой связи применение аллоферона (цитокиноподобного 13-аминокислотного олигопептида) в виде препарата «Аллокин-альфа» представляется наиболее приемлемым благодаря активации препаратом уникального механизма распознавания вирусных антигенов в пораженных клетках.
Аллоферон 13 аминокислотный олигопептид изначально был выделен из иммунокомпетентных клеток гемолимфы насекомых:
- активирует систему естественных киллеров и стимулирует распознавание и лизис дефектных клеток цитотоксическими лимфоцитами, вызывает индукцию синтеза эндогенных интерферонов, преимущественно ИНФ-γ, IL-1b(1) и активацию цитотоксических Т-клеток CD3+HLA-DR+ даже на фоне снижения абсолютного числа CD3+ CD8+ клеток, усиливая противоопухолевый ответ;
- значительно повышает экспрессию активирующего рецептора 2В4 (CD244) в натуральных киллерах и их цитотоксичность за счет усиления экзоцитоза перфорина и гранзимов;
- существенно поднимает концентрацию IL-1β и неспецифической эстеразы;
- приводит к значимому снижению иммуносупрессивных белков TGF-β и FOXP3 и усиливает ангиогенез в опухоли;
- повышает рост CD4 и приводит к коррекции иммунорегуляторного индекса CD4/CD8 и эффективности презентации антигенов и способности распознавания антигенов T-лимфоцитами и натуральными киллерами;
- регулирует экспрессию SLC6A14 и ингибирует поглощение глутамина опухолевыми клетками, существенно повышая их чувствительность к химиотерапии.
Действие аллоферона проявляется не системно, а локально – только в местах нахождения инфекционного агента или опухолевой ткани [21, 22].
Уникальность механизма действия препарата предопределила изучение влияния Аллокина-альфа на степень снижения вирусной нагрузки на предоперативном этапе у пациенток с ВПЧ-ассоциированными CIN II.
Цель исследования:
- изучить влияние препарата «Аллокин-альфа» на элиминацию ВПЧ и частоту рецидивирования CIN II для оптимизации лечения неоплазий II степени;
- oценить влияние Аллокина-альфа на вирусную нагрузку ВПЧ до проведения эксцизии;
- oценить целесообразность использования Аллокина-альфа в комплексном лечении ВПЧ-ассоциированных CIN II путем сравнения вирусной нагрузки: до лечения, после терапии препаратом, после эксцизии.
Материалы и методы
Ретроспективное обсервационное аналитическое многоцентровое исследование проводилось с использованием баз данных за 2020–2021 гг. МЦ «Эдельвейс», МЦ «Ангио Лайн», амбулаторно-поликлинического отделения городского Перинатального центра г. Екатеринбурга.
Количество ДНК ВПЧ определяли методом ПЦР в режиме реального времени с помощью набора реагентов «АмплиСенс ВПЧ ВКР скрин-титр-14-FL», согласно рекомендациям производителя – ФБУН «ЦНИИЭ» Роспотребнадзора (Москва). Забор материала проводили в соответствии с методическими рекомендациями «Взятие, транспортировка, хранение клинического материала для ПЦР-диагностики», разработанными Центральным научно-исследовательским институтом эпидемиологии МЗ РФ и утвержденными МЗ РФ (Москва, 2009 г.). Конечный результат нормированной концентрации ДНК ВПЧ на количество клеток человека рассчитывали по формуле:

Вирусную нагрузку рассчитывали на 100 000 клеток человека, с интерпретацией полученных результатов: менее 3 lg на 105 клеток – низкая, клинически малозначимая концентрация; от 3 до 5 lg на 105 клеток – средняя, клинически значимая концентрация; свыше 5 lg на 105 клеток – высокая.
Результаты лабораторной диагностики: молекулярно-генетической (ПЦР на ВПЧ с определением генотипирования и вирусной нагрузки) до лечения, после медикаментозного этапа и после оперативного лечения, цитологического, гистологического исследования биоптатов шейки матки; инструментальной диагностики: расширенной кольпоскопии до и после эксцизионного лечения были взяты для изучения из индивидуальных карт 194 пациенток с цервикальными интраэпителиальными неоплазиями II степени, развившимися на фоне папилломавирусных инфекций, отобранными в соответствии с критериями включения и исключения. Критерии включения: гистологически и ПЦР верифицированная ВПЧ-ассоциированная цервикальная интраэпителиальная неоплазия II степени (ВПЧ-ассоциированная CIN II), сопутствующая оперативная терапия – радиохирургическая электроконизация; возраст 18–45 лет. Критерии исключения: беременность, лактация; сопутствующая декомпенсированная экстрагенитальная патология; ИМТ≥30; проводимая ранее противовирусная или иммуномодулирующая терапия в течение последнего года.
Все пациентки с CIN II были разделены на 2 группы. В первую группу (основную) вошли 97 пациенток, которым с 1-го дня после установления диагноза «ВПЧ-ассоциированная CIN II» перед проведением оперативных методов был назначен противовирусный, иммуномодулирующий препарат «Аллокин-альфа» по 1 мг п/к через сутки № 6. Следует отметить тот факт, что 69% пациенток (n=67) получили противовирусное лечение вместе с половыми партнерами. Во вторую группу (контроля) вошли 97 пациенток, которым после установления диагноза «Цервикальная интраэпителиальная неоплазия II степени» (N87.1) была назначена традиционная терапия: оперативное лечение, отсроченное на 3 месяца по объективным причинам (самоизоляция в связи с пандемией, лечение дисбиоценоза влагалища и другие медицинские или личные обстоятельства).
Результаты и обсуждение
Группы пациенток, включенных в исследование (n=194), были сопоставимы по возрасту, паритету, наличию экстрагенитальных заболеваний, генотипированию ВПЧ. Средний возраст составил 33,6 года.
Предикторная составляющая ВПЧ-ассоциированных CIN II продемонстрировала наличие косвенных признаков снижения иммунологической толерантности на местном уровне у 78,9% пациенток (n=153), что проявлялось дисбиотическими процессами цервико-вагинального содержимого с доминированием анаэробной флоры у 24,8% (n=38) и смешанной флоры в сочетании анаэробной с аэробной составляющей в виде кишечной группы у 75,2% (n=115). Полученные данные продемонстрировали показанный ранее в результатах отечественных исследователей патоморфоз лидирующих возбудителей – доминирование анаэробной флоры над смешанной с присоединением кишечной группы (Е. coli), произошедший за последние годы на фоне вирусных агрессий и социально-стрессовых воздействий [23], что диктует необходимость смены парадигмы лечебных технологий с расширением спектра антибактериального воздействия при подготовке к оперативному лечению c последующей иммуномодуляцией. У пациенток с CIN II в настоящем исследовании была проведена коррекция дисбиотических изменений препаратами с широким спектром антибактериальной активности.
Необходимо отметить косвенные признаки иммунодефицитного состояния у обследованных пациенток с CIN II и на системном уровне, проявившиеся в виде частых ОРВИ у 56,7% пациенток (n=110), что также подчеркивает необходимость иммуномодулирующей поддержки при подготовке к оперативному лечению для восстановления естественного противовирусного иммунного ответа.
Изучение генотипирования ВПЧ у пациенток с CIN II, взятых в исследование, выявило доминирование 16 типа (рис. 1), что совпадало с результатами исследований в мировой практике [24, 25]. Однако наиболее распространенными другими генотипами явились 31, 33, 45, 58. Следует отметить, что 45 и 58 типы, по данным зарубежных исследователей, наиболее часто вызывают поражение эндоцервикса с развитием аденокарциномы, что осложняет как кольпоскопическую диагностику, так и оперативное лечение, поскольку возрастает риск сохранения вируса в неудаленных фрагментах крипт эндоцервикса с последующим рецидивированием процесса неоплазии, и диктует необходимость комплексного подхода к лечению у данных пациенток, включающего противовирусный компонент. Часто обнаруживаемые 31 и 33 генотипы являются родственными для 16 типа ВПЧ, поскольку входят в филогенетическую группу α9 со значительным канцерогенным потенциалом.
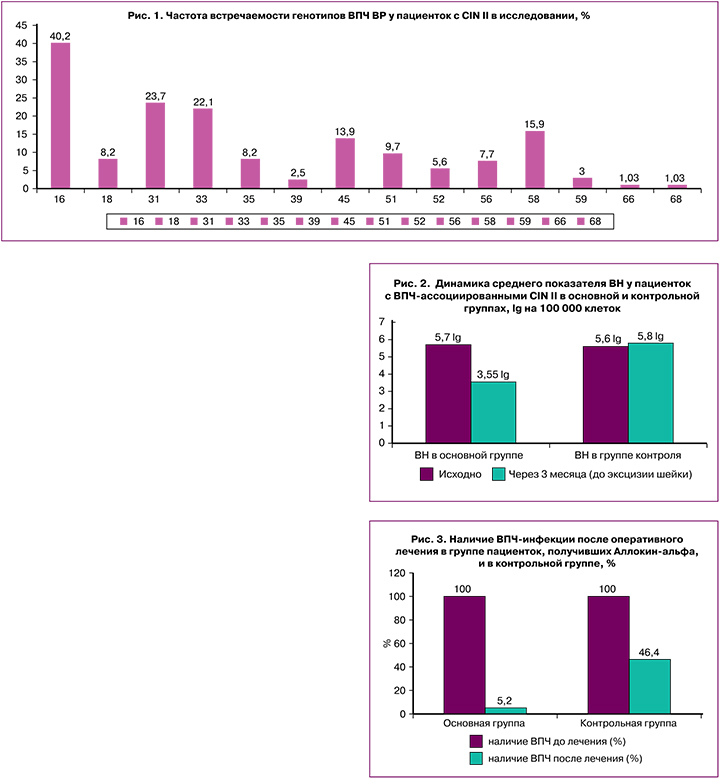
Коинфицирование несколькими типами выявлено наиболее часто (n=145), что составило 74,7% случаев, с наиболее значимо встречающимися сочетаниями 16+31, 16+58 типов ВПЧ.
При исследовании вирусной нагрузки (ВН) у изучаемой группы пациенток выявлено преобладание высокой ВН у 91,8% пациенток (всего 178 случаев: n=89 в основной группе и n=89 в группе контроля), остальные 8,2% женщин демонстрировали среднюю ВН (всего 16 случаев: n=8 в основной группе и n=8 в группе контроля), составившую в среднем 5,7 lg на 100 000 клеток. Высокая ВН чаще выявлялась при генотипировании 16, 18, 45 и 58 типами, что может свидетельствовать о высокой вирулентности данных типов.
Поскольку ВН является индикатором прогноза развития неоплазии, согласно заключению ряда исследователей [26], изучение данного параметра при оптимизации комплексной терапии явилось предопределяющим для исследования клинической эффективности применения аллоферона в виде Аллокина-альфа, который снижает вероятность развития рецидивов благодаря элиминации ВПЧ.
Анализ исследованной ВН ДНК ВПЧ через 3 месяца после медикаментозного предоперативного этапа препаратом «Аллокин-альфа» в дозе 1 мг п/к через день № 6 в основной группе пациенток (n=97) продемонстрировал значительное снижение ВН с высокого до среднего уровня на 2,15 lg, что составляет более чем 2 порядка, а именно в 141 раз (с 5,7 lg до 3,55 lg на 100 000 клеток) у 70,1% пациенток (n=68), в том числе с высокой до средней нагрузки – у 63,9% женщин (n=62), со средней до низкой нагрузки – у 6,2% пациенток (n=6).
В группе контроля аналогичное исследование ВН было проведено перед хирургическим этапом лечения (т.е. через 3 месяца после установления диагноза). Результаты анализа продемонстрировали повышение уровня ВН c 5,6 lg до 5,8 lg на 100 000 клеток. ВН выросла у 5,15% пациенток (n=5) со среднего до высокого уровня, а снижение ВН отмечалось лишь у 2,1% женщин (n=2), что значительно отличалось от аналогичного показателя основной группы (рис. 2).
Динамика ВН через 6 месяцев после лечения продемонстрировала значительные различия между группами. Так, в основной группе пациенток, получивших комплексную терапию с Аллокином-альфа на предоперационном этапе, у 94,8% пациенток (n=92) наступила полная элиминация ВПЧ (рис. 3). А у оставшихся 5,2% пациенток (n=5) ВН снизилась до низких значений – 1,3 lg на 100 000 клеток.
У пациенток контрольной группы, получивших только стандартное эксцизионное лечение, элиминация ВПЧ отмечалась лишь у 53,6% (n=52), что в 1,8 раза хуже данного показателя в основной группе. При этом у остальных 46,4% пациенток (n=45) снижение ВН произошло лишь до среднего уровня – 3,5 lg на 100 000 клеток.
Кольпоскопическое исследование, проведенное через 6 месяцев, в основной группе продемонстрировало нормализацию кольпоскопических изменений на экзоцервиксе в 100% случаев. В течение 12 месяцев у 2,1% пациенток (n=2) была выявлена цервикальная интраэпителиальная неоплазия I степени с ранее выявленными типами ВПЧ и ВПЧ другого генотипа, что не позволяет сделать однозначные выводы о рецидиве заболевания или о реинфекции. В данном исследовании эти женщины отнесены к категории пациенток с рецидивом заболевания.
В группе контроля через 6 месяцев у 15,5% пациенток (n=15) выявлялась картина легкой степени тяжести неоплазии c наличием ВПЧ аналогичных генотипов, в последующем через 12 месяцев картина неоплазии на экзоцервиксе была подтверждена с утяжелением неоплазии до средней степени (CIN II), что явилось более значимым в сравнении с группой, получавшей иммуномодуляцию Аллокином-альфа, и потребовало повторного лечения.
Таким образом, применение иммуномодулирующего противовирусного препарата «Аллокин-альфа» на дооперационном этапе рекомендовано и патогенетически оправдано, поскольку охват широкого спектра воздействий позволил снизить рецидивирование неоплазии в 7,4 раза (с 15,5 до 2,1%) на фоне снижения ВН на дооперационном этапе, с высоким процентом последующей элиминации ВПЧ после комплексной терапии.
Выводы
1. Включение в комплексное лечение ВПЧ-ассоциированных цервикальных интраэпителиальных неоплазий II степени противовирусного препарата «Аллокин-альфа» приводит к элиминации ВПЧ в 94,8% случаев, а также снижает вероятность рецидивирования предракового процесса в 7,4 раза по сравнению с контрольной группой, где элиминация наступила лишь у 53,6% пациенток.
2. Снижение ВН до эксцизии у пациенток основной группы, после терапии Аллокином-альфа, на фоне роста ВН в контрольной группе свидетельствует о самостоятельной эффективности препарата в отношении ВПЧ.
3. Полученные результаты диктуют целесообразность включения препарата «Аллокин-альфа» в алгоритмы комплексного лечения CIN II на предоперационном этапе.



