Регенерация – это процесс непрерывного обновления структурных элементов организма и восстановления их количества после повреждения. Великий французский физиолог К. Бернар писал об этом: «Созидание и разрушение совершаются одновременно во всяком живом существе в неразрывном сцеплении». Регенерация, начинающаяся в ответ на повреждение ткани, называется репаративной. В зависимости от индивидуальных особенностей организма, его реактивности, характеристик патогенного фактора и ряда других условий может формироваться замедление или избыточность регенерации. В этих случаях образуются длительно не заживающие раны, рубцы и келлоид (неполная регенерация или субституция) [1].
Регенеративный процесс охватывает все уровни организации и выражается во внутриклеточной регенерации (молекулярной (увеличение числа генов, политенизация хромосом, увеличение числа рецепторов клетки), внутриорганоидной (обновление и репарация структуры отдельных органоидов и их частей), органоидной (размножение ультраструктур клетки)) и в клеточной (тканевой) регенерации, заключающейся в митотическом делении клеток. То есть регенерация происходит только на базе сохранившихся ДНК и органелл клетки, а не de novo. Таким образом, утверждение «omnis cellula ex cellula», что означает «каждая клетка из клетки», введенное Рудольфом Вирховым в XIX в., сохраняет свою актуальность и в настоящее время, распространяясь на все структуры клетки. В связи с этим исходное состояние клетки, ее органелл и экстрацеллюлярного матрикса оказывает влияние на эффективность репаративных процессов. Только при благоприятных условиях окружающей среды возможно полноценное деление клетки и переход ее из G0 в G1 фазу митоза. В случае воспаления и избыточной продукции провоспалительных цитокинов процесс регенерации ткани замедляется и приобретает черты патологического [1–3].
Своеобразными дирижерами межклеточных коммуникаций являются цитокины. Цитокины – это эндогенные полипептидные медиаторы межклеточного взаимодействия. Термин «цитокины» (от греч. «kuttaro» – клетка + «kinisi» – движение) обозначает молекулы, участвующие в регуляции движения или взаимодействия между различными клетками [2, 4].
Доказана роль цитокинов в формировании и регуляции защитных реакций против патогенов и восстановлении ткани после травм. При этом цитокины, будучи главными медиаторами иммунной системы, участвуют в патогенезе всех без исключения аутоиммунных, воспалительных и аллергических заболеваний. Характер действия провоспалительных цитокинов в организме зависит от их количества. В случае превышения физиологических концентраций цитокины могут оказывать патологическое действие, индуцируя цитокиновый шторм и повреждение ткани [2, 4–6].
Заживление раны – это сложный физиологический процесс, включающий все фазы воспаления, образования грануляционной ткани, реорганизации внеклеточного матрикса и реэпителизации. В норме эти процессы протекают синхронно и приводят к достаточно быстрому заживлению ран с участием клеток соединительной ткани, эпителия и мигрировавших из крови лейкоцитов, факторов роста и цитокинов. Цитокины стимулируют пролиферацию клеток эпителия, фибробластов и метаболизм соединительной ткани, продукцию простагландинов и ростовых факторов. При этом клетки соединительной ткани увеличивают синтез одновременно коллагена и коллагеназы, а также других ферментов, включая нейтральные протеазы и металлопротеиназы [6–8].
Локальная продукция цитокинов резко возрастает в первые минуты после повреждения. Среди клеточных элементов одними из первых в раневом очаге активируются тромбоциты, синтезирующие тромбоцитарный фактор роста, фактор роста фибробластов, TNF, IL-1, IL-6 и другие цитокины. Эти цитокины привлекают в рану нейтрофилы периферической крови, которые фагоцитируют попавшие в очаг бактерии, тканевой дебрис, продуцируют различные протеиназы и активные формы кислорода. При регуляции заживления ран важнейшее значение приобретают свойства цитокинов усиливать рост и метаболизм фибробластов для увеличения ими продукции компонентов внеклеточного матрикса. Хроническая инфекция или длительное воздействие повреждающего фактора служат факторами поддержания вялотекущего тканевого воспаления, синтеза провоспалительных цитокинов и постоянной стимуляции фибробластов, которые приводят к повышенному фиброзированию [2, 7, 8].
Воспалительная реакция – основа тканевого ответа на внедрение патогенов и воздействие многих повреждающих факторов, включая механические нарушения целостности ткани. Ключевым по значимости событием во всем комплексе защитных реакций является синтез комплекса провоспалительных цитокинов из семейства IL-1, IL-6, TNF и хемокинов, стимулирующих большинство дальнейших событий в развитии воспалительных реакций и обеспечивающих активацию различных типов клеток, участвующих в поддержании и регуляции воспаления, включая все типы лейкоцитов, дендритные клетки, Т- и В-лимфоциты, NK-клетки, эндотелиальные и эпителиальные клетки, фибробласты и др. [4, 5, 8].
Важнейшей функцией цитокинов после завершения воспалительной реакции является восстановление целостности тканей, поврежденных при травме. В случае индуцибельной экспрессии цитокины синтезируются короткий промежуток времени, и по механизму ауторегуляции их локальная продукция снижается после восстановления ткани [2, 7].
Для изучения выраженности тканевой реакции при ее механическом повреждении, а также уточнения целесообразности проведения местного противовоспалительного лечения было проведено наблюдательное проспективное интервенционное клиническое исследование, включившее 37 пациенток.
Цель работы: уточнение целесообразности профилактического местного применения комбинированного препарата с глюкокортикостероидами перед проведением биопсии шейки матки.
Материалы и методы
Исследование было построено в соответствии с международными стандартами качественной клинической практики и соответствовало принципам Хельсинкской декларации. Набор пациенток проводился на базе консультативно-диагностического отделения родильного дома при ГКБ № 40 ДЗМ в 2021 г.
Были сформированы основная группа (n=21) и группа сравнения (n=16). Пациенткам основной группы перед манипуляцией проводилась профилактическая местная терапия препаратом «Тержинан» (тернидазол 200 мг, неомицина сульфат 100 мг, нистатин 100 000 ЕД и преднизолон 3 мг) в течение 6 дней. В группе сравнения накануне манипуляции никакие препараты не использовались.
Критерии включения в группы.
1. Наличие показаний для проведения диагностической биопсии шейки матки (ASCUS, LSIL, аномальная кольпоскопическая картина I степени) согласно клиническому протоколу «Доброкачественные и предраковые заболевания шейки матки с позиции профилактики рака от 2 ноября 2017 г. №15-4/10/2-7676».
2. Отсутствие специфического и неспецифического вагинита.
3. Возраст 30–45 лет.
4. Отсутствие значимой соматической и аутоиммунной патологии (ВИЧ-инфекция, сахарный диабет, ожирение, некомпенсированный гипотиреоз, системные аутоиммунные заболевания).
 Пациентки подписали информированное согласие на участие в исследовании, использование биологического материала и обработку персональных данных.
Пациентки подписали информированное согласие на участие в исследовании, использование биологического материала и обработку персональных данных.
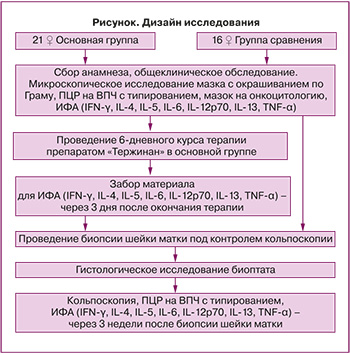
На рисунке представлен дизайн проведенного исследования.
Средний возраст пациенток основной группы составил 32,8 (1,9) года, в группе сравнения – 33,7 (1,4) года. Среди экстрагенитальных заболеваний у всех женщин преобладала патология органов желудочно-кишечного тракта (23,8 и 18,8% соответственно), преимущественно представленная хроническим гастродуоденитом. Варикозное расширение вен нижних конечностей значимо чаще диагностировалось у пациенток основной группы (р=0,04). Суммарно заболевания органов мочевыделительной (14,3 и 12,5%) и дыхательной систем (9,5 и 12,5%) выявлялись примерно с равной частотой в обеих группах (р≥0,05).
Средний возраст менархе у женщин основной группы был 12,4 (1,7) года, у 1 (4,7%) пациентки отмечен нерегулярный характер менструаций с задержками до 45 дней. В остальных случаях средняя продолжительность цикла была 28,4 (2,5) дня. У пациенток группы сравнения возраст менархе составил 11,7 (1,2) года, менструальный цикл имел продолжительность 29,1 (1,2) дня и был регулярным.
В анамнезе наиболее распространенными гинекологическими заболеваниями были эктопия шейки матки (85,7 и 87,5%), кандидозный вагинит (57,1 и 56,2%), бактериальный вагиноз (23,8 и 25%), дисменорея (9,5 и 6,3%), миома матки (14,3 и 12,5%) и эндометриоз (9,5 и 6,5%). Распространенность гинекологической патологии не имела статистических различий между группами (р≥0,05).
Объем обследования перед выполнением манипуляции включал микроскопическое исследование отделяемого из влагалища с окрашиванием по Граму, исключение инфекций, передаваемых половым путем (ИППП), методом полимеразной цепной реакции (ПЦР) в режиме реального времени. В случае обнаружения воспалительного типа мазка или выявления специфических возбудителей пациентки исключались из исследования.
На этапе включения в исследование у пациенток сформированных групп производился забор материала для цитологического исследования. Всего выполнено 37 исследований методом жидкостной цитологии NovаPrep. Забор материала с экто- и эндоцервикса проводился с использованием урогенитального зонда типа f (цервикс браш) согласно клиническому протоколу «Доброкачественные и предраковые заболевания шейки матки с позиции профилактики рака» (2017). За 48 ч до обследования пациентки исключали любые влагалищные манипуляции (влагалищный душ, тампоны, половая жизнь, гинекологический осмотр).
До мануального исследования, после введения зеркал Куско и удаления слизи с поверхности шейки матки в цервикальный канал вводился цитобраш и производилось 3 поворота по часовой стрелке до достижения эффекта «кровавой росы». Далее цитобраш помещался в специальную пробирку NovaPrep, содержащую стабилизирующий раствор, и направлялся в клиническую лабораторию. Оценка полученных результатов проводилась согласно унифицированной гистопатологической номенклатуре системы Bethesda [9, 10].
Качественное определение ДНК вируса папилломы человека (ВПЧ) группы высокого онкогенного риска (типы 16/18/31/33/35/39/45/51/52/56/58/59/68) проводилось методом ПЦР в режиме реального времени в коммерческой лаборатории «Геномед». Забор материала из цервикального канала проводился до мануального исследования, кольпоскопии и цитологического исследования, при помощи специального цитобраша, с последующим помещением его в пробирки с транспортной средой. За 2 ч до проведения исследования рекомендовалось воздержаться от мочеиспускания, за 48 ч – исключить любые влагалищные манипуляции (половой контакт, использование тампонов, спринцевания, свечей).
Иммуноферментный анализ (ИФА) для определения в клеточном супернатанте IFN-γ, IL-4, IL-5, IL-6, IL-12p70, TNF-α выполнялся в основной группе 3 раза (до и через 3 дня после окончания терапии и через 3 недели после биопсии), в контрольной группе – 2 раза (до процедуры и через 3 недели после биопсии). Были использованы мультиплексные панели для количественного определения человеческих биомаркеров (EPX060 10009-901, ProcartaPlex Essential Human Th1/Th2 6 plex 96 образцов, на проточном анализаторе Bio-Plex 200). Иммуноанализ ProcartaPlex основан на принципах сэндвич-ИФА (ELISA) с использованием двух высокоспецифичных антител, связывающихся с различными эпитопами одного белка, для количественного определения всех белковых мишеней одновременно с помощью прибора Luminex. Забор материала с эктоцервикса проводился до кольпоскопии и цитологического исследования, с использованием цитобраша, который помещался в пустую пробирку и замораживался при температуре -20°С. Для мультиплексных анализов требовалось 50 мкл супернатанта клеточного материала. За 2 ч до проведения исследования рекомендовалось воздержаться от мочеиспускания, за 48 ч – исключить любые влагалищные манипуляции (половой контакт, использование тампонов, спринцевания, свечей).
Гистологическое исследование проводилось на базе отделения патоморфологии ГБУЗ ГКБ № 40 ДЗМ. В условиях малой операционной шейка матки обнажалась при помощи зеркал Куско, производилась обработка раствором мирамистина с последующей местной анестезией шейки матки 2% раствором лидокаина гидрохлорида (2 мл). Под кольпоскопическим контролем при помощи петлевого электрода радиохирургическим методом (аппарат «Сургитрон» фирмы ELLMAN International, диапазон высокочастотных радиоволн 3,8–4,0 МГц) производилась биопсия шейки матки с наиболее измененных участков эктоцервикса, размер биоптата составлял в диаметре от 6 до 9 мм. Производилась радиоволновая коагуляция ложа биоптата при помощи шарикового электрода (аппарат «Сургитрон», диапазон радиоволн 3,8 МГц).
Образец полученной ткани фиксировали в 10% растворе нейтрального забуференного формалина и доставляли в патоморфологическую лабораторию. Гистологические срезы толщиной 3 мкм нарезались после спиртовой дегидратации и заливки материала в парафиновые блоки. Гистологическое исследование проводили на парафиновых срезах, окрашенных гематоксилином и эозином. Интерпретация полученных данных проводилась согласно унифицированной гистопатологической номенклатуре Bethesda [11, 12].
Расширенная кольпоскопия проводилась на бинокулярном микроскопе (KN-2200 series) с использованием 3% раствора уксусной кислоты и раствора Люголя. Интерпретация полученных результатов проводилась согласно Международной кольпоскопической классификации 2011 г. [13]. Клиническую оценку эпителизации после биопсии проводили по балльной шкале, где 1 – полная эпителизация, 0 – частичная эпителизация.
Статистический анализ
Статистическая обработка выполнялась с использованием пакета программ Statistica for Windows 10.0 (StatSoft Inc., США). Количественные показатели и их значимость оценивались с использованием теста Манна–Уитни. Связь между количественными показателями оценивали с помощью коэффициента корреляции Спирмена. Статистически значимыми считались различия данных и корреляция между данными при р<0,05.
Результаты
Протокол исследования включал 3 визита. На визите 1 после оценки жалоб, уточнения анамнеза были отобраны 37 женщин, соответствующих критериям включения. Случайным образом пациентки были разделены на 2 группы, выполнен запланированный объем обследования и назначена местная профилактическая терапия в основной группе. На визите 2 (через 3 дня после окончания терапии в основной группе и в любой день у пациенток группы сравнения) проводились повторное обследование и кольпоскопическая биопсия шейки матки. На визите 3 (через 3 недели после манипуляции на шейке матки) осуществлялись забор материала для ИФА, ПЦР в режиме реального времени и кольпоскопия с целью оценки полноты эпителизации ткани.
Результаты клинического и лабораторного обследования пациенток представлены в таблице 1.
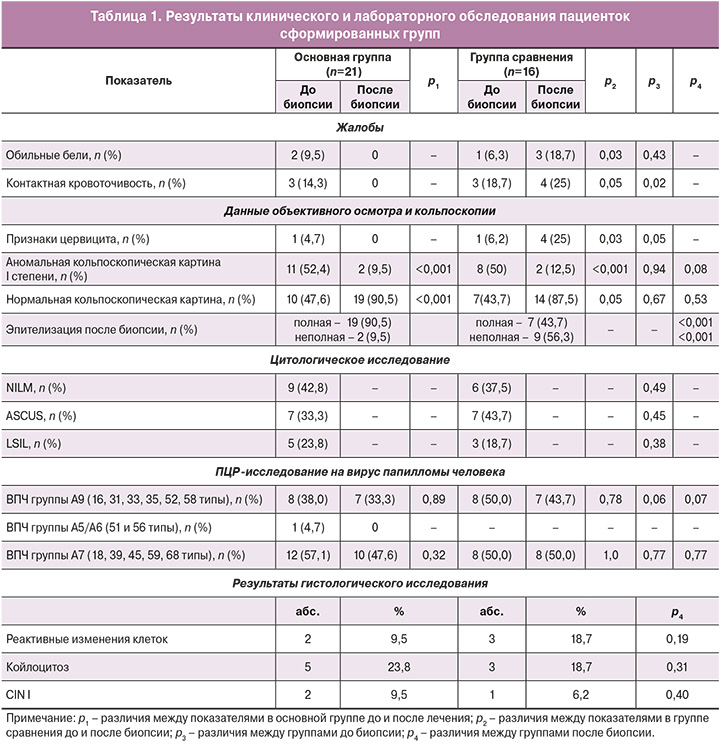
Критерием включения в исследование были цитологические и кольпоскопические изменения шейки матки, являющиеся показанием для проведения биопсии. Пациентки сформированных групп были сопоставимы по результатам цитологического и молекулярно-генетического методов. Не было выявлено значимых различий в частоте выявления аномальных цитологических (57,1 и 63,4%), гистологических и кольпоскопических находок (52,4 и 50% соответственно) (р≥0,05).
Малые цитологические изменения (ASCUS, LSIL) выявлялись у 57% (12/21) и 62,5% (10/16) пациенток соответственно группам (р=0,51). Аномальная кольпоскопическая картина I степени была у 11 (52,4%) и 8 (50%) пациенток (p>0,05). При проведении расширенной кольпоскопии оценивались локализация и площадь очага поражения, выраженность признаков атипии и степень восстановления ткани после лечения (табл. 2).
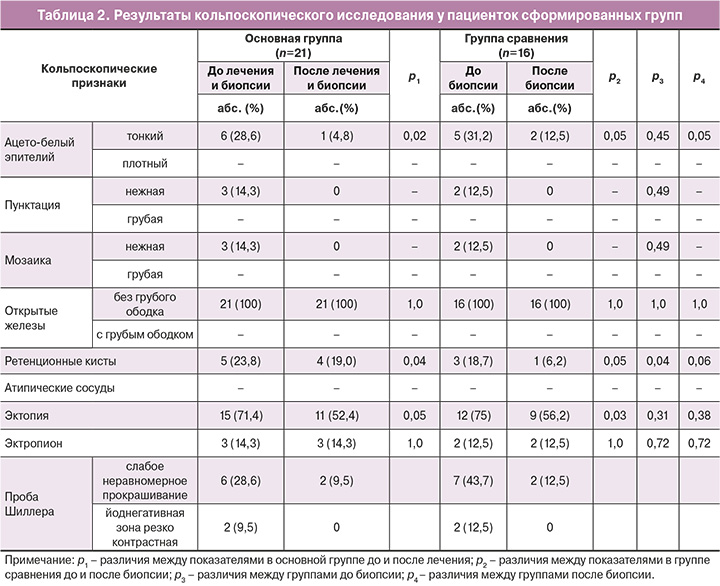
У всех пациенток был выявлен ВПЧ группы высокого онкогенного риска. Преобладали типы ВПЧ группы А7 (18, 39, 45, 59, 68 типы), которые выявлялись у 57% пациенток в основной группе и у 50% – в группе сравнения, и группы А9 (16, 31, 33, 35, 52, 58 типы) – у 38 и 50% женщин соответственно. После проведенной биопсии шейки матки, при повторной оценке наличия вирусов были выявлены значимые изменения.
У пациенток основной группы ВПЧ стал отрицательным у 19% (4/21) женщин, а в группе сравнения – у 6,3% (1/16) (р=0,06).
Проведенное профилактическое лечение оказало выраженный положительный клинический эффект. Полная эпителизация шейки матки произошла у 90,5% (19/21; р<0,01) пациенток основной группы. В группе сравнения полная эпителизация отмечена у 43,7% (7/16; р<0,001) пациенток, различия между группами были статистически значимы (р=0,02).
На этапе включения в исследование 14,3% (3/21) и 18,7% (3/16) пациенток соответственно группам отмечали наличие контактной кровоточивости. После проведенного курса местной терапии и биопсии шейки матки в основной группе контактных кровотечений отмечено не было. В то же время каждая 4-я женщина из группы сравнения жаловалась на сохранение или появление сукровичных выделений, что косвенно отражает снижение скорости эпителизации шейки матки после манипуляции. При кольпоскопии неполная эпителизация у пациенток группы сравнения встречалась в 6 раз чаще, чем у пациенток основной группы (р<0,02).
Результаты исследования содержания цитокинов у пациенток основной группы и группы сравнения представлены в таблицах 3 и 4.
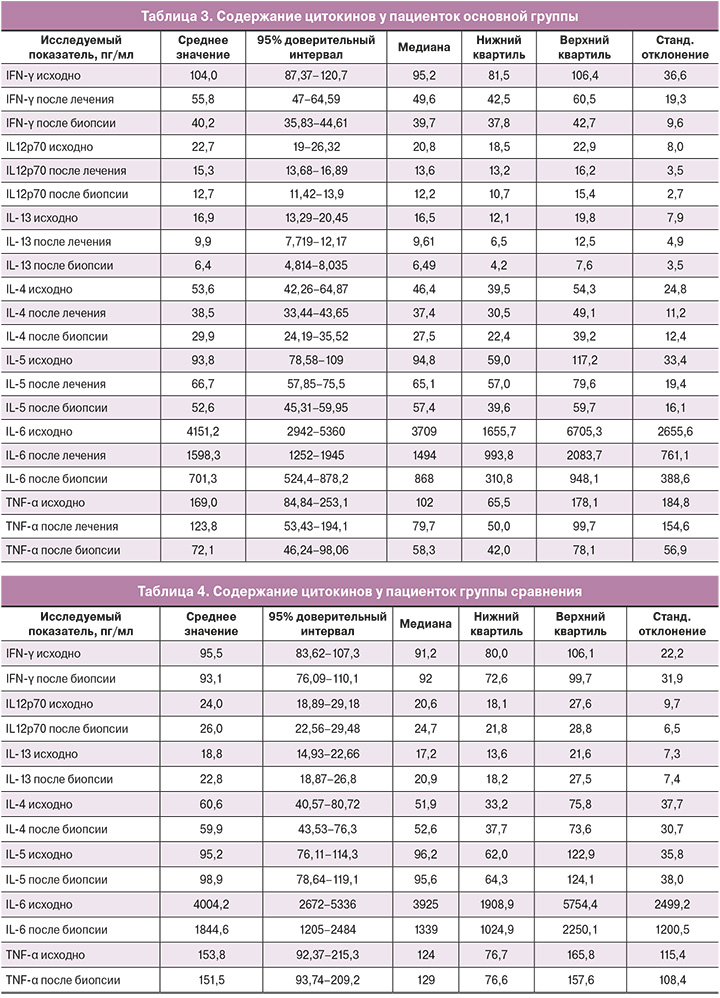
В обеих группах до лечения и биопсии шейки матки уровень всех исследуемых цитокинов был сопоставим и не имел значимых различий (p>0,05). При сравнении показателей в основной группе было выявлено, что уровень провоспалительных цитокинов после 6-дневного курса терапии снижался (р<0,01) по всем показателям и оставался в этих же пределах через 3 недели после биопсии. По сравнению с группой сравнения выявлено значимое снижение концентрации провоспалительных цитокинов в ткани шейки матки по всем исследуемым показателям (р<0,01) (табл. 5).
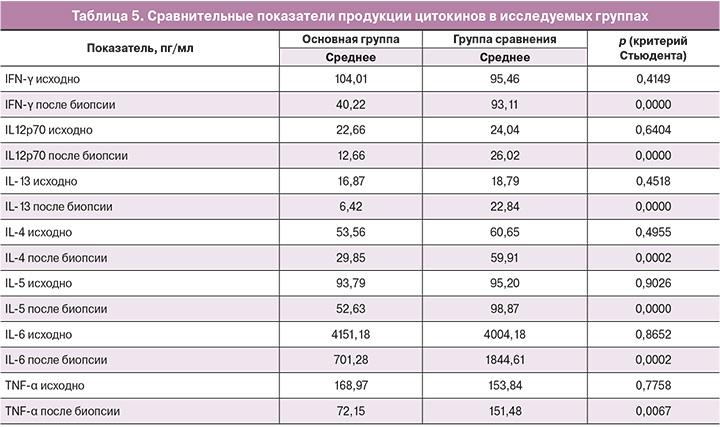
В группе сравнения продукция цитокинов сохранялась на высоком уровне как до, так и после биопсии. Изменения были отмечены только для IL-6, уровень которого снизился в 3 раза через 3 недели (р=0,04).
В основной группе значения IFN-γ, IL-12p70, IL-13, IL-4, IL-5, IL-6 и TNF-α снизились после лечения (р<0,01 для каждого показателя) и сохранялись на достигнутых уровнях в течение 3 недель. В группе сравнения статистически значимых изменений содержания цитокинов по сравнению с показателями до биопсии не произошло.
Выявлена ассоциация продукции цитокинов между собой, что доказывает их единый провоспалительный механизм действия. Проведение анализа показало, что при наличии изменений в ткани происходит единовременное и однонаправленное повышение уровня продукции цитокинов и фактора некроза опухоли. При этом большая связь обнаружена между IL-6 и фактором некроза опухоли альфа (r=0,65), а также IL-5 и IL-6 (r=0,54).
При сопоставлении данных у пациенток группы сравнения прямые корреляционные зависимости были выявлены для продукции IL-4 и IL-13 (r=0,55) и для IL-6 и TNF (r=0,68), обратные зависимости обнаружены между уровнем продукции IL-6 и IL-12p70 (r=-0,17).
Обсуждение
Целью исследования было уточнение целесообразности проведения профилактической местной санации влагалища перед манипуляциями на шейке матки.
Первоначальная гипотеза гласила, что проведение местной профилактической терапии с использованием поликомпонентного препарата, содержащего антибиотик, антимикотик и кортикостероид, до биопсии шейки матки позволяет улучшить состояние ткани и повысить ее регенеративные свойства. В качестве объективного критерия эффективности был избран уровень локальной продукции цитокинов. Известно, что цитокины плейотропны по биологическим функциям, каждая молекула имеет несколько активностей, проявляющихся в отношении различных типов клеток, участвующих в иммунологических реакциях. Биологические эффекты цитокинов распространяются далеко за пределы иммунной системы и охватывают разнообразные клетки и ткани. Являясь универсальной системой регуляции, цитокины способны проявлять биологическую активность как дистанционно после секреции клеткой-продуцентом (местно и системно), так и при межклеточном контакте [1, 3].
Важнейшими являются IL-6 и TNF, усиливающие пролиферацию и выживаемость многих типов клеток. Механизм действия TNF связан со стимуляцией пролиферации и снижением апоптоза клеток, а также подавлением их некротической гибели [1, 4].
Биологическое действие TNF как провоспалительного цитокина во многом зависит от его концентрации в ткани. В низких дозах он является важным физиологическим регулятором воспаления и нужен для нормального протекания защитных реакций при внедрении патогенов. При развитии местного воспаления он активирует лейкоциты, фибробласты, клетки эндотелия, усиливает фагоцитоз и синтез цитокинов макрофагами. В высоких концентрациях TNF выступает в роли медиатора патологического воспаления, развития системной воспалительной реакции, повреждения органов и септического шока [1]. В проведенном нами исследовании выявленные высокие исходные уровни продукции TNF и цитокинов свидетельствуют о напряженном состоянии местного иммунитета, вероятнее всего, связанном с наличием ВПЧ.
IFN-γ обладает выраженной противовирусной активностью, оказывая антипролиферативное и иммуномодулирующее действия. Действие его видоспецифично и направлено на стимуляцию экспрессии антигенов гистосовместимости II класса, активацию макрофагов, цитотоксических Т-лимфоцитов и NK-клеток [1, 5, 14]. Повышенная продукция интерферона, наиболее вероятно, связана с первичным контактом с вирусным геномом или с периодом активной репликации вируса. Снижение выработки интерферона после проведенной местной терапии препаратом «Тержинан» и выполненной электрохирургической манипуляции может свидетельствовать о стихании напряженности факторов местного иммунитета.
IL-5 необходим для стимуляции пролиферации и дифференцировки различных типов клеток-предшественников в костном мозге, активации мононуклеарного воспаления, клеточного и гуморального иммунитета. IL-6 оказывает провоспалительное и иммунорегуляторное действия, модулируя взаимодействие между Т- и В-лимфоцитами. Это типичный индуцибельный цитокин, вырабатывающийся в ответ на инфекционный и повреждающий фактор. Он активирует пролиферацию В-лимфоцитов и синтез ими антител, активирует Т-лимфоциты, повышает продукцию IL-2, активирует естественные лимфоциты-киллеры, является главным активатором синтеза большинства острофазовых белков [1, 15, 16].
В результате исследования было выявлено, что, несмотря на отсутствие ИППП, признаков вагинита и цервицита, локальная экспрессия провоспалительных цитокинов в ткани шейки матки у пациенток сформированных групп была достаточно высокой. Это можно объяснить наличием у них ВПЧ и различных цитологических изменений. Проведение биопсии шейки матки на фоне такого состояния сопровождается снижением темпов эпителизации в 6 раз (в группе сравнения). В проведенных ранее исследованиях Радзинский В.Е. и соавт. также продемонстрировали положительное влияние применения местных препаратов на темпы эпителизации ткани после радиоволновой эксцизии [16].
В основной группе продукция провоспалительных цитокинов значимо снижалась после окончания курса лечения и сохранялась практически неизменной в течение последующих 3 недель. Наибольшие изменения были выявлены в экспрессии IFN-γ, TNF-α и IL-13 (уровень снижался в 2,3 раза), а также IL-6, продукция которого снижалась в 5,6 раза. Другие провоспалительные цитокины также вырабатывались в значимо меньшем количестве, их уровень снизился в среднем в 1,7 раза для IL-4, IL-5 и IL-12p70.
Биологический эффект провоспалительных цитокинов зависит от концентрации, и при избыточной их продукции нарушаются процессы межклеточного взаимодействия, репарации и апоптоза [15, 17].
Клинически было показано, что полная эпителизация ткани после биопсии шейки матки, выполненной после профилактического местного применения поликомпонентного препарата «Тержинан», содержащего тернидазол 200 мг, неомицина сульфат 100 мг, нистатин 100 000 ЕД и преднизолон 3 мг, происходит в 90,5% случаев. Полная эпителизация шейки матки, выполненная без профилактической санации, происходит в 43,7% случаев.
Заключение
Таким образом, проведение местной профилактической терапии позволяет снизить локальную экспрессию цитокинов и способствовать эпителизации ткани. Профилактическое лечение с использованием комбинированного противомикробного и антимикотического препарата широкого спектра действия, содержащего противовоспалительный компонент – преднизолон, является эффективной стратегией и позволяет значительно улучшить цитокиновый баланс и регенеративные способности ткани.



