Нарушения когнитивных функций являются одной из наиболее актуальных проблем в современной медицине, так как значительно ухудшают качество жизни, приверженность лечению и уменьшают продолжительность жизни пациента. В норме снижение когнитивных функций отмечается в возрасте 50 лет и старше. Старение организма человека сопровождается снижением способности к обучению – лица пожилого и старческого возраста хуже усваивают новую информацию. В настоящее время отмечается значительная распространенность когнитивных нарушений сосудистого генеза в популяции, что обусловлено повышением частоты случаев артериальной гипертензии (АГ) и старением населения [2, 8].
АГ у пожилых ассоциируется с ухудшением когнитивного статуса и деменцией [4]. Одна из наиболее многочисленных групп пациентов с АГ – женщины в период постменопаузы, которые одну треть своей жизни находятся в этом периоде и, как правило, продолжают занимать активную социальную позицию в обществе и семье, многие из них не прерывают своей профессиональной деятельности [1, 3, 17]. Закономерно возникает вопрос о сохранении здоровья женской популяции и адекватного ведения женщин в период постменопаузы. Исследований, посвященных изучению когнитивного статуса у данной категории пациенток, недостаточно, практически отсутствуют данные о влиянии предыдущего гестационного анамнеза на выраженность когнитивных нарушений в этой группе, что и послужило основанием для проведения данной работы.
Цель: изучение когнитивного статуса у женщин в постменопаузе с АГ, наблюдающихся в поликлинических условиях.
Материали методы исследования
В исследование были включены 58 женщин в возрасте от 44 до 88 лет с АГ 1–3-й степеней. От каждой женщины было получено письменное информиро- ванное согласие на добровольное участие в исследовании. Комплексное обследование и наблюдение за больными проводилось в Диагностическом клиническом центре (ДКЦ) № 1 юго-западного округа Москвы.
Всем женщинам проводили клиническое обследование, оценивали показатели антропометрии (масса тела, рост, индекс массы тела – ИМТ, рассчитанный по формуле Кеттле).
В сыворотке крови определяли содержание калия, натрия, креатинина, мочевины, глюкозы, общего холестерина, липопротеинов низкой плотности, триглицеридов.
Эхокардиографическое исследование (ЭхоКГ) в покое проводили на аппарате Hewlett-Packard (CША), модель 77030R с помощью датчика 2,5 Мгц в одномерном (М-режиме), двухмерном (В-режиме) и допплеровских режимах (импульсно-волновом и постоянно-волновом), в стандартных позициях по общепринятой методике Н. Feigenbaum (1986). Фракцию выброса левого желудочка (ФВ ЛЖ) определяли методом Симпсона из верхушечной позиции на 4 и 2 камеры.
Тредмил-тест был проведен у 39 (67,2%) женщин, который оказался положительным у 15 (38,5%) из 39 женщин. Суточное мониторирование артериального давления (АД) было проведено у 39 (67,2%) женщин.
После клинико-лабораторного и инструментального обследований у всех женщин оценивали наличие тревоги и депрессии с помощью стандартной оценочной «Госпитальной шкалы тревоги и депрессии» (HADS – Hospital Anxiety and Depression Scale) [15] и у 49 женщин определяли психоэмоциональный статус с помощью опросника MMSE (Mini- mental State Examination) [5].
Всем женщинам корректировали медикаментозную терапию, согласно Национальным рекомендациям по ведению и лечению больных АГ.
Статистическую обработку данных проводили с использованием пакетов программ SPSS 16.0 и Statistica 6.0. Для непрерывных показателей с нормальным распределением результаты представлены как среднее и его стандартное отклонение (M/SD). Для исследования связи между непрерывными показателями применялся коэффициент ранговой корреляции Спирмена. Дискретные переменные представлены в виде процента от общего числа больных в группе. Для их сравнения применялся анализ таблиц сопряженности с применением критерия χ2 с поправкой на непрерывность или точный тест Фишера, когда число наблюдений в одной из ячеек таблицы не превышало 5. Для оценки взаимосвязи показателей определялось отношение шансов (ОШ) и его 95% доверительный интервал (ДИ) при однофакторном анализе в модели логистической регрессии. Различия считали статистически значимыми при значениях двустороннего p<0,05.
АГ рассматривается в настоящее время как ведущий фактор риска развития когнитивных нарушений, которые представляют одно из наиболее распространенных нарушений у людей пожилого и старческого возраста. По степени тяжести выделяют умеренные и выраженные когнитивные расстройства, или деменцию. Наиболее тяжелые изменения, которые вызывают профессиональную и бытовую дезадаптацию пациента, принято обозначать термином сосудистая деменция. Менее тяжелые нарушения, которые, тем не менее, выходят за рамки возрастной нормы и заметны для окружающих, согласно современным представлениям, называют умеренными когнитивными нарушениями. При легких когнитивных нарушениях изменения когнитивных функций незаметны для окружающих, но ощущаются самим пациентом и подтверждаются при тщательном исследовании с применением чувствительных методик. В связи с тем что повреждение мозга при сосудистых заболеваниях, прежде всего, влияет на зрительное восприятие, кратковременную память и визуально-моторную координацию, при проведении оценочных тестов мы в основном обращали внимание на данные области [8, 11].
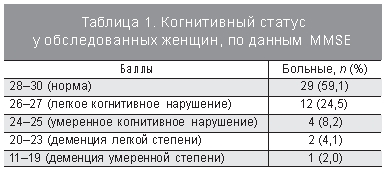
В табл. 1 представлено распределение женщин по уровню снижения у них когнитивного статуса, по данным опросника MMSE. В результате проведенного нами исследования было выявлено, что у женщин с АГ в период постменопаузы когнитивные расстройства встречаются достаточно часто – 40,8% женщин в той или иной степени страдают когнитивными расстройствами: 24,5% в виде легких форм, 8,2% в виде умеренных когнитивных нарушений, а у 6,1% женщин АГ привела к развитию деменции легкой и средней степеней тяжести. Необходимо понимать, что когнитивные нарушения – прогрессирующее состояние, которое трансформируется в деменцию достаточно быстро. По данным Larrieu (2002), у 5–15% пациентов с умеренными когнитивными нарушениями деменция развивается уже через год [8].
Снижение когнитивного статуса (по результатам опросника MMSE), по данным корреляционного анализа, в этой группе пациенток ассоциировано с ранним возрастом наступления менопаузы (р=0,001, r=-0,77), ожирением (р<0,001, r=0,95), наличием депрессивного состояния (р<0,001, r=-0,55). Проведение однофакторного регрессионного анализа также подтверждает, что независимыми факторами риска снижения когнитивного статуса у этой категории больных являются: ранний (или преждевременный) возраст наступления менопаузы (р=0,001, ОШ 0,05, 95% ДИ 0,01–0,24), наличие депрессивного статуса (р=0,01, ОШ 0,11, 95% ДИ 0,02–0,59) и ожирение (р=0,004, ОШ 0,09, 95% ДИ 0,02–0,47). Наши результаты согласуются с литературными данными и данными клинических исследований, по результатам которых было показано, что основными факторами риска ухудшения когнитивной функции являются АГ, сахарный диабет, кардиальная патология, метаболический синдром, депрессия и курение [11, 14].
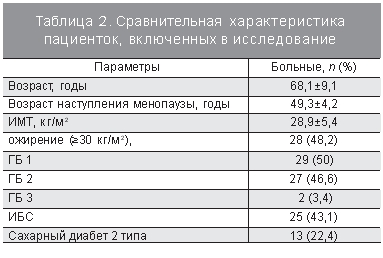
По степени тяжести заболевания и сопутствующей сердечно-сосудистой патологии пациентки распределялись следующим образом: гипертоническая болезнь (ГБ) I стадии имелась у 29 (50%), II стадии – у 27 (46,6%), III стадии – у 2 (3,4%) пациенток. Ишемическая болезнь сердца (ИБС) в анамнезе была у 25 (43,1%) женщин, у 13 (22,4%) – перенесенный инфаркт миокарда (подтвержденный электрокардиографией и ЭхоКГ). У 27 (46,5%) женщин ИБС осложнилась развитием хронической сердечной недостаточности II функционального класса. Из сопутствующих заболеваний у 14 (24,1%) женщин был хронический пиелонефрит в стадии ремиссии, у 9 (15,5%) – язвенная болезнь двенадцатиперстной кишки, у 16 (27,6%) – хронический некалькулезный холецистит. Сахарный диабет 2 типа был выявлен у 13 (22,4%) больных. Различные заболевания щитовидной железы (гипотиреоз, узловой зоб, аутоимунный тиреоидит) выявлены у 11 (18,9%) больных. Избыточная масса тела имелась у 15 (25,9%), ожирение – у 28 (48,2%) женщин. Высшее образование было у 40 (68,9%) женщин, семью имели 36 (62,1%) женщин.
Длительность менопаузы колебалась от 1 до 40 лет и составила 19,4±9,7 года, возраст наступления менопаузы был от 40 до 56 лет (49,3±4,2 года). Прибавку массы тела 10 кг и более на протяжении жизни за короткий период времени отметили 19 (32,8%) женщин. Гипертензивный синдром во время беременности имелся у 11 (18,93%) женщин. У 17 (40,5%) женщин были одни роды, у 30 (51,7%) – 2, у 1 (0,02%) – 3 родов, 4 (6,9%) женщины не рожали. У 17 (29,3%) женщин была выполнена двухсторонняя овариэктомия с или без гистерэктомии по поводу опухоли или опухолевидных образований яичников и доброкачественных образований матки. Сравнительная харакеристика пациенток, включенных в исследование, представлена в табл. 2
Хорошо известно, что АГ играет важную роль в развитии и прогрессировании когнитивных расстройств; при нейропсихологическом тестировании у больных АГ отмечаются несколько худшие когнитивные функции, чем у лиц с нормальным АД. В исследованиях SCOPE (Whitehall II study и Study on cognition and prognosis in the elderly) показано наличие слабой, но статистически значимой отрицательной обратной связи между уровнем систолического АД (САД), диастолического (ДАД) АД и показателями когнитивных функций независимо от уровня образования, наличия сахарного диабета, цереброваскулярных заболеваний и курения [12, 13]. Особенно значительной была эта ассоциация в отношении исполнительных функций у женщин: анализ информации, решение задач, выявление сходств и различий, обобщение, активность, мотивация, построение программы, умозаключение, произвольное внимание [17]. В проведенном нами исследовании, по данным корреляционного анализа, выявлена высокая степень корреляции между уровнем САД и выраженностью когнитивных нарушений (р<0,001, r=-0,95).
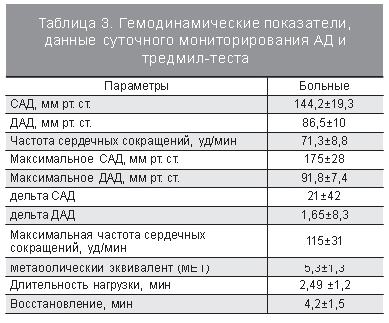
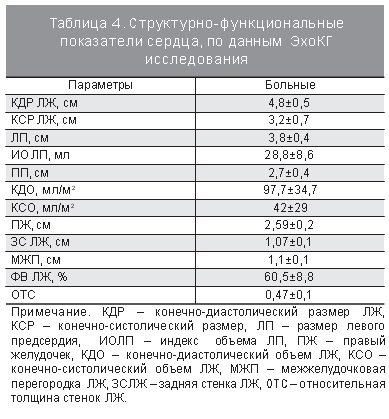
Наступление менопаузы и связанное с ней снижение уровней эстрогенов неблагоприятным образом сказывается на развитии и течении АГ. К настоящему времени обсуждается ряд механизмов, объясняющих повышение АД после менопаузы. Дефицит эстрогенов в постменопаузе может нарушить баланс между различными вазоактивными гормонами, пролиферацией и функционированием клеток гладкомышечных сосудов, возможно, путем нарушения электролитного баланса в интра- или экстраклеточной среде [16]. Известно, что у женщин в постме нопаузе ГБ протекает с быстрым поражением органов-мишеней: почек (микроальбуминурия), сердца (гипертрофия миокарда ЛЖ), головного мозга. [10]. В нашем исследовании не было выявлено взаимосвязи гипертрофии миокарда ЛЖ и выраженности когнитивных нарушений. Из структурно-функциональных показателей сердца, по данным ЭхоКГ и тредмил-теста, представленных в табл. 3 и 4, корреляционная связь выявлена только для фракции выброса ЛЖ (р<0,001, r=-0,71).
При проведении однофакторного регрессионного анализа было продемонстрировано, что снижение фракции выброса ЛЖ (р=0,001, ОШ 0,22, 95% ДИ 0,09–0,52) и увеличение левого предсердия, по данным ЭхоКГ (р=0,013, ОШ 11,6, 95% ДИ 1,67–79,8), являются независимыми факторами риска снижения когнитивного статуса у этой категории больных. Вероятно, эти результаты можно объяснить небольшой выборкой пациенток и относительно небольшой длительностью АГ, поскольку многочисленные исследования свидетельствуют, что дилатация ЛП у больных ГБ предшествует развитию гипертрофии ЛЖ [9].
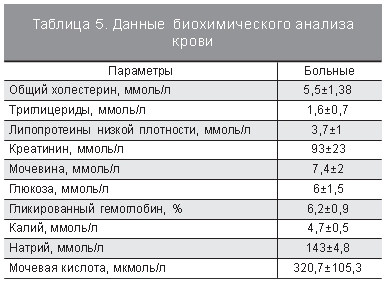
Важным аспектом исследования также явилось исследование метаболического статуса пациенток. В постменопаузе у женщин патогенетические механизмы АГ не ограничиваются прекращением положительного влияния гормонов яичников на сосудистый тонус. Дефицит эстрогенов сопровождается развитием относительной гиперандрогении, которая способствует или усугубляет развитие инсулинорезистентности. Последняя в свою очередь сопровождается гиперинсулинемией, дислипидемией, увеличением активности симпатоадреналовой системы, повышает реабсорбцию натрия в почечных канальцах, тем самым способствуя задержке жидкости, что создает предпосылки для прогрессирования АГ. В группе обследованных нами пациенток когнитивные нарушения были ассоциированы с наличием ожирения (р=0,004, ОШ 0,09, 95% ДИ 0,02–0,47), гиперхолестеринемии (р<0,001, ОШ 0,03, 95% ДИ 0,01–0,22), высоким уровнем мочевины (р=0,001, ОШ 0,06, 95% ДИ 0,01–0,29), а также повышенным уровнем глюкозы (р=0,012, ОШ 6,3, 95% ДИ 1,5–25,9). Показатели биохимического анализа крови представлены в табл. 5.
В последние десятилетия активно изучается роль АГ в развитии и прогрессировании нарушения когнитивных функций – от легких и умеренных когнитивных расстройств до степени деменции. Морфологической основой развития когнитивных нарушений у пациентов с АГ могут быть повторные инсульты, единичный инсульт в стратегически важной для когнитивных функций области головного мозга, множественные «немые» лакунарные инсульты, значительное диффузное и очаговое поражение белого вещества головного мозга (лейкоареоз) [8, 11]. В обследованной нами группе не было пациенток с острым нарушением мозгового кровообращения в анамнезе, тем не менее около 6% женщин страдают деменцией легкой и средней степеней тяжести. На фоне АГ происходят изменения стенки микроциркуляторного русла, развивается артериолосклероз, что приводит к изменению физиологической реактивности сосудов. В этих условиях снижение сердечного выброса за счет развившейся сердечной недостаточности, избыточной антигипертензивной терапии развивается гипоперфузия в зонах терминального кровообращения.
Адекватная антигипертензивная терапия способна предупреждать развитие цереброваскулярных осложнений, включая повторные нарушения мозгового кровообращения и когнитивные расстройства. В настоящее время на основании кли нических и экспериментальных данных можно утверждать, что только два класса антигипертензивных препаратов – антагонисты кальция и антагонисты рецепторов ангиотензина независимо от их гипотензивного эффекта обладают способностью предотвращать когнитивные нарушения. Было установлено, что в познавательном процессе большое значение имеет активность рецепторов АТ2 головного мозга на фоне сохраненного уровня ангиотензина II. Антагонисты кальция не влияют на уровень ангиотензина II, а антагонисты рецепторов ангиотензина изолировано блокируют только АТ1 рецепторы, деятельность рецепторов АТ2 не нарушается, что обеспечивает сохранение когнитивной функции [6, 7]. Кроме того, описанные плейотропные механизмы антагонистов кальция (антиатерогенный, позитивное влияние на реологию, эндотелий сосудов, гиперинсулинемию) увеличивают их потенциальную способность предотвращать когнитивные нарушения у пожилых пациентов при АГ, а также при сочетании АГ с сахарным диабетом и/или атеросклерозом.
Таким образом, у женщин с АГ в период постменопаузы снижение когнитивного статуса ассоциировано с ранним возрастом наступления менопаузы, ожирением, наличием депрессивного состояния, а также с нарушением липидного и углеводного обменов. Для практических целей важна своевременная диагностика когнитивных нарушений, так как именно на ранних этапах поражения головного мозга можно ожидать наибольшего успеха терапевтических мероприятий. Адекватная терапия АГ и коррекция метаболических сдвигов способна позитивно модифицировать когнитивный прогноз у женщин в период постменопаузы.



