В последние годы активно происходит развитие службы родовспоможения. На территории Российской Федерации создано большое количество перинатальных центров, и постоянное внедрение высоких технологий в перинатологии сопряжено с необходимостью совершенствования технологий и применения современных методик выхаживания новорожденных с различной патологией, в том числе и недоношенных детей [1, 2]. Малый вес при рождении является одним из важных факторов риска возникновения инфекций, в том числе инфекций, связанных с оказанием медицинской помощи (ИСМП). По данным официальной статистики, инфекционная заболеваемость у недоношенных детей значительно превышает таковую у доношенных: врожденными пневмониями – 76,2 против 6,1, бактериальным сепсисом – 3,9 против 0,16, инфекционными болезнями – 68,2 против 9,8 на 1000 родившихся живыми соответственно [3]. Частота ИСМП у новорожденных находится в прямой зависимости как от гестационного возраста, так и от массы тела при рождении. Уменьшение массы тела при рождении на каждые 500 г приводит к значительному возрастанию числа ИСМП [4, 5]. Смертность от инфекций также значительно выше в группе недоношенных новорожденных: от врожденной пневмонии – 1 против 0,05, от бактериального сепсиса – 0,9 против 0,08, от инфекционных заболеваний в целом – 2,1 против 0,08 на 1000 рожденных живыми соответственно [3]. Врожденные аномалии развития, требующие хирургической коррекции, и смертность от них также выше в группе недоношенных новорожденных – 62,7 против 30,8 и 2,2 против 0,1 на 1000 родившихся живыми соответственно [3]. Родовспомогательные учреждения третьего уровня (перинатальные центры) играют ведущую роль в лечении и выхаживании недоношенных новорожденных и новорожденных с врожденными аномалиями развития, в связи с чем 67,4% умерших новорожденных, по официальной статистике, приходится на третий уровень. Это заставляет уделять особое внимание инфекционному контролю и микробиологической диагностике в перинатальных центрах, для которых в настоящее время нет специфических нормативных актов, предписывающих обязательное наличие лаборатории микробиологии и регламент микробиологического обследования новорожденных в отделениях высокого риска по развитию ИСМП – в отделениях реанимации и интенсивной терапии (ОРИТ) новорожденных. Микробиологический мониторинг обозначен в СанПин 2.1.3.2630-10 «Санитарно-эпидемиологические требования к организациям, осуществляющим медицинскую деятельность» как «…диагностика… для подтверждения этиологии инфекции…», в части «Профилактика внутрибольничных инфекций в акушерских стационарах (отделениях)» [6]. Необходимо отметить, что микробиологический мониторинг с целью диагностики не может быть отнесен к профилактическим мерам. Более того, термин «мониторинг» подразумевает под собой непрерывное плановое обследование всех пациентов, имеющих факторы риска, а не отдельных пациентов [7]. Микробиологический мониторинг у новорожденных ОРИТ должен соответствовать следующим требованиям.
Не должен быть инвазивным (не должны быть использованы методы взятия биологического материала, создающие угрозу заражения новорожденного, – катетеры, иглы и пр.).
Биоматериал для микробиологического исследования, полученный у новорожденных, должен представлять наиболее открытые для колонизации окружающими условно-патогенными микроорганизмами (УПМ) локусы, которые первыми колонизируются при контакте с окружающей средой и медицинским персоналом и отражают общую картину обсемененности отделения. С этой целью наиболее оптимальными представляются слизистые оболочки желудочно-кишечного тракта (ЖКТ) –кал, зев.
Не должен включать исследования окружающей среды, поскольку медицинские поверхности не отражают всего видового разнообразия микроорганизмов, передающихся между пациентами и медперсоналом, а титры условных патогенов на них низки по сравнению со слизистыми оболочками, в связи с чем эпидемиологические тенденции могут быть не выявлены.
Микробиологический мониторинг проводится постоянно в режиме реального времени из одних и тех же локусов (мазки из ануса, кал, мазки из зева) и дает оперативную информацию о колонизации всех новорожденных детей, находящихся в ОРИТ. Информацию, полученную при микробиологическом мониторинге, необходимо воспринимать и интерпретировать как эпидемиологический показатель распространенности тех или иных популяций микроорганизмов в ОРИТ с целью оценки эпидемиологических тенденций в чувствительности или видовой структуре. Ответом на информацию, полученную в ходе микробиологического мониторинга, должны быть эпидемиологические мероприятия, изменение маршрутизации пациентов и другие организационные меры, но не лечение конкретного пациента. Лечение назначается при наличии (появлении или усилении) клинической картины инфекции, для этиологической диагностики проводится микробиологическое исследование биоматериала из предполагаемого очага инфекции и посев крови на стерильность [7–10]. Выявление возбудителей из предполагаемого очага инфекции называется этиологической диагностикой, но не микробиологическим мониторингом.
В настоящее время контроль за колонизацией УПМ у пациентов является обязательным не только при возникновении эпидемиологического процесса, но и в плановом порядке, особенно в ОРИТ [11–13].
Данные методические рекомендации разработаны группой специалистов по инфекционному контролю отдела микробиологии, клинической фармакологии и эпидемиологии в Федеральном государственном бюджетном учреждении «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени В.И. Кулакова» Министерства здравоохранения Российской Федерации (далее – Центр) для врачей-неонатологов, детских хирургов и реаниматологов. На основании результатов, полученных при микробиологическом мониторинге, осуществляется инфекционный контроль в перинатальных центрах РФ силами организаторов здравоохранения, госпитальных эпидемиологов, медицинских микробиологов, клинических фармакологов и специалистов инфекционного контроля.
Методические рекомендации организации микробиологического мониторинга в отделениях неонатального профиля
В отделениях неонатального профиля (ОРИТ и патологии новорожденных недоношенных детей), наряду с этиологической диагностикой инфекции, следует проводить плановый микробиологический мониторинг.
Микробиологический мониторинг должен представлять собой регулярное, непрерывное, охватывающее всех пациентов в отделении микробиологическое исследование. В качестве образцов биологического материала у новорожденных должны быть исследованы наиболее разнообразно колонизированные локусы, доступные для простого неинвазивного взятия (слизистые оболочки ЖКТ – кал и мазок из зева). По внутреннему протоколу микробиологический мониторинг проводится всем новорожденным независимо от наличия или отсутствия клинических признаков инфекции при поступлении и далее еженедельно (1 раз в неделю) с одинаковым интервалом в течение всего периода пребывания ребенка в отделении. Поскольку новорожденные не обладают сформированной микробиотой, а видовое разнообразие окружающей их внутрибольничной среды довольно скудно, то колонизация слизистых оболочек новорожденных в условиях стационара в полной мере отражает состав госпитального сообщества микроорганизмов. Такое обследование носит исключительно эпидемиологический характер и не является поводом к лечению или изменению схемы антимикробной терапии, но позволяет отслеживать изменения основных циркулирующих популяций УПМ [7]. Данные микробиологического мониторинга следует использовать для оценки видовой структуры УПМ, процента резистентных штаммов и популяционных изменений госпитального микробного сообщества. Таким образом, микробиологический мониторинг должен стать действенным инструментом для коррекции противоэпидемических мероприятий, маршрутизации пациентов, изменений протоколов эмпирической (но не целенаправленной) антимикробной терапии.
Правила взятия и доставки биологического материала в лабораторию
Взятие материала для микробиологического мониторинга проводят стерильными тампонами, которые помещают в транспортную среду. Весь биологический материал транспортируют в лабораторию микробиологии на исследование незамедлительно. Необходимо помнить, что титр микроорганизмов можно определить только на известный объем и вес биологического материала.
NB! Исследование на тампоне не позволяет определить точный титр микроорганизмов, поскольку объем биологического материала, попавшего на тампон, неизвестен. В связи с этим данные о титре микроорганизмов, полученные при микробиологическом мониторинге, носят условный характер и не могут быть использованы для определения динамики массивности колонизации.
При подозрении на инфекционный процесс данные микробиологического мониторинга могут стать основой для выбора схемы эмпирической антимикробной терапии, но до ее назначения должна быть проведена этиологическая диагностика инфекционного агента. С этой целью берут кровь (в обязательном порядке) и биологический материал из предполагаемого места локализации инфекции – мочу, ликвор или другие стерильные или условно-стерильные в норме жидкости, такие как аспират из трахеи, отделяемое пупочной ранки, поврежденной кожи, конъюнктивы и др. (табл. 1). Предпочтительно брать непосредственно сам биологический материал (кал, жидкости, образцы ткани), а не мазок на тампоне, поскольку вероятность положительного высева непосредственно из образца значительно выше, чем с тампона.
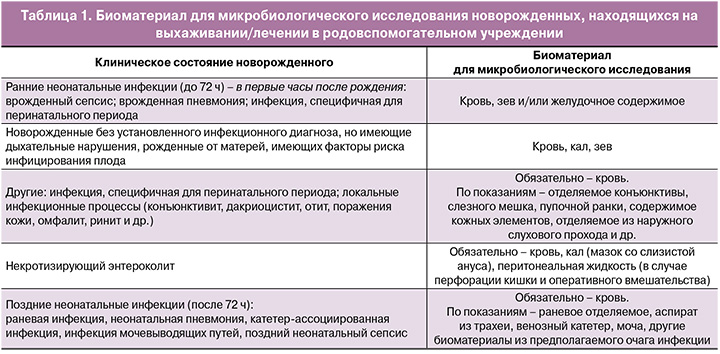
NB! Для жидких биологических материалов из стерильных в норме локусов (ликвор, суставная, плевральная, перикардиальная жидкость) целесообразно использовать флаконы для гемокультур.
Ключевые точки микробиологических исследований
Исследование гемокультуры: посев крови на стерильность является золотым стандартом диагностики системных инфекций в неонатологии, в том числе грибковой этиологии. Чувствительность культурального исследования крови напрямую связана с объемом образца биоматериала, взятого для изучения.
Учитывая значительные технические сложности, связанные с осуществлением пункций интактных вен у недоношенных новорожденных, а также принимая во внимание величину объема циркулирующей крови у данной категории пациентов (80–90 мл/кг массы тела), допускается взятие не менее 1,0 мл крови на исследование [20]. Культуры крови объемом 1,0 мл обладают хорошей чувствительностью даже в случае бактериемии низкой степени выраженности, а объемов крови до 0,5 мл может быть достаточно для выявления средней и высокой степени бактериемии, в особенности E. coli и S. agalactiae [21]. При этом сбор необходимого объема крови производится в соответствии с инструкцией производителя флаконов для гематологических анализаторов [20].
В тех случаях, когда посев крови взят в объеме меньше рекомендованного, отрицательная гемокультура не является достоверным признаком отсутствия бактериемии.
К ключевым моментам лабораторной диагностики бактериемии/фунгемии относятся:
- соблюдение необходимого минимального объема крови для исследования;
- взятие крови для посева до начала антимикробной терапии;
- образцы крови, взятые из катетера, имеют более высокий риск контаминации (ложноположительный результат) и не отражают спектр причинных возбудителей, циркулирующих в крови;
- концы удаленных венозных катетеров отправлять на исследование нецелесообразно;
- никогда не ставить в холодильник кровь перед инкубацией;
- используется 1 аэробный флакон для новорожденных; анаэробные флаконы используются только, когда это клинически значимо (при течении некротизирующего энтероколита (НЭК), подозрении на анаэробную инфекцию);
- Streptococcus pneumoniae и другие грамположительные микроорганизмы и факультативно анаэробные микроорганизмы могут лучше расти в анаэробном флаконе (более быстрое время для обнаружения) [11, 14].
Исследование при инфекциях ЦНС:
- по возможности целесообразно собирать образцы ликвора до начала антимикробной терапии;
- посев ликвора необходимо проводить во флаконы для гемокультур;
- при подозрении на бактериальный менингит следует также получить не менее двух образцов культур ликвора;
- целесообразно сообщить в лабораторию микробиологии о предполагаемых необычных микроорганизмах (например, Nocardia, грибы, микобактерии), для которых необходимы специальные методы исследования;
- не следует хранить ликвор в холодильнике;
- следует собирать как можно больше образцов для нескольких исследований (минимальный рекомендуемый объем образца – 1 мл).
Исследование мочи:
- собранный образец мочи не должен храниться при комнатной температуре более 30 минут;
- если нет возможности в течение 30 минут отнести образец в лабораторию, то целесообразно поставить биоматериал в холодильник или использовать устройство для транспортировки мочи (борную кислоту или другой консервант);
- наличие трех или более видов бактерий в образце мочи обычно указывает на контаминацию во время сбора, и интерпретация полученных результатов представляется сомнительной. В таком случае взятие образца мочи для микробиологического исследования следует повторить;
- не просите лаборанта сообщать «обо всем, что растет», перед принятием клинического решения следует обсудить с клиническим микробиологом результаты, если присутствует высокий титр сапрофитных микроорганизмов аногенитальной области, два и более вида микроорганизмов или результаты противоречат клиническим и лабораторным данным.
Инфекции кожи и мягких тканей:
- не следует при оформлении направления использовать обозначение «кожа». Целесообразно конкретно описать локализацию места взятия образца биоматериала и тип раны (например, «гнойничковый элемент на спинке, рана после операции по поводу…»);
- идеальным образцом для исследования является биоптат края раны с прогрессирующим поражением;
- исследование только гноевидного отделяемого или поверхностный мазок неадекватны и не отражают болезненный процесс;
- не просите лаборанта сообщать «обо всем, что растет».
Инфекции костей и суставов:
- мазки на тампоне не рекомендуются для взятия образцов, предпочтительны для исследования образцы аспиратов и/или биопсия тканей;
- исследование культуры крови целесообразно для выявления некоторых инфекционных агентов при диагностике остеомиелита и инфекции суставов, но не для диагностики раневой инфекции в зоне разреза;
- суставную жидкость следует по возможности культивировать во флаконах для культивирования крови;
- при подозрении на инфекции, вызванные анаэробными микроорганизмами, следует использовать анаэробные контейнеры для транспортировки тканей и жидкостей в микробиологическую лабораторию, а также проводить анаэробное культивирование.
Инфекции органа зрения:
- образцы биоматериала должны иметь указание на наличие конкретного локуса взятия биоматериала, то есть конъюнктива или роговица, и т.д.;
- окрашивание мазка отделяемого с конъюнктивы по Граму полезно при диагностике конъюнктивита, парный образец от неинфицированного глаза может быть использован в качестве «контрольного», чтобы помочь в интерпретации культуры или окрашивания по Граму;
- микроорганизмы, которые являются частью местной резидентной микрофлоры, обычно не вовлечены в конъюнктивит, но могут быть вовлечены в послеоперационный кератит и эндофтальмит [11].
 После взятия биологического материала врачу-неонатологу следует заполнить направление на микробиологическое исследование, которое должно быть доставлено вместе с биологическим материалом в лабораторию микробиологии (рис. 1).
После взятия биологического материала врачу-неонатологу следует заполнить направление на микробиологическое исследование, которое должно быть доставлено вместе с биологическим материалом в лабораторию микробиологии (рис. 1).
В обязательном порядке посев биоматериала осуществляют минимум на три питательных среды: 5% кровяной агар, селективную среду для выделения энтеробактерий, среду Сабуро. Рост микроорганизмов необходимо оценивать в течение 72 ч. Осуществляют видовую идентификацию чистых культур и определение чувствительности выделенных изолятов к антибактериальным препаратам. Для определения чувствительности выделенных изолятов к антибактериальным препаратам используют диско-диффузионный метод и/или метод серийных разведений (определение минимальной подавляющей концентрации (МПК) любым из имеющихся способов). Метод, условия и критерии интерпретации полученных результатов при постановке теста на чувствительность определяют в соответствии с действующей версией клинических рекомендаций «Определение чувствительности микроорганизмов к антимикробным препаратам», а также с учетом актуальной версии [15].
Аналитический отчет по микробиологическому мониторингу в неонатологии
Анализ результатов микробиологического мониторинга, проводимого в ОРИТ новорожденных, проводят ежеквартально, при этом частоту выделения отдельных групп микроорганизмов (энтеробактерии, неферментирующие грамотрицательные бактерии (НГОБ), коагулазонегативные и коагулазопозитивные стафилококки, энтерококки, дрожжевые грибы и др.) оценивают на 100 образцов биологического материала, полученных в плановом порядке со слизистых ЖКТ (кал, зев), табл. 2.
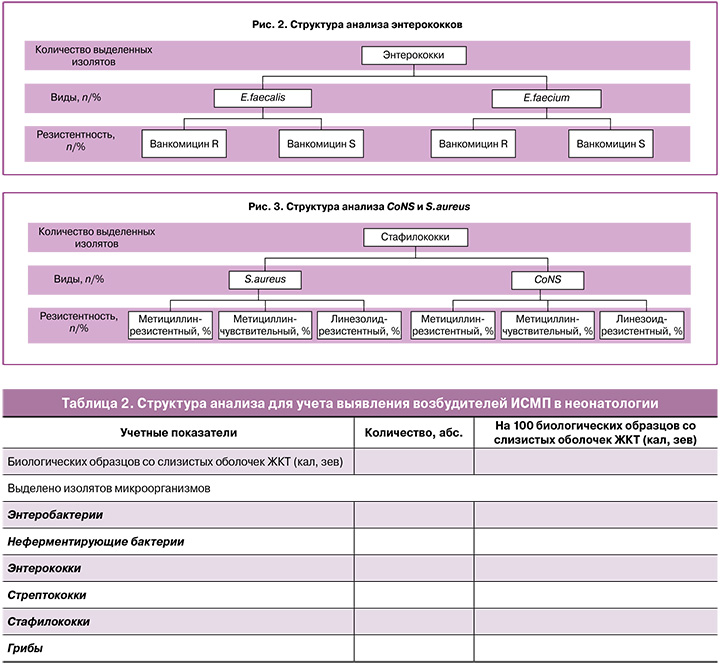
Энтерококки. Энтерококками дети колонизируются во время родов при прохождении через естественные родовые пути, приблизительно в 12,5% случаев. Первоначально происходит колонизация новорожденных детей E. faecalis, и, по литературным данным, 50% энтерококковых инфекций у детей развивается на 1-й неделе жизни, а группу риска по развитию врожденной инфекции составляют 47% детей, но при этом инфекция развивается у 6,3% новорожденных [16].
Одной из причин распространения энтерококков в лечебных учреждениях является устойчивость данных микроорганизмов к некоторым часто используемым антибиотикам, таким как бета-лактамные антибиотики (цефалоспорины III поколения) и аминогликозиды. Энтерококки имеют устойчивость к хлорамфениколу, эритромицину, тетрациклину и клиндамицину. Два наиболее клинически значимых вида энтерококков – E. faecalis и E. faecium имеют принципиальные отличия по чувствительности к пенициллинам – E. faecalis, как правило, чувствителен к ампициллину, который и является препаратом выбора для лечения инфекций, им вызванных, в то время как E. faecium часто устойчив к пенициллинам, поэтому препаратами выбора при лечении ассоциированных с ним инфекций стали гликопептиды – ванкомицин или оксазолидиноны – линезолид. По данным многоцентровых исследований, примерно 70% штаммов клинических изолятов E. faecalis сохраняют чувствительность к ампициллину, амоксициллину/клавулановой кислоте, имипенему, нитрофурантоину и 51–70% штаммов E. faecium – к гликопептидам (ванкомицину), нитрофуранам (нитрофурантоину и нитроксолину) [17, 18].
При анализе видовой структуры циркулирующих энтерококков необходимо учитывать не только частоту их выделения, но и процентное соотношение видов E. faecalis/E. faecium/другие, а также процентное соотношение ванкомицинрезистентных и ванкомицинчувствительных видов (рис. 2).
NB! При определении чувствительности энтерококков необходимо помнить, что они имеют природную резистентность к цефалоспоринам, соответственно, нет необходимости в ее постановке.
Стафилококки. Поскольку в последнее время появились данные о линезолидрезистентных штаммах коагулазонегативных стафилококков (CoNS) в России, необходимо проводить мониторинг резистентности CoNS и S. aureus не только в отношении метициллинрезистентных штаммов, но и в отношении устойчивых к линезолиду (рис. 3). Ванкомицинрезистентных штаммов стафилококков в мире в настоящий момент не выявлено.
Энтеробактерии. Распространенным механизмом резистентности у энтеробактерий является выработка бета-лактамаз расширенного спектра (БЛРС), которые разрушают цефалоспориновые антибиотики. Также для продуцентов БЛРС характерна ассоциированная устойчивость к аминогликозидам и фторхинолонам, но при этом сохраняется чувствительность к защищенным пенициллинам и карбапенемам. При проведении анализа структуры среди энтеробактерий в отделении обязательным становится определение количества выделенных изолятов, продуцирующих БЛРС, в общей популяции выделенных штаммов энтеробактерий (рис. 4, 5). Необходимо помнить, что выявление устойчивости энтеробактерий к одному из цефалоспоринов III поколения дает высокую вероятность наличия резистентности ко всем препаратам из этой группы.
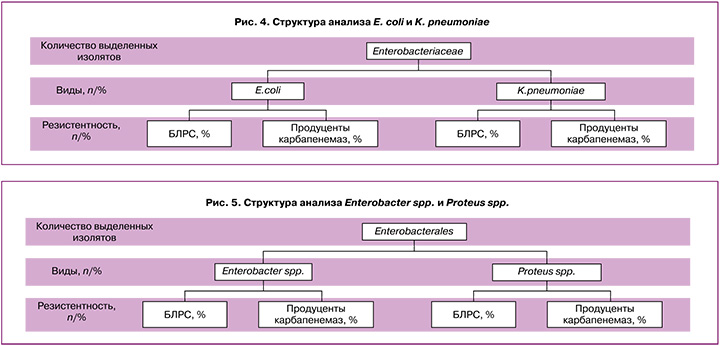
Резистентность к классу карбапенемов сильно изменилась после появления и открытия продуцентов карбапенемаз с плазмидной локализацией кодирующих генов. Постоянно происходит рост количества известных карбапенемаз, и глобальное распространение получили немногие представители класса В (металло-бета-лактамазы – МБЛ): IMP-тип, VIM-тип и NDM-тип; а также А-КРС-тип и D-ОХА-тип. Данные типы карбапенемаз распространены среди основных групп грамотрицательных бактерий. Из энтеробактерий класса Klebsiella spp. преимущественно распространены карбапенемазы типов КРС, ОХА-48 и NDM. Таким образом, массивное распространение продуцентов карбапенемаз в стационарах приводит к отсутствию клинического эффекта при использовании группы антибактериальных препаратов – карбапенемов. В связи с чем обязательным при проведении микробиологического мониторинга является учет доли штаммов – продуцентов карбапенемаз в общей популяции энтеробактерий в отделении.
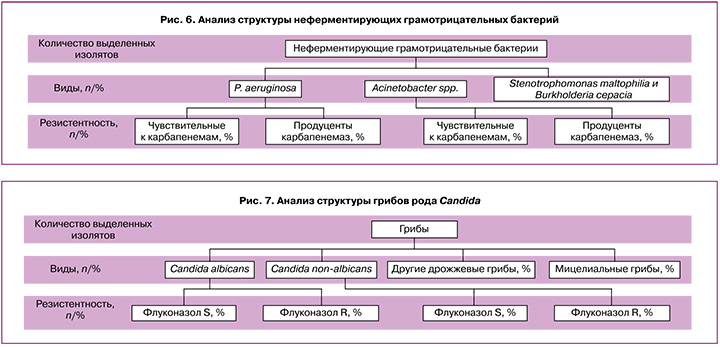
Неферментирующие грамотрицательные бактерии (НГОБ). Значительное место среди ИСМП занимают НГОБ, они широко распространены в окружающей среде, не являясь при этом представителями комменсальной микрофлоры тела человека. Основными их свойствами являются: высокая способность к образованию биопленок на искусственных медицинских имплантах и девайсах (катетерах, интубационных трубках, дренажах), природная устойчивость ко многим антибиотикам, высокая резистентность к дезинфектантам и распространение в лечебных учреждениях от пациента к пациенту (руки медицинского персонала, медицинское оборудование). При этом следует помнить, что колонизация медицинских девайсов не всегда является маркером инфекции и без клинических признаков инфекции не требует антибиотикотерапии. Широкое использование карбапенемов в течение длительного времени привело к появлению и распространению штаммов, резистентных к антибактериальным препаратам, в том числе продуцентов карбапенемаз (наличие резистентности к карбапенемам). К таким представителям среди P. aeruginosa относят тип VIM; среди Acinetobacter spp. – типы ОХА-23, ОХА-40, ОХА-51 и ОХА-58. Выявление карбапенемрезистентных штаммов и анализ их структуры в отделении имеют важное практическое значение при составлении протокола эмпирической и этиотропной антибиотикотерапии (рис. 6).
Микозы у новорожденных
Частота инвазивного кандидоза (ИК) у новорожденных детей в структуре инфекционно-воспалительных заболеваний, по данным Российской ассоциации специалистов перинатальной медицины, составляет от 15 до 30%. Частота возникновения ИК обратно пропорциональна сроку гестации и массе тела при рождении у детей. В ОРИТ новорожденных в 10% случаев причиной нозокомиального сепсиса у детей с экстремально низкой массой тела при рождении являются грибы рода Candida [19]. Недоношенные дети с экстремально низкой массой тела имеют высокий риск развития инфекции, вызванной грибами рода Candida, в силу наличия у них таких факторов риска, как применение в терапии антибактериальных препаратов группы резерва (цефалоспорины III поколения и карбапенемы), длительное по времени проведение парентерального питания, функционирование центральных венозных катетеров, некротизирующий энтероколит. Учету подлежит также частота колонизации и инфицирования новорожденных мицелиальными грибами рода Aspergillus, Mucor и другими, увеличение частоты выделения которых является неблагоприятным прогностическим признаком и косвенно указывает на неэффективность систем вентиляции в отделении. Важно отметить, что, в отличие от других областей медицины, наряду с традиционными возбудителями инвазивных микозов в ОРИТ новорожденных особую значимость имеет еще один род дрожжевых грибов – Malassezia, представители которого могут стать причиной госпитальных вспышек, которые описаны в отечественной и зарубежной литературе [20–22]. При этом стоит отметить, что значимость Malassezia в перинатальной медицине может быть недооценена в связи с трудностями при культивировании на стандартных питательных средах, используемых для выделения грибов. Обладая специфическими пищевыми потребностями (необходимость наличия полиненасыщенных жирных кислот), Malassezia не дает роста на агаре Сабуро и во флаконах для гемокультивирования. В связи с этим при микробиологическом мониторинге целесообразно использовать посев на плотную среду Диксона, а при этиологической диагностике дополнять посев крови, мочи, ликвора посевом в жидкую среду Диксона.
Популяция дрожжевых грибов в отделении, так же как и других микроорганизмов, формируется под воздействием антимикотиков, применяемых в отделении, – при пассаже через восприимчивый организм на фоне использования того или иного спектра антимикотических препаратов происходит селекция устойчивых к данному виду терапии видов и вариантов. Так, фоном для доминирования устойчивых к флуконазолу штаммов грибов рода Candida становятся избыточная профилактика и лечение флуконазолом, а использование амфотерицина и длительное парентеральное питание липидными растворами дают преимущество для распространения резистентных к амфотерицину штаммов Malassezia [22].
Выявление грибов при плановом микробиологическом мониторинге дает возможность в случае ухудшения клинического состояния новорожденного своевременно провести коррекцию терапии, а также осуществить выбор антимикотических препаратов с учетом чувствительности выявленных изолятов грибов (рис. 7).
Универсальной формулы для организации микробиологического мониторинга в неонатальных отделениях не существует, только междисциплинарный подход с мероприятиями эпидемиологического контроля, обеспечение правильного и своевременного сбора материала для микробиологического исследования, проведение анализа этиологической структуры возбудителей позволит оптимизировать использование антимикробных препаратов и, соответственно, повлиять на сдерживание антибиотикорезистентности в медицинской организации. Организация системы микробиологического мониторинга и проведение регулярного анализа получаемых сведений в неонатальных отеделениях лечебных учреждений являются обязательными компонентами эпидемиологического надзора за ИСМП.
Заключение
Таким образом, микробиологический мониторинг – это комплексное и динамическое наблюдение за патогенными и условно-патогенными микроорганизмами, выделенными от пациентов, их свойствами и особенностями циркуляции штаммов в стационаре. Создание системы микробиологического мониторинга в медицинской организации позволяет отслеживать этиологическую структуру ИСМП, своевременно обнаруживать циркуляцию госпитальных штаммов микроорганизмов и оценивать качество проводимых эпидемиологических мероприятий, а также выявлять предвестники эпидемиологического неблагополучия, чтобы целенаправленно и эффективно проводить необходимые профилактические и противоэпидемические мероприятия. Важным моментом для каждого специалиста является понимание значимости регулярного микробиологического мониторинга и этиологической диагностики возбудителей, а также понимание того факта, что наличие колонизации новорожденных детей определенными штаммами микроорганизмов не требует лечения в отсутствие клинических проявлений манифестации инфекционного процесса.
Ключевые точки микробиологического мониторинга
Микробиологический мониторинг: активное выявление внутрибольничных штаммов микроорганизмов, которое отражает эпидемиологическую ситуацию в стационаре.
Создание единого подхода к мониторированию потенциальных возбудителей ИСМП в отделениях неонатального профиля дает возможность оценивать в динамике и сравнивать показатели как в неонатальных отделениях одного лечебного учреждения, так и в различных медицинских учреждениях между регионами и другими странами.
Противоэпидемические мероприятия, проводимые по результатам микробиологического мониторинга, позволяют предупредить развитие заболеваемости.
Проведение микробиологического мониторинга в отделениях неонатального профиля является обязательной частью эпидемиологического надзора.



