Несмотря на длительный период изучения особенностей функционирования репродуктивной системы женщины, мы не обладаем достоверными сведениями о нюансах роста и развития фолликулов как в гонадотропин-независимой фазе, так и в течение менструального цикла. Ранние исследования, посвященные изучению механизмов, регулирующих биологию фолликулогенеза, были основаны на косвенных гистологических и/или эндокринологических наблюдениях, направленных на отслеживание роста фолликулов с помощью определения параметров стероидогенеза и биопсии яичников [1, 2]. Сравнительно недавно использование ультразвукового исследования (УЗИ) позволило получить новые данные о физиологических аспектах функциональной активности яичников, в частности, о наличии роста фолликулов во время лютеиновой фазы менструального цикла [3, 4]. Некоторые исследователи предполагают, что «когорты», или «волны», антральных фолликулов развиваются циклически 2–3 раза в течение одного и того же менструального цикла, опровергая классическую теорию, утверждающую, что у женщин только одна когорта антральных фолликулов растет исключительно во время фолликулярной фазы менструального цикла [4].
Возможность индуцировать экзогенными гонадотропинами рост фолликулов в лютеиновую и позднюю фолликулярную фазы позволила использовать инновационные протоколы во вспомогательных репродуктивных технологиях, направленные на получение ооцитов независимо от дня цикла: random-start протоколы [5, 6, 7] и протоколы двойной стимуляции (DuoStim) [8].
Особую практическую ценность random-start протоколы имеют в тактике ведения онкологических пациентов, направленных на процедуру предварительного сохранения и криоконсервации репродуктивного материала. Выбор протокола для стимуляции яичников у онкологических пациенток базируется на балансе между двумя основными факторами: ограниченный временной промежуток, имеющийся до начала гонадотоксичной терапии, и необходимость получения достаточного количества ооцитов и эмбрионов для криоконсервации. Именно гибкость random-start протоколов позволяет говорить об их предпочтительности и целесообразности в контексте онкофертильности.
Данные о сопоставимой эффективности классического протокола с антагонистом гонадотропин-рилизинг-гормона (антГнРГ) в фолликулярную фазу цикла и random-start протокола были получены в большинстве исследованиий, изучающих этот вопрос [5, 9]. В некоторых работах даже было показано, что ооциты, полученные в лютеиновую фазу цикла, могут демонстрировать более высокий коэффициент оплодотворения in vitro [10, 11].
Для окончательного решения вопроса об эффективности и безопасности традиционных и random-start протоколов исследований пока недостаточно, что обуславливает актуальность настоящей работы.
Цель исследования – оценить эффективность применения протокола стимуляции яичников в лютеиновую фазу цикла для забора и сохранения репродуктивного материала у онкологических больных.
Материалы и методы
Было проведено ретроспективное клиническое исследование на базе ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» среди пациенток, обратившихся с целью предварительного забора и криоконсервации ооцитов и/или эмбрионов перед планируемым лечением по поводу онкологического заболевания.
Дизайн исследования представлен на рисунке 1.

Из 160 пациенток, проконсультированных в отделении НОЦ ВРТ им. Ф. Паулсена в период с марта по декабрь 2019 г., для участия в исследовании были отобраны 47 женщин, направленных онкологом для забора и сохранения репродуктивного материала перед гонадотоксичной терапией (химио-, лучевой терапией). Все пациентки подписывали утвержденную на этическом комитете форму информированного согласия.
Критериями включения в исследования были: возраст от 18 до 42 лет, уровень антимюллерова гормона (АМГ) не менее 0,75 нг/мл, планирующееся проведение гонадотоксичной терапии (химио-, лучевой терапии). Критерии исключения: крайне сниженные показатели овариального резерва и невозможность получить собственный ооцит, рецидивирующие онкологические заболевания, отдаленные метастазы, состояние после гонадотоксичного лечения, противопоказания к стимуляции яичников.
В зависимости от дня обращения пациентки произвольно были разделены на 2 группы. Пациенткам 1-й группы, обратившимся в раннюю фолликулярную фазу, проводили стимуляцию яичников по стандартному протоколу с антГнРГ со 2–3-го дня менструального цикла. В качестве гонадотропинов использовали препараты рекомбинантного фолликулостимулирующего гормона (рФСГ), человеческого менопаузального гонадотропина (ЧМГ) или их комбинацию. Специальные программы проведены двум женщинам, имеющим рак молочной железы с высокой экспрессией рецепторов к эстрогену, которым в схему стимуляции включали ингибиторы ароматазы (Летрозол) в дозе 2,5 мг, согласно международным клиническим рекомендациям.
Пациенткам 2-й группы, обратившимся в лютеиновую фазу цикла, проводили стимуляцию яичников по random-start протоколу гонадотропинами рФСГ или ЧМГ, при этом во IIа подгруппе (n=8) – без дополнительного назначения антГнРГ и в подгруппе IIb (n=5) – с дополнительным назначением антГнРГ. Специальные программы с включением ингибиторов ароматазы в этой группе были проведены 3 женщинам, имеющим рак молочной железы с высокой экспрессией рецепторов к эстрогену.
При проведении стимуляции оценивали количество антральных, растущих и преовуляторных фолликулов при УЗИ. Оценку параметров стероидогенеза проводили в день вступления в программу ЭКО, в день назначения антГнРГ и в день введения триггера финального созревания ооцитов.
Трансвагинальную пункцию яичников назначали через 36 ч после введения хорионического гонадотропина человека (ХГЧ) в дозе 10 000 МЕ и через 38 ч после введения диферелина в дозе 0,2 мг. После трансвагинальной пункции проводили идентификацию и оценку зрелости ооцитов. Все зрелые ооциты (MII) криоконсервировали либо оплодотворяли. На 5-е сутки культивирования проводили криоконсервацию эмбрионов.
Всего было проведено 47 программ стимуляции яичников с последующей криоконсервацией репродуктивного материала. Из них 13 – по random-start протоколу, 34 – по стандартному протоколу с антГнРГ в фолликулярную фазу менструального цикла. В 78,7% (n=37) случаев проводили криоконсервацию ооцитов, в 17% (n=8) – криоконсервацию эмбрионов, в 4,3% (n=2) выполнена сочетанная криоконсервация ооцитов и эмбрионов. Оценивали количество полученных ооцитов, число зрелых ооцитов, суточную и суммарную дозу затраченных гонадотропинов, длительность стимуляции.
Статистический анализ
Результаты обрабатывали на персональном компьютере с использованием статистического анализа для Microsoft Excel 2010 и SPSSVV22.0. Для каждого количественного параметра были определены среднеарифметическое значение, стандартное среднеквадратическое отклонение и стандартная ошибка средней, медиана, 95% доверительный интервал (ДИ). Для качественных показателей определяли показатели частоты. Для определения вида распределения данных перед проведением сравнительного анализа количественных данных в исследуемых группах проводили теcт Колмогорова–Смирнова или теcт Шапиро–Уилка в зависимости от размера выборки. При нормальном виде распределения данных для оценки различий в группах применяли методы параметрической cтатиcтики. При распределении данных, отличном от нормального, применяли методы непараметрической cтатиcтики – тест Краскела–Уоллиса для сравнения данных в нескольких группах c дальнейшим проведением теcта Манна–Уитни с поправкой значений Бонферрони. Для сравнения зависимых групп при нормальном распределении признаков применяли одномерный дисперсионный анализ повторных наблюдений (Repeated measures ANOVA), при отсутствии нормального распределения применяли непараметрический метод Фридмена. Все критерии считались значимыми при значении менее 0,05. При множественном сравнении и нормальном распределении выборки применяли метод параметрической статистики – t-теcт.
 Результаты и их обсуждение
Результаты и их обсуждение
Оценка данных анамнеза и клинико-лабораторных параметров исследуемых больных
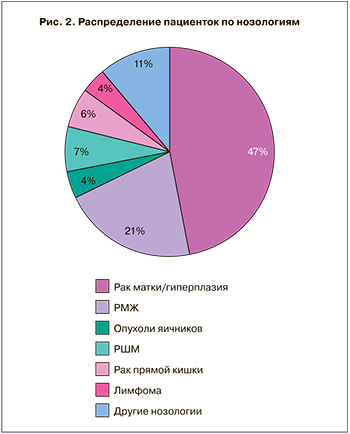
Были определены основные нозологические формы онкологических заболеваний у пациенток, направленных для предварительного сохранения репродуктивного материала. Результаты анализа представлены на рис. 2. Наиболее частыми нозологиями были рак матки I степени и атипическая гиперплазия эндометрия (n=22), рак молочной железы (n=10). Остальные заболевания: пограничные опухоли яичников (после выполнения оперативного лечения и гистологической верификации диагноза), рак шейки матки, рак прямой кишки, лимфомы, рак щитовидной железы, составили суммарно 15 случаев.
Клинико-лабораторные показатели пациенток двух групп по возрасту, индексу массы тела (ИМТ), уровню АМГ и количеству антральных фолликулов (КАФ) представлены в таблице 1.
Все пациентки, вошедшие в исследование, были сопоставимы по возрасту, ИМТ и уровню АМГ. Средний возраст у женщин I группы составил 33,38 (3,73) года, II группы – 33,3 (5,47) года; ИМТ – 23,2 (2,2) кг/м2 и 21,2 (1,6) кг/м2 соответственно. При подсчете КАФ их число оказалось статистически значимо меньше в группе II по сравнению с группой I. Необходимо отметить, что данный показатель может считаться весьма субъективным ввиду наличия желтого тела в одном из яичников.

Таким образом, анализ клинико-лабораторных данных женщин, включенных в исследование, не выявил значимых статистических межгрупповых различий. На момент включения в настоящее исследование пациентки 2 групп имели сходные показатели овариального резерва, подтвержденные данными гормонального исследования.
При анализе особенностей стимуляции в обеих группах не было обнаружено статистически значимой разницы в суточной и суммарной дозах затраченных гонадотропинов. Не различалось количество полученных ооцит-кумулюсных комплексов и зрелых ооцитов, несмотря на то, что при предварительной оценке насчитывали меньшее число визуализированных фолликулов в лютеиновую фазу цикла, что объясняли наличием желтого тела в одном из яичников (табл. 2).

На 5-е сутки культивирования производили криоконсервацию эмбрионов качеством не ниже 3ВВ. Было получено сопоставимое количество эмбрионов, пригодных для криоконсервации, в обеих группах (4,1 (1,3) и 5,1 (0,2)).
Особое внимание было уделено пониманию особенностей стероидогенеза при стимуляции яичников и функционирующем желтом теле. На момент начала стимуляции уровни эстрадиола (Е2) и прогестерона (Р) в лютеиновую фазу цикла были статистически значимо выше, чем значения этих гормонов в раннюю фолликулярную фазу (E2 – 211,62 (40,19) пмоль/л и 693,47 (151,04) пмоль/л; р=0,01; P – 1,13 (0,1) нмоль/л и 22,44 (9,97) нмоль/л, р=0,04), что вполне закономерно (табл. 3).
На 6-й день стимуляции и в день введения триггера финального созревания ооцитов уровни Е2 в обеих группах были статистически сопоставимы. Мы предположили, что на 6-й день стимуляции в лютеиновую фазу менструального цикла, по всей видимости, происходит редукция желтого тела. В настоящем исследовании уровни прогестерона на 6-й день стимуляции в лютеиновую фазу на первый взгляд казались значительно выше, но при подсчете полученных данных были зарегистрированы широкий разброс значений и отсутствие статистически значимой разницы со стимуляцией в фолликулярную фазу. О факте редукции желтого тела свидетельствуют сопоставимые значения прогестерона в обеих группах в 3-й точке мониторинга стероидогенеза – 6,71 (2,31) нмоль/л и 5,59 (3,41) нмоль/л (р=0,27).
На момент назначения антГнРГ ни в фолликулярную, ни в лютеиновую фазу цикла повышения уровня ЛГ не было зарегистрировано ни в одном цикле стимуляции. Однако это не исключает возможности преждевременной овуляции при стимуляции без аналогов ГнРГ. Необходимо отметить, что при стимуляции в лютеиновую фазу в 38,5% циклов мы назначали антГнРГ, в остальных случаях – стимуляцию проводили без добавления аналогов ГнРГ. Существует точка зрения, что при стимуляции в лютеиновую фазу цикла протективное действие эндогенного прогестерона предотвращает паразитарные пики ЛГ, однако это предположение не совпадает с предложенной нами гипотезой о редукции желтого тела с 6-го дня стимуляции. Обозначенные аспекты нуждаются в дальнейшем изучении [12, 13, 14].
Таким образом, современные данные о фолликулогенезе позволяют расширить и оптимизировать подходы к проведению контролируемой овариальной стимуляции в программах ВРТ не только с точки зрения дня начала стимуляции яичников, но и формируют совершенно новые протоколы контролируемой овариальной стимуляции. Тем не менее в 2 клинических случаях стимуляции без антГнРГ в лютеиновую фазу цикла у женщин со сниженным овариальным резервом мы зарегистрировали преждевременную овуляцию.
Продемонстрированные факты, по всей видимости, дают основание думать, что для безопасного использования протокола стимуляции во вторую фазу цикла без антГнРГ должен иметь место равномерный рост не менее 7–8 фолликулов. Тогда как неравномерный рост 2–3 фолликулов может привести к преждевременной овуляции, и в этих случаях необходимо назначение антГнРГ.
Несмотря на то что в большинстве международных клинических рекомендаций говорится о необходимости назначения ингибиторов ароматазы и антиэстрогенов при стимуляции яичников у пациенток с раком молочной железы с высокой экспрессией рецепторов к эстрогену, нами, в отличие от других исследователей, не обнаружено снижения преовуляторных значений E2 на фоне использования летрозола по сравнению со стимуляцией без применения ингибиторов ароматазы [15, 16]. Возможно, отсутствие значимого снижения пикового уровня Е2 связано с маленькой выборкой пациенток, которым контролируемая стимуляция функции яичников осуществлялась на фоне ингибиторов ароматазы. Тем не менее мы позволили себе выдвинуть предположение, что пиковый уровень E2 в первую очередь определяется числом преовуляторных фолликулов, и назначение ингибиторов ароматазы оказывает второстепенное влияние на его значение.
Выводы
Полученные данные позволяют сделать вывод о сопоставимой эффективности стимуляции яичников в фолликулярную и лютеиновую фазы цикла.
По нашим данным, с 6-го дня стимуляции яичников в лютеиновую фазу цикла зарегистрировано начало редукции функциональной активности желтого тела, что выражается падением концентрации эндогенного прогестерона.
Наличие преждевременной овуляции отмечено только в циклах с неравномерным ростом 2–3 фолликулов.
Не было обнаружено значительного снижения преовуляторных уровней эстрадиола при стимуляции яичников на фоне назначения ингибиторов ароматазы.



