Профессиональные риски для здоровья работающих женщин связаны в первую очередь с высокой чувствительностью репродуктивной системы к токсичным химическим веществам. Воздействие репротоксикантов связано с широким спектром нарушений эндокринной регуляции, с цитотоксическим эффектом [1, 2]. Особенно важно, что многие химические соединения являются факторами риска развития новообразований и предраковых состояний [3]. В частности, органические растворители (углеводороды и их производные) являются канцерогенами с уровнем доказанности от IIb (ксилол) до I (трихлорэтилен) по классификации МАИР [4–6]. Это одни из наиболее распространенных промышленных токсикантов.
Гиперплазия эндометрия – распространенное заболевание с высокой вероятностью малигнизации [7, 8]. При этом онкологический риск характеризуется значительной гетерогенностью. Так, при атипической гиперплазии вероятность малигнизации составляет 20–50% [9]. Простая гиперплазия трансформируется в злокачественное новообразование менее чем в 5% случаев [10]. В этой связи актуальным является изучение биомеханизмов заболевания и факторов, влияющих на особенности клинических проявлений, научный поиск биомаркеров неблагоприятного течения заболевания для выделения групп риска. Особенности формирования гиперплазии эндометрия в условиях воздействия органических растворителей все еще изучены недостаточно. Одновременно необходимо учитывать фактор ожирения в связи с доказанностью его этиологической роли в развитии гиперплазии эндометрия [7], а также с эффектом кумуляции органических растворителей в жировой ткани, существенно влияющим на токсичность [11].
Цель данной работы: выявить влияние органических растворителей и фактора ожирения на клинические, морфологические и молекулярные характеристики гиперплазии эндометрия.
Материалы и методы
Дизайн исследования – одноцентровое одномоментное наблюдательное сравнительное. Основная исследуемая группа – 140 женщин с гиперплазией эндометрия и воздействием на рабочем месте органических растворителей; из них 70 имели ожирение, 70 – нормальную массу тела. Группу сравнения составили женщины с гиперплазией эндометрия и отсутствием воздействия химического фактора (n=140, подгруппа больных ожирением – 68, без ожирения – 72 человека).
Больных включали в исследование на основании следующих критериев: наличие письменного информированного согласия на участие в исследовании, возраст от 50 до 65 лет, менопауза в течение 2 лет и более, диагноз гиперплазии эндометрия; критерии включения в основную группу – контакт с органическими растворителями в связи с выполнением трудовых функций не менее 5 лет; в группу контроля – отсутствие на рабочем месте воздействия химического фактора (в том числе в концентрациях менее предельно допустимых) за весь период трудовой деятельности.
Не включали в исследование женщин в случае отсутствия информированного согласия на участие в исследовании; неспособности или неготовности понимать и выполнять требования протокола исследования; при наличии противопоказаний к диагностическим мероприятиям, предусмотренным протоколом исследования; принимавших эстроген-гестагенные препараты в течение месяца до включения в исследование, а также, если индекс массы тела был менее 18; имевших злокачественные новообразования любой локализации, воспалительные заболевания органов малого таза, хронические воспалительные заболевания другой локализации, синдром поликистозных яичников, тяжелый сахарный диабет в стадии декомпенсации, цирроз печени или гепатит с печеночной недостаточностью; при наличии анамнестических данных об отсутствии родов, раннем возрасте начала менструаций, семейного анамнеза рака яичников, толстой кишки или матки.
Гиперплазию эндометрия диагностировали на основании результатов гистологического исследования эндометрия [12, 13].
Диагноз ожирения устанавливали по критериям ВОЗ – индекс массы тела более 30 кг/м2. Абдоминальное ожирение определяли на основании критериев IDF 2005 – окружность талии более 80 см [14] и при значении отношения окружности талии к окружности бедер более 0,85 [15].
Всем больным выполнены: сбор жалоб, анамнеза, физикальное исследование, гинекологический бимануальный осмотр, ультразвуковое исследование органов малого таза дважды, гистероскопия с биопсией или раздельное лечебно-диагностическое выскабливание стенок полости матки с гистологическим исследованием по стандартным показаниям [12].
Гистологические препараты были подготовлены по стандартной методике и исследованы методами световой микроскопии с окраской гематоксилином и эозином и иммуногистохимическим методом. Определяли экспрессию рецепторов к прогестерону, эстрогену на эпителиальных и стромальных клетках, экспрессию маркера пролиферации белка Ki-67.
Методом твердофазного иммуноферментного анализа в сыворотке крови больных определяли концентрации С-реактивного белка, интерлейкинов 1β и 6, трансформирующего фактора роста β1 (TGFβ1), фактора роста фибробластов-2 (FGF-2), тромбоцитарного фактора роста (PDGF AB), лептина, адипонектина, ферритина. Концентрацию фибриногена в крови измеряли методом Клаусса.
Профессия больных, подвергавшихся воздействию химического фактора, – маляры, место работы – предприятие машиностроения (производство летательных аппаратов, код ОКВЭД 2022 30.30). Уровни органических растворителей в воздухе рабочей зоны измеряли фотометрическим методом во время планового мониторинга, проводимого экспертами отдела надзора по гигиене труда, коммунальной гигиене Управления Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека по Новосибирской области. Концентрации органических растворителей в воздухе рабочей зоны превышали предельно допустимые значения в 1,1–5 раз.
Статистический анализ
Выполнены стандартные методы описательной статистики. Количественные переменные представлены в виде среднего арифметического и стандартного отклонения М (SD) при нормальном распределении данных, медианы и межквартильного интервала – Me (Q1; Q3) при других вариантах распределения. Нормальное распределение данных устанавливали методом Колмогорова–Смирнова. Качественные переменные даны в процентах. По количественным переменным группы сравнивали методом Крускалла–Уоллиса, по качественным – критерием χ2, с последующим апостериорным анализом для определения значимо различающихся групп.
Взаимосвязи определяли в каждой исследуемой группе методом парной корреляции Спирмена, параметр «атипическая гиперплазия эндометрия» включен в анализ в виде дихотомической переменной.
При сравнении групп различия признавали значимыми при значении вероятности ошибки р<0,01 с учетом поправки Бонферрони (4 сравниваемые группы, 6 пар сравнений). Уровень значимости при проведении корреляционного анализа принимали меньшим 0,05. Программное обеспечение для статистического анализа – SPSS 28.
Исследование выполнено в соответствии с этическими принципами, установленными Хельсинкской декларацией Всемирной медицинской ассоциации, а также с соблюдением этических норм и правил, предусмотренных Бюллетенем Высшей аттестационной комиссии Министерства образования России № 3 от 2002 г. «О порядке проведения биомедицинских исследований у человека». Исследование одобрено этическим комитетом ФГБОУ ВО «Новосибирский государственный медицинский университет» Минздрава России.
Результаты
Основные характеристики больных и гигиеническая характеристика условий труда представлены в таблице 1.
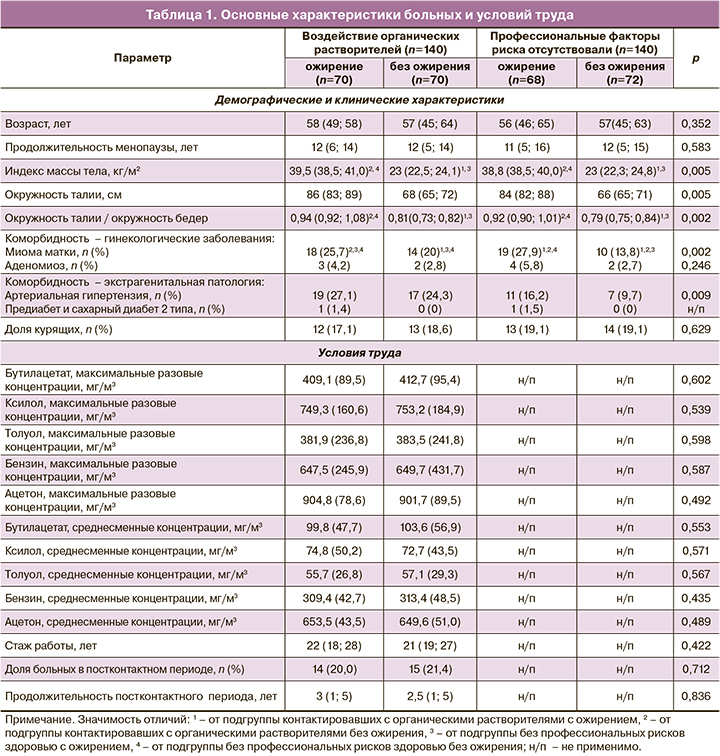
Гиперплазия эндометрия в условиях воздействия химического фактора характеризовалась частотой атипических форм, максимальной в подгруппе с ожирением – 24/70 (34,3 %) случаев, в сравнении с 13/70 (18,6%) в подгруппе без ожирения; 7/68 (10,3 %) и 5/72 (6,9 %) в группе без профессиональных рисков у женщин с ожирением и нормальной массой тела соответственно, р=0,0035. Различия были статистически значимыми между подгруппами: рабочих с ожирением и без ожирения, рабочих и контроля с ожирением, рабочих и контроля без ожирения. Частоты атипической гиперплазии эндометрия в группе сравнения в подгруппах с наличием и отсутствием ожирения не различались.
При оценке клинико-анамнестических данных отмечено увеличение частоты случаев аномальных маточных кровотечений (АМК) у больных гиперплазией эндометрия, работающих в контакте с органическими растворителями, преимущественно у больных с ожирением (табл. 2). В этой же подгруппе наблюдали тенденцию к увеличению числа пациенток с тяжелыми АМК, сопровождавшимися нарушениями гемодинамики, снижением гематокрита, потребностью в трансфузиях компонентов крови. Кроме того, в группе рабочих была выше частота анемий, меньше сывороточные концентрации ферритина. Данные изменения также были выражены в большей степени в подгруппе с ожирением.

Ультразвуковое исследование органов малого таза показало увеличение толщины М-эхо в подгруппе женщин, подвергавшихся воздействию органических растворителей и в подгруппах больных с ожирением.
У исследуемых, работающих в условиях контакта с органическими растворителями, с коморбидным ожирением, выявлен наибольший уровень экспрессии клетками эндометрия белка Ki-67, маркера пролиферации. Указанная закономерность прослеживалась и при простой, и при атипической гиперплазии эндометрия. При сравнении подгрупп экспрессия Ki-67 была больше в подгруппах воздействия органических растворителей, в сравнении с неэкспонированными и в подгруппах с ожирением, в сравнении с женщинами с нормальной массой тела.
При простой гиперплазии эндометрия экспрессия рецепторов эстрогенов на эпителии была больше у лиц с ожирением и не зависела от воздействия химического фактора. В группе сравнения экспрессия эстрогеновых рецепторов в подгруппе с ожирением была больше также и на клетках стромы. В случаях атипической гиперплазии эндометрия экспрессия эстрогеновых рецепторов была выше в подгруппах с ожирением, максимальной – при отсутствии влияния химического фактора.
Концентрации в крови стандартных острофазовых показателей, С-реактивного белка и фибриногена, в исследуемых группах не различались. Уровни провоспалительных цитокинов – интерлейкинов 1β и 6, были увеличены у больных с ожирением, в большей степени при воздействии органических растворителей. Содержание в системной циркуляции профиброзных ростовых факторов – TGFβ, FGF-2, PDGF-AB, было увеличено у женщин, подвергавшихся воздействию органических растворителей, и не зависело от фактора ожирения.
Снижение сывороточной концентрации адипонектина в подгруппах с ожирением не зависело от воздействия токсикантов. Повышение при ожирении уровня лептина крови у работающих в контакте с органическими растворителями было меньше относительно группы сравнения.
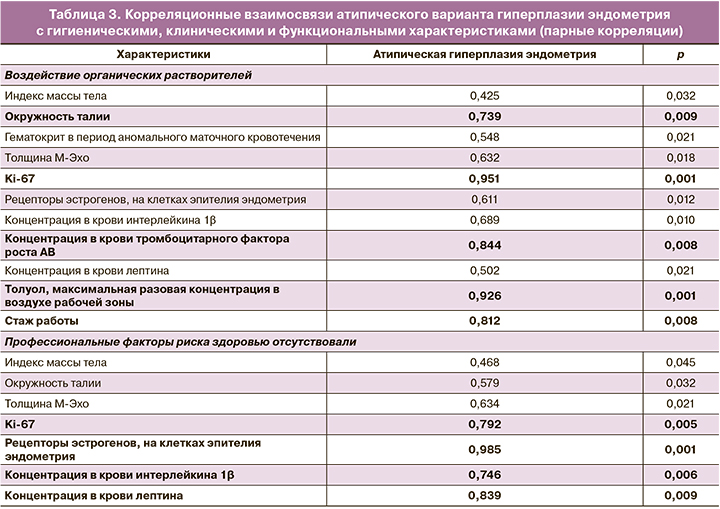
Корреляционный анализ показал сильные взаимосвязи атипического варианта гиперплазии эндометрия с окружностью талии, уровнем экспрессии Ki-67, концентрацией в крови PDGF-АВ, максимальной разовой концентрацией толуола в воздухе рабочей зоны, стажем работы. Также наблюдали статистически значимые взаимосвязи средней силы с гематокритом в период АМК, толщиной М-эхо, уровнем экспрессии рецепторов эстрогенов на клетках эндометрия, концентрациями в крови интерлейкина-1β и лептина, слабые – с индексом массы тела.
В группе контроля определены сильные корреляции атипической гиперплазии эндометрия с экспрессией Ki-67, экспрессией рецепторов эстрогенов на эпителиальных клетках эндометрия, концентрациями в системной циркуляции интерлейкина-1β и лептина, связи средней силы – с окружностью талии и толщиной М-эхо, слабые – с индексом массы тела (табл. 3).
Обсуждение
Ожирение – известный фактор риска гиперплазии эндометрия [7]. В данном исследовании дополнительно установлено, что воздействие органических растворителей увеличивает частоту атипических форм, способствует неблагоприятному течению заболевания с высокой частотой и тяжестью АМК. Увеличение экспрессии Ki-67 отражает большую пролиферативную активность клеток эндометрия в условиях воздействия химического фактора [16], особенно при сочетании с ожирением, что является неблагоприятным признаком с точки зрения возможности малигнизации.
Хорошо известна роль гиперэстрогении и изменений экспрессии клетками эндометрия эстрогеновых рецепторов в патогенезе гиперплазии эндометрия [7]. У исследуемых больных фактор ожирения был значимо связан с уровнем эстрогеновых рецепторов эндометрия, что соответствует литературным данным [17]. Вместе с тем, с клеточной пролиферацией, развитием новообразований и предраковых состояний ассоциированы процессы воспаления, ростовые факторы, в первую очередь профиброзные [18–20]. В данном исследовании определено увеличение сывороточных концентраций интерлейкинов 1β [21] и 6 [22] в зависимости от воздействия и химического фактора, и ожирения, увеличение профиброзных факторов TGF-β1 [18,19], FGF-2 [23], PDGF [24] у женщин с профессиональным риском. По данным корреляционного анализа, с наличием атипических вариантов гиперплазии эндометрия в условиях воздействия органических растворителей был связан профиброзный цитокин фактор роста тромбоцитов; у больных, не подвергавшихся воздействию химического фактора – уровень экспрессии эстрогеновых рецепторов, сывороточные концентрации лептина (ожирение и воспаление), провоспалительного цитокина интерлейкина 1β. В этой связи можно предположить влияние органических растворителей на клинические и патогенетические особенности гиперплазии эндометрия за счет индукции воспалительного ответа и фиброобразования, влияние ожирения – посредством индукции воспаления. Увеличение экспрессии Ki-67 в условиях воздействия органических растворителей, взаимосвязи концентрации толуола в воздухе рабочей зоны и атипической гиперплазии эндометрия не исключают и прямого воздействия токсиканта. Наблюдаемый в исследуемых группах синергизм действия химического фактора и ожирения на маркеры процессов пролиферации, воспаления, фиброза может приводить к тяжелому течению заболевания.
Выводы
Гиперплазия эндометрия в условиях воздействия органических растворителей характеризуется частотой атипических форм, аномальных маточных кровотечений, увеличением толщины М-эхо, увеличением экспрессии Ki-67 в эндометрии, концентраций в крови интерлейкинов 1β и 6, трансформирующего фактора роста β1, тромбоцитарного фактора роста, фактор роста фибробластов 2. Коморбидное ожирение усугубляет эффекты органических растворителей на фенотип гиперплазии эндометрия.



