Современные методы диагностики и лечения позволяют достичь высокой выживаемости пациенток с онкологическими заболеваниями. Однако в связи с риском развития преждевременной недостаточности яичников в результате химио- и радиотерапии встает вопрос о сохранении репродуктивного потенциала пациенток, повышении качества их жизни после перенесенного лечения.
Предпочтительным методом сохранения фертильности онкологических пациенток в настоящее время является криоконсервация ооцитов или эмбрионов, полученных в результате стимуляции суперовуляции. Однако проведение гормональной стимуляции не всегда возможно ввиду необходимости срочного начала терапии, неудовлетворительного состояния здоровья пациентки, препубертатного возраста, наличия эстрогензависимых опухолей. В таких случаях возможна криоконсервация коркового вещества яичника с последующей аутотрансплантацией после выздоровления [1]. Но в зависимости от стадии и типа рака (гемобластозы, рак яичника и раки, метастазирующие в яичник) трансплантация после выздоровления может привести к рецидиву заболевания [2–4]. В таком случае единственным способом сохранения фертильности становится криоконсервация ооцитов, полученных из антральных фолликулов мозгового слоя яичника после овариэктомии [5–7].
Так как получаемые из экстракорпорального яичника ооциты являются незрелыми, для последующего использования этих клеток в программах вспомогательных репродуктивных технологий (ВРТ) необходимо провести их дозревание в условиях in vitro (IVM – англ. in vitro maturation). По данным литературы, частота дозревания таких ооцитов составляет 30–60% [8]. Такие клетки можно оплодотворить спермой мужа или анонимного донора либо витрифицировать. Большинство работ, посвященных изучению IVM ооцитов, полученных из мозгового слоя яичника, представлено в виде клинических случаев. Очень мало известно о компетентности таких яйцеклеток, их способности к оплодотворению и дальнейшему развитию. На данный момент опубликованы данные лишь о трех беременностях, наступивших с применением таких ооцитов, две из которых завершились рождением здоровых детей [9–11]. Таким образом, большой интерес представляет изучение эффективности дозревания ооцитов и их потенциала к развитию у широкой группы онкологических пациенток.
Цель исследования – изучение дозревания в условиях in vitro ооцитов, полученных в ходе овариэктомии у онкологических пациенток.
Материалы и методы
В исследование были включены 24 пациентки в возрасте от 16 до 42 лет, проходившие лечение по поводу онкологических заболеваний с июня 2018 по апрель 2019 гг. Хирургическое лечение 20 пациенткам проводилось в ФГБУ «НМИЦ АГП им. академика В.И. Кулакова», и еще 4 были направлены на консультацию к репродуктологу 1-го гинекологического отделения Центра перед проведением радикального лечения из других медицинских учреждений Москвы. Консилиумом в составе онколога, хирурга и репродуктолога пациенткам, в зависимости от их возраста, семейного положения, диагноза и предполагаемого протокола терапии, были предложены комбинации способов сохранения репродуктивного потенциала – криоконсервация яичниковой ткани и дозревание ооцитов, полученных в ходе овариэктомии, в условиях in vitro с последующей криоконсервацией или оплодотворением сперматозоидами партнера или анонимного донора.
В ходе лапароскопической операции или операции кесарева сечения (КС) производилась частичная или полная овариэктомия. Извлеченную овариальную ткань помещали в 0,9% раствор NaCl и транспортировали в эмбриологическую лабораторию в течение 15 мин (при 37 оС) в пределах Центра или в течение 2 ч (при 37 оС или на льду) – при транспортировке из других лечебных учреждений для дальнейшего препарирования. Все видимые антральные фолликулы (более 2 мм в диаметре) аспирировали с применением инъекционной иглы (21G), присоединенной к шприцу (10 мл). Фолликулярную жидкость помещали в чашку Петри со средой для манипуляций с гаметами Ооклин (Панэко) и оценивали на наличие ооцит-кумулюсных комплексов (ОКК) под стереомикроскопом. Около 5% свежей овариальной ткани фиксировали с применением 3% раствора формалина для дальнейшего гистологического исследования. После этого корковый слой яичника отделяли от мозгового с помощью хирургических скальпелей, мозговой слой дополнительно измельчали, а среду, в которой проводились манипуляции, оценивали на наличие ОКК.
Все полученные ОКК культивировали в четырехлуночных планшетах (до 7 ОКК в лунке) в среде для дозревания ооцитов (SAGE, CooperSurgical) с добавлением 0,75 МЕ/мл менопаузального гонадотропина человека (Менопур, Ферринг) и 20% сывороточного альбумина человека (Альбурекс, Беринг) при 37 оС в атмосфере 6% СО2 и 5% О2. Через 48 ч культивирования ОКК помещали в 80 ЕД/мл раствор гиалуронидазы (Origio, CooperSurgical) и аккуратно пипетировали для удаления кумулюсных клеток. Зрелость яйцеклеток оценивали по морфологическим признакам, и все незрелые ооциты возвращали в среду для дозревания еще на 24 ч. Зрелые яйцеклетки криоконсервировали с применением стандартного протокола витрификации (Kitazato, Япония).
При наличии добровольного информированного согласия пациентки на оплодотворение зрелых ооцитов спермой партнера или анонимного донора оплодотворение проводили методом интрацитоплазматической инъекции сперматозоида (ИКСИ). Полученные эмбрионы культивировали в средах G-1 Plus и G-2 Plus (Vitrolife, Швеция) при 37 оС в атмосфере 6% СО2 и 5% О2 в течение 5–6 суток. Качество эмбрионов оценивали на 3, 5 и 6-й дни культивирования. Всем полученным бластоцистам проводили биопсию трофэктодермы с целью последующего преимплантационного генетического тестирования на анеуплоидии. Генетический анализ образцов трофэктодермы проводился методом высокопроизводительного секвенирования (NGS) c использованием Ion ReproSeq PGS Kit (Thermo Fisher Scientific, США) согласно инструкции производителя. Выявление анеуплоидий было произведено с помощью генетического анализатора Applied Biosystems 3130 (4-capillary). Бластоцисты криоконсервировали с применением набора для витрификации (Kitazato).
Корковый слой яичника нарезали квадратами со стороной 0,5 см и толщиной около 1 мм на подогреваемой поверхности (37 оС). Фрагменты эквилибрировали в растворе криопротекторов (1,5 M этиленгликоль и 0,1 М сахароза) в течение 20 минут на льду, затем помещали в криопробирки (по 4 фрагмента в каждую пробирку) и замораживали с использованием медленного протокола криоконсервации в программируемом замораживателе (Kryo 360 — 1.7, Planer PLC).
В ходе исследования оценивали частоту дозревания ооцитов, частоту оплодотворения, дробления и формирования бластоцист. Кроме того, оценивали морфологические особенности зрелых ооцитов и частоту встречаемости отдельных цитоплазматических и экстрацитоплазматических дисморфизмов.
Результаты
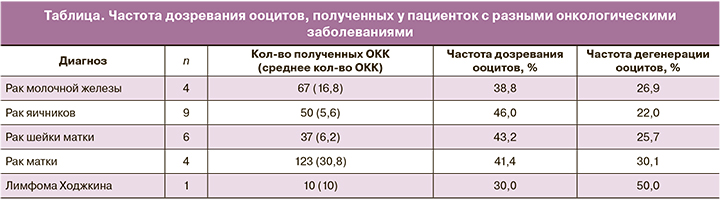
В ходе исследования была произведена овариэктомия пациенткам с различными онкологическими заболеваниями: рак молочной железы – 4 случая, рак яичников – 9, рак шейки матки – 6, рак матки – 4, лимфома Ходжкина – 1 случай. В ходе лапароскопической операции овариэктомия была проведена в 22 случаях, в 2 случаях яичниковую ткань получали в ходе операции КС в связи с обнаружением онкологического заболевания во время беременности. По крайней мере один курс химиотерапевтического лечения до овариэктомии прошли 2 пациентки.
В эмбриологическую лабораторию 20 образцов яичниковой ткани были доставлены в течение 15 мин ут при 37 оС, 2 образца транспортировали в течение 1,5–2 ч при 37 оС и 2 образца транспортировали в течение 1,5–2 ч при 4 оС.
В 11 случаях в эмбриологическую лабораторию доставляли 1 или 2 интактных яичника, в 13 – фрагменты различного размера в связи с ранее проведенной резекцией или необходимостью срочного гистологического исследования части извлеченного яичника.
Криоконсервация яичниковой ткани была произведена 18 пациенткам в сочетании с дозреванием ооцитов, полученных путем аспирации антральных фолликулов из мозгового слоя яичника, 6 пациенткам – только дозревание ооцитов в условиях in vitro. Витрификация зрелых ооцитов была произведена в 12 случаях, в 7 получено согласие пациенток на оплодотворение и 1 пациентка предпочла комбинацию методов.
Всего 287 ОКК было получено у 21 (87,5%) пациентки из 24. Среднее количество получаемых ОКК – 13,6 (от 1 до 77 ОКК от пациентки). У 3 (12,0%) из 25 пациенток ОКК получить не удалось. 90 (31,4%) ооцитов достигли стадии метафазы II (MII) через 48 ч культивирования в среде IVM; еще 29 (10,1%) ооцитов дозрели спустя 24 ч. Общая частота дозревания ооцитов в условиях in vitro составила 41,4% (119/287), и 28,2% (81/287) ооцитов дегенерировали (таблица). После денудации в цитоплазме 3 ооцитов визуализировались 1 или 2 пронуклеуса и еще 6 были обнаружены на стадии дробления (2–4 бластомера). Развитие 78 (27,1%) ооцитов остановилось на стадии метафазы I (MI) или герминального везикула (GV).
Как минимум один тип дисморфизма яйцеклетки был обнаружен в 42 (35,3%) зрелых ооцитах. В женских половых клетках наблюдались следующие аномалии: изменения формы и размеров ооцитов (гигантский ооцит – 1, аномальная форма – 2), цитоплазматические включения (скопления гладкого эндоплазматического ретикулума – 1, грануляция цитоплазмы – 1, вакуоли – 7), увеличенное перивителлиновое пространство – 16, аномалии первого полярного тельца (фрагментация – 8, увеличение – 5, уменьшение размера – 1).
На стадии MII 64 ооцита были витрифицированы по желанию пациенток. Методом ИКСИ были оплодотворены 55 зрелых ооцитов. Через 18 ч после оплодотворения в 11 зиготах визуализировались 2 пронуклеуса, в 12 зиготах – 1 или 3 пронуклеуса; в 28 ооцитах признаков оплодотворения не наблюдалось, 2 дегенерировали в результате проведения процедуры оплодотворения и 2 были обнаружены на стадии дробления (2 бластомера). На 3-и сутки после оплодотворения 1 эмбрион был на стадии 8 бластомеров, 6 эмбрионов – на стадии 5–6 бластомеров и 4 эмбриона – на стадии 2–4 бластомеров. На 6-й день культивирования были получены 3 бластоцисты, которые были оценены, как 5АА, 5ВВ и 3СС, согласно критериям Гарднера. Таким образом, частота оплодотворения составила 20,0%, частота дробления – 100%, а частота формирования бластоцист – 27,3%. Генетический анализ образцов трофэктодермы полученных бластоцист показал наличие в них эуплоидного хромосомного набора.
Обсуждение
В настоящее время IVM получил применение в широкой клинической практике у пациенток с синдромом поликистозных яичников. В ходе данных программ ВРТ забор незрелых ооцитов производят путем трансвагинальной пункции яичников, а затем проводят их дозревание в условиях in vitro с последующим оплодотворением. Более 5000 здоровых детей рождены в результате применением данной технологии [12].
Получение незрелых ооцитов из мозгового слоя при подготовке яичниковой ткани к криоконсервации впервые было описано в 2013 г. [13] и с тех пор получает все большее распространение в клинической практике [5–8].
В нашем исследовании было показано, что при подготовке ткани яичника к криоконсервации в 87,5% случаев могут быть получены ОКК. Однако 28,2% из них оказываются дегенеративными или дегенерируют в процессе культивирования. Несмотря на то что частота дозревания ооцитов в условиях in vitro мала, в нашем исследовании у 79% пациенток был получен как минимум 1 зрелый ооцит.
Низкая частота дозревания и потенциал полученных ооцитов могут быть связаны как с влиянием онкологического заболевания на овариальный резерв [14], так и с несовершенством условий культивирования клеток в лаборатории. В процессе созревания ооцитов in vivo ключевую роль играют паракринные механизмы и взаимодействие с клетками кумулюса, которые предоставляют метаболическую поддержку и транспортируют регуляторные сигналы [15]. При извлечении ОКК отсутствие фолликулярного окружения может провоцировать асинхронность процессов ядерного и цитоплазматического созревания и приводить к снижению потенциала развивающегося в условиях in vitro ооцита. В настоящее время ведутся исследования влияния паракринных взаимодействий на процессы созревания [16, 17]. На экспериментальных моделях и ОКК, полученных в ходе трансвагинальной пункции у пациенток с синдромом поликистозных яичников, было показано, что добавление некоторых биологически активных веществ в среду IVM позволяет точнее имитировать условия in vivo, что повышает частоту созревания ооцитов, увеличивает количество и улучшает качество получаемых после оплодотворения эмбрионов [18, 19].
У 35,3% зрелых ооцитов в нашем исследовании были обнаружены те или иные дисморфизмы, 33,3% из которых составили аномалии первого полярного тельца. Это может быть косвенным свидетельством нарушений мейотического деления в таких клетках. Тем не менее исследование веретен деления дозревших ооцитов до и после витрификации в работе Lierman S. et al. [20] показало, что они имеют правильную форму с нормальным расположением хромосом. Вопрос физиологичности протекания мейоза в клетках в процессе IVM все еще остается открытым и требует дальнейшего изучения.
Кроме того, необходимы широкие многоцентровые исследования для определения эффективности программ ВРТ с использованием ооцитов, полученных из мозгового слоя яичника. В трех известных в настоящее время работах криоконсервацию и перенос эмбрионов производили на 2–3-е сутки развития [9–11]. В ходе нашего исследования из яйцеклеток, извлеченных из экстракорпорального яичника, впервые в мировой практике были получены бластоцисты и проведена оценка их хромосомного статуса. Отсутствие анеуплоидий в эмбрионах указывает на то, что дозревание ооцитов, полученных из овариальной ткани, может проходить правильно.
Заключение
Таким образом, дозревание ооцитов, полученных из мозгового слоя яичника после овариэктомии, является перспективным методом сохранения репродуктивного потенциала у онкологических пациенток. Однако до внедрения данного метода в рутинную практику требуются дополнительные исследования для совершенствования условий дозревания и оценки влияния IVM на потенциал полученных ооцитов, развитие эмбрионов и здоровье потомства.



