В последние годы существенно возросло число случаев беременности на фоне злокачественных новообразований. Наиболее распространенными раковыми заболеваниями, связанными с беременностью, являются гинекологические, гематологические, рак молочной железы (РМЖ) и кожи. Принимая во внимание увеличение возраста первородящих женщин, можно предположить, что частота выявления онкологических заболеваний, в том числе РМЖ, во время беременности также будет увеличиваться [1–3].
Диагностированное во время беременности злокачественное новообразование часто воспринимается как ситуация, которая ставит жизнь матери в конфликт с ее плодом. Поэтому в случае решения о сохранении беременности основная задача состоит в лечении матери без ущерба для плода, то есть польза для матери должна быть сбалансирована с риском для ребенка. В то же время, существуют данные, свидетельствующие о том, что прерывание беременности не улучшает исход для женщин с РМЖ [4]. Решение о лечении рака следует принимать совместно с пациентом, после тщательного рассмотрения рисков и выгод в каждом конкретном случае [5,6].
Химиотерапия является одним из ведущих методов лечения онкологических заболеваний [7]. Почти все химиотерапевтические средства оказывают тератогенное действие на животных, и в отношении некоторых препаратов существуют только экспериментальные данные. Однако дозы, применяемые у человека, часто ниже, чем минимальные тератогенные дозы для животных. Потенциальное тератогенное действие любого химиотерапевтического агента, используемого во время беременности, зависит от суммарной дозы и от стадии развития плода. Химиотерапия в течение первого триместра увеличивает риск спонтанных абортов, внутриутробной смерти и крупных пороков [8–10]. Но и после органогенеза некоторые органы и системы, включая глаза, гениталии, кроветворную систему и центральную нервную систему, остаются уязвимыми к химиотерапии. В связи с этим, возникают опасения по поводу состояния здоровья детей, внутриутробно подвергшихся действию химиотерапевтических препаратов.
Помимо прямой потенциальной тератогенности, противоопухолевые химиотерапевтические препараты могут негативно повлиять на течение беременности, являясь причиной спонтанных абортов, задержки внутриутробного развития и низкого веса при рождении [4]. Показано, что мультидисциплинарный подход к ведению беременности у пациенток с РМЖ имеет решающее значение для оптимизации исходов, как для матери, так и для плода. В большинстве случаев комплексная работа специалистов различных областей дает хорошие онкологические и акушерские результаты при ведении беременных женщин с РМЖ [7, 10–12].
Тем не менее, имеющиеся в литературе сведения недостаточно полно характеризуют состояние здоровья новорожденных у матерей с онкологическими заболеваниями, а данные о состоянии их иммунной системы практически отсутствуют. Представляет несомненный интерес выявление зависимости субпопуляционного состава лимфоцитов от особенностей течения беременности, клинических проявлений заболевания и способа терапии пациенток с онкологическими заболеваниями.
Цель настоящего исследования: охарактеризовать состояние здоровья и оценить иммунный статус новорожденных у матерей с онкологическими заболеваниями, получавших химиотерапию во время беременности.
Материал и методы исследования
В проспективное когортное исследование было включено 64 новорожденных (их них 4 двойни) у матерей с онкологическими заболеваниями, рожденных и находившихся под наблюдением в ФГБУ НЦАГиП им. В.И. Кулакова (2012–2016 гг.). В структуре онкологических заболеваний матери наиболее часто встречались: РМЖ, острый и хронический миело- и лимфолейкоз, лимфомы. Проводилась оценка течения раннего неонатального периода. Совместно с научно-консультативным педиатрическим отделением осуществлялось наблюдение детей в катамнезе.
Новорожденные были разделены на следующие группы: 1-ю группу составили дети (n=27), родившиеся у матерей с РМЖ, получавших во время беременности полихимиотерапию (ПХТ) по следующим схемам: АС (доксорубицин и циклофосфамид) и EC (эпирубицин и доксорубицин); 2-ю – дети (n=20), родившиеся у матерей с РМЖ, не получавших ПХТ; 3-ю – дети (n=6), родившиеся у матерей с лимфомами Ходжкина и неходжкинскими лимфомами, получавших во время беременности ПХТ по схеме: BEACOPP (блеомицин, этопозид, доксорубицин, винкристин, прокарбазин, преднизолон) и схеме ABVD (доксорубицин, блеомицин, винбластин, дакарбазин), также использовалась терапия иматинибом; 4-ю – дети (n=11), родившиеся у матерей с Ph-негативными миелопролиферативными новообразованиями (эссенциальная тромбоцитемия, истинная полицетемия, первичный миелофиброз), которые получали во время беременности иммуномодулирующую терапию рекомбинантным интерфероном (ИФН)-α.
Дети оценивались по возрасту гестации, антропометрическим показателям и шкале Апгар на 1-й и 5-й минутах. Всем детям проводили физикальный осмотр, оценку зрелости по шкале Баллард, недоношенным детям оценку физического развития проводили с помощью кривых роста Фентона [13]. Контроль клинического анализа крови с целью диагностики нейтропении, анемии, тромбоцитопении проводился на 1-е и 3–5-е сутки жизни ребенка. Всем детям проводилось ультразвуковое исследование головного мозга, сердца, органов брюшной полости и почек, оценка течения раннего неонатального периода. Ретроспективный анализ 60 историй родов женщин (из них 44 больных РМЖ и 16 больных лимфомами и Ph-негативными миелопролиферативными новообразованиями) учитывал соматический, акушерско-гинекологический анамнез, течение беременности и родов, а также способ родоразрешения.
С целью оценки иммунного статуса матери и ребенка для определения влияния получаемого матерью лечения во время беременности на иммунную систему, как матери, так и плода, проводился забор венозной крови перед родами у женщин с онкологическими заболеваниями, получавших ПХТ и женщин с гемобластозами, получавших ИФН (n=27), и пуповинной крови их новорожденных (n=27). Результаты иммунологического обследования сравнивались с показателями женщин с физиологическим течением беременности (n=26) и с данными их новорожденных (n=26), составивших контрольную группу.
Фенотипирование лимфоцитов периферической крови осуществляли методом проточной цитометрии на приборе FACSCanto II (Becton Dickinson, США) с использованием моноклональных антител к поверхностным маркерам CD3, CD5, CD16, CD95, меченных FITC (флуоресцеина изотиоцианатом) и к CD4, CD8, CD19, CD56, HLA-DR, меченных PE (фикоэритрином) (BD Biosciences, США). Для оценки позитивно-окрашенных субпопуляций использовали соответствующие FITC или PE-меченые изотипические IgG. Лейкоцитарный гейт, позволяющий исключить из анализа другие клетки крови, выявляли с помощью моноклональных антител к CD45, меченных PerCP (перидинин-хлорофилл протеином). Данные анализировали, используя программу FACSDiva (Becton Dickinson, США). Абсолютное содержание лимфоцитов исследуемых субпопуляций рассчитывали, исходя из результатов клинического анализа крови. Содержание иммуноглобулинов классов М и G в сыворотке крови определяли турбидиметрическим методом c использованием коммерческих наборов (Human, Германия).
Статистическую обработку данных проводили методом вариационной статистики с использованием пакетов статистических программ для Microsoft Office Excel 2007 и MedCalc для Windows 7. Данные представлены как среднее значение ± стандартное отклонение (M±SD). Различия считали достоверными при уровне значимости р<0,05.
Результаты исследования и обсуждение
В структуре онкологических заболеваний в исследуемых группах наиболее часто встречался РМЖ – 73,3% от общего числа женщин, гемобластозы составляли 26,7%. Пациентки, включенные в исследование, были сопоставимы по возрасту. Средний возраст женщин, больных РМЖ, которым проводилась ПХТ во время беременности (n=27), составил 31±4,4 года, возраст женщин без ПХТ (n=20) – 34,5±5,4 года. Средний возраст женщин, больных гемобластозами, которым проводилась ПХТ (n=6), составил 31±4,5 года; возраст женщин, получавших интерферонотерапию (n=11) – 30,5±5,1 года; средний возраст женщин в контрольной группе (n=26) – 28,2±3,1 года.
Среди женщин, больных РМЖ, получавших и не получавших ПХТ, наиболее часто встречались такие осложнения течения беременности, как угроза прерывания (23,4 и 12,8% соответственно), токсикоз (27,6 и 14,9%), обострение хронического пиелонефрита (2,4% в обеих группах). Анемия легкой и средней степени тяжести (31,9%) и синдром задержки развития плода (2,1%) встречались в первой группе, истмико-цервикальная недостаточность (4,2%), артериальная гипертензия (6,4%) и ОРВИ (4,2%) – во второй. У женщин с лимфомами, получавших ПХТ, течение беременности осложнялось анемией (29,4%), токсикозом (11,7%), обострением пиелонефрита и задержкой развития плода (5,8%). Среди женщин, получавших интерферонотерапию, в 29,4% случаев встречалась угроза прерывания, анемия (23,5%), артериальная гипертензия (11,7%), токсикоз и обострение пиелонефрита – в 5,8% случаев.
Родоразрешение в группе матерей с РМЖ, которым проводилась ПХТ, в 44,4% случаев произошло через естественные родовые пути, в 55,6% случаев – путем операции кесарева сечения. В группе матерей без ПХТ 25% родоразрешений произошли через естественные родовые пути, а в 75% случаев проводилась операция кесарева сечения. Одним из ведущих показаний к оперативному родоразрешению являлась необходимость, как можно раньше провести более агрессивную терапию онкологического заболевания у матери.

В группе матерей с лимфомами, получавших ПХТ, 50% родоразрешений произошли через естественные родовые пути, в 50% случаев – путем операции кесарева сечения. У матерей с терапией ИФН 18,2% родоразрешений произошли через естественные родовые пути, в 27,3% путем вакуум экстракции плода, в 54,5% случаев проводилось кесарево сечение.
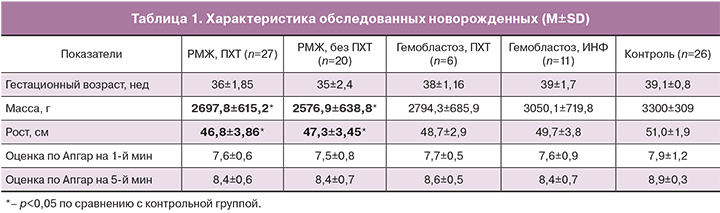
Новорожденные от матерей с онкологическими заболеваниями имели более низкие массо-ростовые показатели по сравнению с новорожденными из контрольной группы. Дети из исследуемых групп были сопоставимы по антропометрическим характеристикам и оценке по шкале Апгар на 1-й и 5-й минутах (табл. 1).
В группе с ПХТ недоношенными родилось 59,3% детей, в группе без химиотерапии – 70%, из них на сроке беременности менее 32 недель 5% от общего числа детей. В этом случае показанием к родоразрешению являлось прогрессирование онкологического заболевания и необходимость более агрессивной терапии у матери, а не показания со стороны плода. У женщин, больных РМЖ, преобладали «поздние недоношенные» новорожденные, представляющие собой особую группу детей, которая имеет более высокий риск развития таких патологических состояний как респираторные нарушения, реализация внутриутробной инфекции, нарушения терморегуляции, проблемы усвоения питания, гематологические изменения, гипербилирубинемия и метаболические нарушения. В группе женщин с гемобластозами, получавших ПХТ, недоношенными родилось 16,7% детей, при терапии ИНФ – 18,2%. В этих группах преобладали доношенные дети, однако в группе с ПХТ 16,7% новорожденных родилось «поздними недоношенными», с ИНФ – 18,2%.
В структуре заболеваемости новорожденных от матерей с РМЖ преобладали респираторные нарушения, причем наиболее часто респираторный дистресс-синдром встречался в группе детей без проведения химиотерапии во время беременности, что связано с преждевременным родоразрешением. Также в большем проценте случаев в данной группе была диагностирована врожденная пневмония, транзиторное тахипноэ, асфиксия легкой степени, рождение маловесными к сроку гестации.
В группе новорожденных у матерей с гемобластозами и ПХТ во время беременности чаще выявлялось апноэ недоношенных, внутрижелудочковое кровоизлияние 1-й степени, стойкое фетальное кровообращение и рождение детей маловесными к сроку гестации. В группе детей, матери которых во время беременности получали терапию ИФН, в большем проценте диагностирован респираторный дистресс-синдром, транзиторное тахипноэ, инфекция мочевыводящих путей. Следует отметить, что ни в одном случае у новорожденных не выявлено врожденных пороков развития и гематологических нарушений. При анализе заболеваемости в исследуемых группах значимых различий не выявлено (табл. 2).
Установлено, что в группе новорожденных у женщин с РМЖ без химиотерапии во время беременности в 35% случаев потребовалось проведение респираторной поддержки, в то время как в группе с химиотерапией – в 25,9%.
Среди детей, родившихся у матерей с гемобластозами, в группе с ПХТ не было показаний для респираторной терапии, а в группе с терапией ИФН двум детям (18,2%) потребовался перевод в отделение реанимации и интенсивной терапии новорожденных и проведение респираторной терапии путем неинвазивной искусственной вентиляции легких методом Biphasic, далее новорожденные последовательно были переведены на СРАР (Continuous Positive Airway Pressure), затем на высокопоточные канюли.
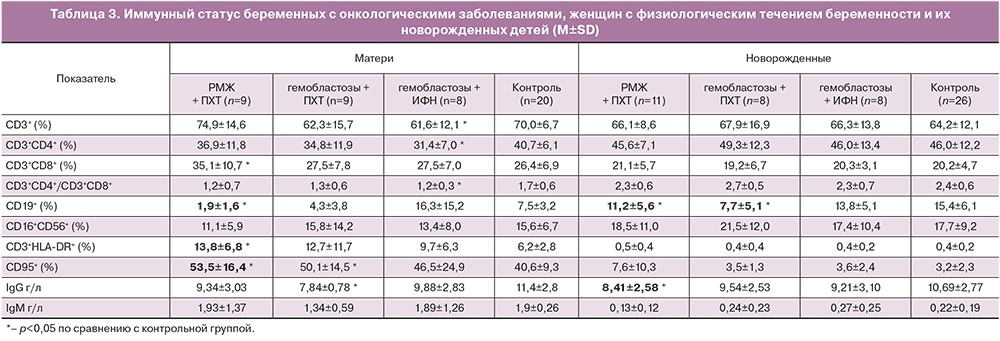
Как известно, химиотерапия обладает миело- и иммунносупрессивным действием. В наблюдаемых группах детей, матери которых получали ПХТ во время беременности, не отмечалось существенной депрессии ростков кроветворения, и, соответственно, выраженных гематологических нарушений. Выявлено статистически значимое снижение абсолютного числа лимфоцитов в периферической крови матерей исследуемых групп по сравнению с контрольной группой (1,2±0,5 ×109; 1,7±0,4 ×109 и 1,5±0,7 ×109 клеток/литр против 1,9±0,4 ×109 клеток/литр в контрольной группе, p<0,05). Также определены изменения в субпопуляционном составе Т- и В-лимфоцитов (табл. 3).
В группе беременных с гемобластозами, получавших интерферонотерапию (4-я группа), статистически значимо был снижен процент CD3+ Т-лимфоцитов, в основном за счет субпопуляции CD4+ Т-лимфоцитов. У женщин с РМЖ (1-я группа) наблюдалось увеличение относительного количества CD8+ Т-цитотоксических клеток. Во всех группах с онкологическими заболеваниями наблюдалась явная тенденция к снижению иммунорегуляторного индекса (соотношения CD4+ Т-хелперов к CD8+ Т-цитотоксическим клеткам), однако статистически значимые различия с контролем получены лишь в 4-й группе женщин. По-видимому, это можно объяснить большим разбросом данных и малой выборкой.
Для популяции Т-лимфоцитов всех исследуемых групп женщин характерно увеличение процента активированных Т-клеток, экспрессирующих HLА-DR-антиген, по сравнению с контролем.
В группах беременных с онкологическими заболеваниями, получавших ПХТ (1-я и 3-я группы), статистически значимо снижено содержание абсолютного количества CD3+ Т-лимфоцитов (0,86±0,46 ×109/л и 1,0±0,3 ×109/л соответственно против 1,34±0,3 в контрольной группе). В основном это происходило за счет уменьшения количества CD4+ Т-клеток (0,41±0,2 ×109/л и 0,53±0,18 ×109/л соответственно против 0,78±0,2 ×109/л в контрольной группе). Значимых различий в абсолютном содержании остальных субпопуляций Т-лимфоцитов у беременных исследуемых групп не установлено.
Показано, что абсолютное содержание CD19+ В-лимфоцитов значительно снижено в обеих группах беременных, получавших ПХТ: 0,03±0,03 ×109/л в 1-й группе и 0,07±0,06 ×109/л в 3-й группе против 0,14±0,07 ×109/л – в контрольной. Относительное содержание CD19+ В-лимфоцитов значимо ниже у женщин с РМЖ, получавших химиотерапию.
При определении уровня иммуноглобулинов в сыворотке периферической крови обнаружено снижение концентрации IgG у женщин с гемобластозами, получавших химиотерапию, по сравнению с контролем.
У беременных с онкологическими заболеваниями, получающих ПХТ, увеличена доля лимфоцитов, несущих Fas-антиген (CD95) – маркер готовности клетки к апоптозу. В других группах наблюдалась лишь тенденция к увеличению содержания таких клеток.
Статистически значимых различий в субпопуляционном составе лимфоцитов между группами исследуемых женщин не наблюдалось.
Несмотря на значимые изменения в содержании ряда субпопуляций Т-лимфоцитов в крови матерей с РМЖ и гемобластозами, получающих ПХТ или терапию ИФН, аналогичных изменений в пуповинной крови новорожденных не обнаружено.
В пуповинной крови различия в иммунорегуляторных индексах между исследуемыми группами и контролем отсутствовали, но соотношение CD4+ и CD8+ Т-лимфоцитов у новорожденных во всех группах было значимо выше, чем у матерей. Кроме того, обращает на себя внимание более высокая вариабельность этого показателя внутри групп матерей с онкологическими заболеваниями по сравнению с показателями в контрольной группе и в группах новорожденных. Более выраженные индивидуальные различия в группах могут зависеть от различий в форме и активности заболевания, как и от различий в лечебной тактике.
Выявлено значимое снижение относительного содержания популяции В-лимфоцитов в группах новорожденных, матери которых получали химиотерапию, тогда как доля В-лимфоцитов в пуповинной крови новорожденных у матерей при терапии ИФН статистически не отличалась от контроля. В пуповинной крови новорожденных от матерей с РМЖ на фоне химиотерапии определялся сниженный уровень IgG.
Таким образом, в пуповинной крови новорожденных значимых изменений в содержании субпопуляций Т-лимфоцитов, подобных наблюдаемым у матерей с РМЖ и гемобластозами, получавших химиотерапию или лечение ИФН, не обнаружено, но выявлено значимое снижение содержания В-лимфоцитов. Снижение содержания В-клеток у новорожденных, возможно, следует учитывать при определении сроков вакцинации. Об отсутствии выраженного влияния иммуносупрессивной терапии матери на состояние иммунной системы у ребенка указывали авторы, проводившие в течение года сравнительное исследование детей от матерей с аутоиммунными заболеваниями, получавших и не получавших во время беременности лечение иммунодепрессантами [14]. Они не наблюдали различий между группами по содержанию лимфоцитов, относительному содержанию B- и T-лимфоцитов, а также по уровню иммуноглобулинов.
В нашей работе обнаружены изменения в содержании и соотношениях иммунокомпетентных клеток у обследованных беременных женщин с онкологическими заболеваниями на фоне иммуносупрессивной терапии, однако в большинстве случаев изменения не носят ярко выраженных признаков угнетения иммунной системы. Существенных изменений в иммунном статусе новорожденных у этих матерей по сравнению с новорожденными контрольной группы не было обнаружено, что может свидетельствовать о минимальном воздействии на эмбрион и плод применяемой лекарственной терапии, необходимой для подавления активности заболевания и обеспечения успешного протекания беременности.
Заключение
Среди осложнений течения беременности у женщин с РМЖ, получавших и не получавших ПХТ, более часто встречались угроза прерывания, токсикоз, анемия. У женщин с гемобластозами на фоне ПХТ течение беременности часто осложнялось анемией и токсикозом, в группе с интерферонотерапией – угрозой прерывания, анемией, артериальной гипертензией. Для беременных с онкологическими заболеваниями на фоне иммуносупрессивной терапии характерны некоторые признаки дисбаланса в клеточном звене иммунитета, которые проявлялись снижением иммунорегуляторного индекса и количества В-лимфоцитов, увеличении содержания активированных Т-лимфоцитов и лимфоцитов, готовых к апоптозу.
Дети, рожденные женщинами с онкологическими заболеваниями, отличались более низкими массо-ростовыми показателями и повышенной частотой осложнений раннего неонатального периода, что нередко связано с преждевременным родоразрешением, необходимым для проведения более агрессивной терапии у матери. В пуповинной крови новорожденных от матерей с онкологическими заболеваниями и химиотерапией во время беременности выявлено снижение относительного содержания В-лимфоцитов при отсутствии значимых различий с контрольной группой по субпопуляционному составу Т-лимфоцитов. Выявленные отличия в состоянии здоровья и иммунном статусе новорожденных у матерей с онкологическими заболеваниями и химиотерапией во время беременности скорее можно объяснить меньшим гестационным возрастом, чем влиянием химиотерапии, получаемой матерью.
Междисциплинарный характер лечения, тщательный подбор препаратов и их дозировки, целью которого является максимальная польза для матери без нанесения вреда ребенку, имеют решающее значение для успешного исхода беременности у женщин с онкологическими заболеваниями, а также нормального становления и развития клеточных основ адаптивного иммунитета у плода.



