Синдром поликистозных яичников – самая частая эндокринопатия у женщин репродуктивного возраста [1]. Высокая распространенность СПКЯ, которая варьирует от 6 до 20% и зависит от диагностических критериев, оправдывает растущий интерес эндокринологов и привлекает значительное внимание общественности к данной проблеме [1, 2]. В 2012 г. Отдел по профилактике болезней Национальных институтов здоровья США (National Institutes of Health) организовал Семинар по методологии на основе фактических данных (Evidence-based Methodology Workshop), в рамках которого были пересмотрены диагностические критерии СПКЯ и рекомендовано придерживаться «Роттердамских критериев» 2003 г. Группа экспертов также рекомендовала определять фенотип синдрома в каждом случае: 1) гиперандрогения и овуляторная дисфункция; 2) гиперандрогения и поликистозные яичники; 3) овуляторная дисфункция и поликистозные яичники; 4) гиперандрогения, овуляторная дисфункция и поликистозные яичники [3].
Общеизвестно, что СПКЯ характеризуется не только репродуктивными, но и метаболическими расстройствами, которые определяют высокий риск развития нарушенной толерантности к глюкозе, сахарного диабета 2-го типа и могут приводить к увеличению частоты сердечно-сосудистых заболеваний, особенно в постменопаузе [1–4].
В настоящее время модификация образа жизни рассматривается как терапия первой линии у женщин с СПКЯ и высоким метаболическим риском, а также при наличии ожирения. Назначение метформина рекомендуется пациенткам с сахарным диабетом 2-го типа, нарушенной толерантностью к глюкозе, ожирением при неэффективности диеты и физических упражнений. Метформин может использоваться у женщин, которым противопоказаны гормональные контрацептивы, или при непереносимости этих препаратов. Кроме того, метформин рекомендован для профилактики синдрома гиперстимуляции яичников в программах экстракорпорального оплодотворения. Эксперты не рекомендуют использование других сенситайзеров инсулина для лечения нарушенной толерантности к глюкозе и сахарного диабета 2-го типа. Необходимы дальнейшие исследования по возможности использования статинов при СПКЯ [1, 4].
Таким образом, можно заключить, что на сегодняшний день отсутствуют рекомендации по коррекции доклинических нарушений метаболизма, предшествующих развитию нарушенной толерантности к глюкозе и сахарного диабета 2-го типа, а также факторов сердечно-сосудистого риска у женщин с СПКЯ, особенно при отсутствии ожирения.
Целью настоящего исследование было установить эффекты таурина и метформина в составе комбинированной терапии на антропометрические параметры, общую составляющую жировой ткани в организме, уровень артериального давления и частоту пульса, липиды, резистентность к инсулину натощак, чувствительность тканей к инсулину, функцию β-клеток, продолжительность менструального цикла и ультразвуковые параметры матки и яичников у женщин с СПКЯ.
Материал и методы исследования
В исследование включили 26 женщин с СПКЯ. Критерии включения: 1) письменное информированное согласие на участие в исследовании, 2) возраст от 18 до 45 лет, 3) диагноз СПКЯ, установленный в соответствии с «Роттердамскими критериями» 2003 г., 4) согласие на использование барьерной контрацепции в течение всего периода участия в исследовании. Критерии исключения: 1) прием комбинированных оральных контрацептивов, 2) беременность, 3) наличие острых или обострение хронических заболеваний, 4) соматические заболевания, требующие постоянного приема лекарственных препаратов, 5) нарушенная гликемия натощак, нарушенная толерантность к глюкозе и сахарный диабет в анамнезе, 6) отказ от участия в исследовании.
Всем пациенткам была назначена комбинированная терапия таурином (препарат дибикор, ООО «ПИК-ФАРМА», Россия) в дозе 500 мг два раза в день и метформином (препарат глюкофаж, «Мерк Сантэ с.а.с.», Франция) в стартовой дозе 500 мг один раз в день с титрацией дозы на 500 мг каждую неделю до дозы 500 мг четыре раза в день. Длительность лечения составила 3 месяца.
Проводилось антропометрическое обследование с определением роста, веса, окружности талии. Рост измеряли ростомером Person Chek (KaWe, Германия), вес – на электронных весах Seca-780 (Seca gmbh & co. kg, Германия). Окружность талии определяли на середине расстояния от нижнего края реберной дуги до вершины гребня подвздошной кости в конце выдоха. Индекс массы тела (ИМТ) рассчитывали как вес в килограммах, разделенный на рост в квадратных метрах.
Общую составляющую жировой ткани в организме, выраженную в процентах от веса, измеряли определителем жировых отложений Omron BF-306 (OMRON Healthcare Co., Ltd., Япония). Артериальное давление и частоту пульса измеряли тонометром Omron М2 Basic (OMRON Healthcare Co., Ltd., Япония).
Лабораторное обследование включало определение общего холестерина (ОХС), холестерина липопротеидов высокой плотности (ХС ЛПВП), триглицеридов (ТГ) энзиматическим колориметрическим методом. Уровень холестерина липопротеидов низкой плотности (ХС ЛПНП) рассчитывали по формуле: ХС ЛПНП = ХС (ммоль/л) ХС ЛПВП (ммоль/л) – ТГ (ммоль/л) × 0,45. Всем женщинам провели 3-часовой пероральный глюкозо-толерантный тест (ПГТТ) с нагрузкой 75 г глюкозы и определением глюкозы и инсулина натощак, через 30, 60, 120 и 180 мин для расчета чувствительности к инсулину и функции β-клеток при помощи математических моделей, адаптированных к использованию на основе ПГТТ. Глюкоза определялась энзиматическим колориметрическим методом, инсулин – методом твердофазного иммуноферментного анализа (диагностические наборы фирмы DRG Instruments GmbH, Германия).
Резистентность к инсулину натощак оценивали с использованием математической модели HOMA по формуле: HOMA = [инсулин натощак мкMЕ/мл) × глюкоза натощак (ммоль/л)] / 22,5. Чувствительность тканей к инсулину и функцию β-клеток рассчитывали при помощи математических моделей (M. Stumvoll и соавт., 2000) по формулам: «ISISTUM» = чувствительность периферических тканей к инсулину = 0,226 0,0032 × ИМТ (кг/м2) – 0,0000645 × инсулин на 120-й минуте (мкMЕ/мл) – 0,0037 × глюкоза на 60-й минуте (ммоль/л), 1st Phase = индекс первой фазы секреции инсулина = 1283 + 1,829 × инсулин на 30-й минуте (мкMЕ/мл) – 138,7 × глюкоза на 30-й минуте (ммоль/л) + 3,772 × инсулин базальный (мкМЕ/мл), 2nd Phase = индекс второй фазы секреции инсулина = 287 + 0,4164 × инсулин на 30-й минуте (мкМЕ/мл) – 26,07 × глюкоза на 30-й минуте (ммоль/л) + 0,9226 × инсулин базальный (мкMЕ/мл) [5].
Ультразвуковое исследование матки и яичников выполняли на аппарате Medison-SA 8000 EX трансабдоминальным и трансвагинальным датчиками в период с 12-го по14-й день менструального цикла.
Все указанные обследования выполнялись исходно и через 3 месяца лечения.
Математическую обработку полученных данных выполнили при помощи программы SPSS for Windows (версия 18). Все количественные данные представлены как медиана (Me) и квартили (Q25-75), так как большинство признаков имело распределение, отличающееся от нормального. Для сравнения признаков до и после лечения использовался критерий Уилкоксона для двух связанных групп. За критический уровень значимости принято значение p<0,05.
Результаты исследования
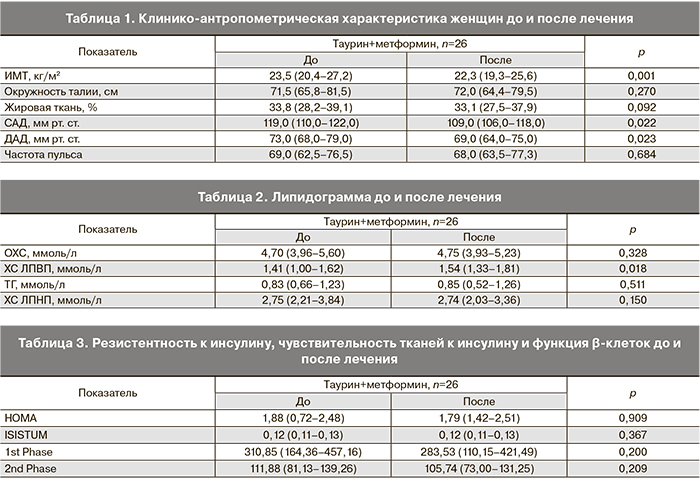
Комбинированная терапия таурином и метформином привела к снижению ИМТ, уровней систолического (САД) и диастолического (ДАД) артериального давления. Составляющая жировой ткани в организме после лечения уменьшилась, но изменения не достигли уровня статистической значимости (табл. 1).
Положительные изменения липидного профиля после терапии таурином и метформином заключались в повышении уровня ХС ЛПВП, в то время как остальные параметры липидограммы не изменились (табл. 2).
Комбинированная терапия таурином и метформином не повлияла на резистентность к инсулину натощак, чувствительность тканей к инсулину и функцию β-клеток (табл. 3). В то время как монотерапия таурином, согласно нашим данным, улучшает чувствительность тканей к инсулину и функцию β-клеток у женщин с СПКЯ [6].
Изменения в репродуктивной системе через 3 месяца лечения определялись укорочением периодов олигоменореи, характерных для СПКЯ. Так, максимальная продолжительность менструального цикла уменьшилась с 60,0 (49,0–178,8) дня до 37,5 (31,3–72,8), p=0,010. Ультразвуковые параметры матки и яичников, такие как размер тела матки, толщина эндометрия, объем яичников и размер фолликулов после терапии не изменились.
Обсуждение
Нами ранее были изучены эффекты таурина у женщин без избыточной массы тела и ожирения и показано, что терапия таурином в течение 3 месяцев приводит к снижению уровней САД и ДАД, уменьшению частоты пульса, повышает уровень ХС ЛПВП, улучшает чувствительность тканей к инсулину ISISTUM и функцию β-клеток (преимущественно индекс 2nd Phase). Также была отмечена тенденция к нормализации менструального цикла [6].
Клинические исследования продемонстрировали, что терапия метформином у женщин с СПКЯ приводит к снижению веса и содержанию висцеральной жировой ткани, оказывает корректирующее влияние на дислипидемию, улучшает чувствительность тканей к инсулину [4, 7–9]. Положительные изменения липидного профиля после терапии метформином характеризовались снижением ХС ЛПНП, повышением ХС ЛПВП [10]. В одном из долговременных исследований самые лучшие результаты заключались в снижении ИМТ, уменьшении ДАД, повышении ХС ЛПВП [11]. Доказано, что метформин повышает частоту овуляции и вероятность наступления беременности, особенно при наличии ожирения, однако данный эффект наблюдается не у всех пациенток [4, 7, 12–14]. A. Tomova и соавт. показали, что положительные эффекты метформина, в частности восстановление регулярного менструального цикла и снижение уровня антимюллерова гормона, преимущественно наблюдаются в подгруппах с ожирением и более высокой инсулинорезистентностью [15].
Таким образом, можно заключить, что комбинированная терапия метформином и таурином приводит к снижению ИМТ с тенденцией к уменьшению жировой составляющей в организме, что обусловлено преобладающим эффектом метформина. Снижение уровней САД и ДАД, вероятно, определяется эффектами таурина в составе комбинированной терапии. Оба препарата потенцируют свои эффекты, повышая уровень ХС ЛПВП. Комбинированная терапия метформином и таурином не повлияла на чувствительность к инсулину, однако таурин при монотерапии улучшает чувствительность периферических тканей к этому гормону. Функция β-клеток после терапии также не изменилась, в то время как монотерапия таурином улучшала индексы первой и второй фазы секреции инсулина. Метформин в комбинации с таурином значимо повлиял на продолжительность менструального цикла, что сопровождалось уменьшением длительности периодов олигоменореи.
Заключение
Положительные эффекты комбинированной терапии метформином и таурином характеризуются снижением ИМТ, уменьшением уровней САД и ДАД, повышением уровня ХС ЛПВП и появлением более регулярного менструального цикла. Необходимы дальнейшие исследования, чтобы определить, есть ли преимущество у комбинированной терапии в отношении монотерапии данными препаратами. Также необходимо дальнейшее изучение влияния этой комбинации на резистентность к инсулину натощак, чувствительность тканей к инсулину и функцию β-клеток в различных подгруппах СПКЯ – с нормальной массой тела, избыточной массой тела и ожирением, а также с разными характеристиками гликемических кривых в процессе ПГТТ. Комбинированная терапия метформином и таурином может быть рекомендована пациенткам с СПКЯ и избыточным весом, имеющим компоненты метаболического синдрома, такие как артериальная гипертония и снижение уровня ХС ЛПВП, для коррекции этих нарушений и менструального цикла.



