В настоящее время преэклампсия (ПЭ) остается одним из серьезных осложнений беременности, затрагивает от 2 до 5% всех беременностей и может приводить к неблагоприятным исходам для плода как в ближайшей, так и в долгосрочной перспективе.
У женщин с ПЭ в анамнезе в 2–4 раза повышается риск возникновения хронической артериальной гипертензии, в 2 раза увеличивается смертность от сердечно-сосудистых осложнений, а также в 1,5 раза повышается риск возникновения инсульта [1]. У плода возникают следующие антенатальные риски: задержка роста плода (ЗРП), преждевременные роды (чаще ятрогенные), олигогидрамнион, отслойка плаценты, дистресс-синдром и внутриутробная смерть плода [2–4]. Существует также мнение, что внутриутробное воздействие гипертензивных расстройств у беременной может привести к значительным сердечно-сосудистым последствиям у потомства, например к ранней гипертонии и повышению рисков появления ишемической болезни сердца и инсульта [5]. Ранняя манифестации ПЭ (до 34-й недели гестации) встречается лишь в 5–20%, но она является наиболее неблагоприятной как для матери, так и для плода, всегда протекает в тяжелой форме и сопровождается внутриутробной ЗРП. Интересно, что у женщин с ранней ПЭ с большей вероятностью наблюдается семейный анамнез ПЭ и может произойти рецидив заболевания при последующих беременностях [6].
Основным патологическим признаком ПЭ с ранним началом является патологическое развитие плаценты. Плацентация при ПЭ обычно характеризуется аномальным ремоделированием сосудов спиральных артерий, начиная с I триместра беременности, за несколько недель до очевидного клинического проявления. Локальная гипоперфузия приводит к высвобождению различных факторов, включая воспалительные цитокины и антиангиогенные белки, увеличивая соотношение между растворимой fms-подобной тирозинкиназой-1 и проангиогенным фактором роста плаценты, которые могут способствовать системному эндотелиальному ответу, клинически проявляются в виде ПЭ и ЗРП.
У женщин, у которых беременность осложнилась поздним началом ПЭ, чаще всего наблюдается минимальное или полное отсутствие аномального ремоделирования сосудов спиральных артерий и отсутствует ограничение внутриутробного роста плода.
На данный момент единственным эффективным методом лечения ПЭ является родоразрешение. Поэтому на сегодняшний день актуальным является поиск путей пролонгирования беременности и стабилизации состояния как женщины, так и плода. Так, перспективным направлением в лечении ранней тяжелой ПЭ является терапия, основанная на создании постоянного положительного давления в дыхательных путях, которая снижает медикаментозную нагрузку, улучшает прогноз для новорожденного [7]. Как правило, исход для детей, рожденных у матерей с тяжелой ПЭ, в особенности ранней, является наиболее неблагоприятным. Эти дети обычно недоношены, с экстремально низкой/низкой массой тела, нуждаются в респираторной поддержке и имеют множество осложнений.
Цель исследования: определение влияния тяжелой ПЭ на пери- и неонатальные исходы, отдаленные прогнозы для матери и потомства.
Материалы и методы
Проведено ретроспективное когортное исследование, в которое были включены 123 женщины, перенесшие во время настоящей беременности ПЭ, и их новорожденные дети, в период с 2012 по 2019 гг. наблюдавшиеся в ФГБУ НМИЦ АГиП им. академика В.И. Кулакова Минздрава России. У 83 беременных (I группа) была диагностирована тяжелая ПЭ с ЗРП, а у остальных 40 беременных (II группа) – умеренная ПЭ.
Были проанализированы анамнестические данные женщин, включенных в исследование, истории родов и истории новорожденных, состояние детей при рождении, во время нахождения в стационаре и дальнейшее состояние их здоровья при катамнестическом наблюдении в течение первого года жизни.
Критериями исключения были: хроническая артериальная гипертензия, сахарный диабет, нарушение функции почек, онкологические и воспалительные заболевания во время беременности. Все матери были анкетированы по телефону; в результате сформирована когорта из 75 женщин, дети которых наблюдаются в научно-консультативном педиатрическом отделении Центра (НКПО).
Клинические данные о беременности матери были получены из архивных записей историй родов; данные о ребенке – из архивных записей историй новорожденного. Оценку состояния новорожденного проводили по шкале Апгар на 1-й и 5-й минутах, оценку физического развития – на основании центильных таблиц для доношенных и недоношенных детей. Учитывались осложнения неонатального периода (асфиксия при рождении, геморрагические осложнения, неврологические и дыхательные нарушения). По разработанному алгоритму проводилось обследование детей в течение первого года жизни в НКПО.
Статистический анализ
Данные по исследованию были занесены в электронные таблицы (MS Excel), в дальнейшем обработаны с помощью статистических формул данной программы и пакета программ STATISTICA. Количественные показатели оценивались на предмет соответствия нормальному распределению, для этого использовался критерий Колмогорова–Смирнова. Далее проверялось равенство дисперсий в сравниваемых группах с помощью теста Левена. При выполнении обоих условий использовались параметрические методы статистического анализа. В случае описания количественных показателей полученные данные объединялись в вариационные ряды, в которых проводился расчет средних арифметических величин (M) и стандартных отклонений (SD). При сравнении средних величин в нормально распределенных совокупностях количественных данных рассчитывался t-критерий Стьюдента. Полученные значения t-критерия Стьюдента оценивались путем сравнения с критическими значениями. Различия показателей считались статистически значимыми при уровне значимости p<0,05. При распределении признаков, отличающихся от нормальных, полученные данные описывались в виде медианы (ME) и квартилей (Q1;Q3). Для сравнения независимых совокупностей в случаях отсутствия признаков нормального распределения данных использовался U-критерий Манна–Уитни.
При сравнении относительных показателей нами использовался показатель относительного риска (ОР), отражающий, во сколько раз риск исхода при наличии фактора риска выше риска исхода при отсутствии фактора риска. С целью проецирования полученных значений ОР на генеральную совокупность нами рассчитывались границы 95% доверительного интервала (95% ДИ). Исходя из полученных данных, значимость взаимосвязи исхода и фактора считалась доказанной в случае нахождения доверительного интервала за пределами границы отсутствия эффекта, принимаемой за 1.
Результаты
В результате работы были проанализированы 200 историй родов в период с 2012 по 2019 гг., с установленным на основании Международной классификации болезней 10-го пересмотра диагнозом ПЭ. После отбора пациенток в соответствии с критериями включения и исключения, в исследовании остались 123 женщины и их новорожденные дети.
Возраст всех пациенток варьировал от 24 до 45 лет, в среднем – 32,62 (5,9) года; в I группе средний возраст – 32,92 (6,04) года, во II группе – 32 (5,49) года. В I группе у 24 женщин (28,9%) в анамнезе уже был установлен диагноз ПЭ в предыдущую беременность, во II группе – у 15 женщин (37,5%). У 37 беременных (44,5%) из I группы данная беременность первая, из II группы – у 11 женщин (27,5%). В группе с тяжелой ПЭ артериальная гипертензия манифестировала на сроках 28,49 (6,41) недели беременности, протеинурия присоединялась в 31,23 (4,3) недели беременности, а в группе с умеренной ПЭ – в 31,14 (5,4) недели беременности (р=0,004) и 32,09 (7,39) недели соответственно (р=0,6) (табл. 1).
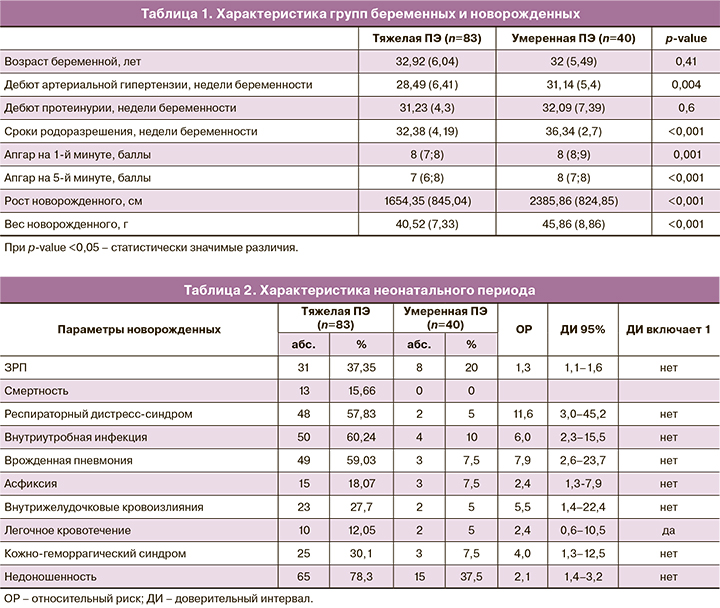
Синдром ЗРП наблюдался чаще в группе с тяжелой ПЭ – в 37,35% случаев (31 пациентка), в 20% (8 пациенток) – в группе с умеренной ПЭ (табл. 2). У 4 женщин в группе с тяжелой ПЭ развился HELLP-синдром. Все женщины в I группе были родоразрешены путем операции кесарева сечения в сроке беременности от 26 до 37 недель. Сроки родоразрешения в группе с умеренной ПЭ были значимо выше – в среднем 36,34 (2,7) недели, чем в группе с тяжелой ПЭ – 32,38 (4,19) недели. В структуре причин преждевременного родоразрешения в группе с умеренной ПЭ одной из основных явилось ухудшение состояния плода по данным функциональных методов оценки (ультразвуковое исследование, допплерометрия, кардиотокография) – в 45% случаев; в группе с тяжелой ПЭ это были: нарастание тяжести ПЭ в 39%, ухудшение состояния плода – в 38%, отсутствие эффекта от проводимой терапии – в 10% и развитие НELLP-синдрома – в 5% случаев.
Все дети родились живыми. В группе с тяжелой ПЭ 78,3% детей родились недоношенными, в группе с умеренной ПЭ – 37,5% недоношенных (ОР=2,1; ДИ 1,4–3,2). При анализе данных новорожденных антропометрические показатели были ниже в группе с тяжелой ПЭ (1654,35 (845,04) г; 40,52 (7,33) см), чем в группе с умеренной ПЭ (2385,86 (824,85) г; 45,86 (8,86) см), p<0,001. При этом в группе с тяжелой ПЭ 32,5% детей родились с экстремально низкой массой тела (<1000 г). Оценка по шкале Апгар была также выше в группе с умеренной ПЭ: на 1-й минуте – 8 (7;8) баллов, на 5 минуте – 9 (8;9) баллов, в группе с тяжелой ПЭ на 1-й минуте – 7 (6;8) баллов, p=0,001, на 5-й минуте – 8 (7;8) баллов, p<0,001. Тяжелая асфиксия при рождении отмечалась исключительно у новорожденных в группе с тяжелой ПЭ (n= 4).
В группе с умеренной ПЭ родились 77,5% здоровых детей. При анализе неонатального периода в группе с тяжелой ПЭ чаще возникали осложнения: респираторный дистресс-синдром (ОР=11,6; 95% ДИ 3,0–45,2), врожденные инфекционно-воспалительные заболевания (ОР=6,0; 95% ДИ 2,3–15,5), в том числе врожденная пневмония (ОР=7,9; ДИ 2,6–23,7), асфиксия (ОР=2,4; 95% ДИ 1,3–7,9), внутрижелудочковые кровоизлияния (ОР=5,5; 95% ДИ 1,4–22,4), кожно-геморрагический синдром (ОР=4,0; 95% ДИ 1,3–12,5) (табл. 2).
Далее был проведен проспективный анализ состояния здоровья детей первого года жизни у матерей с тяжелой и умеренной ПЭ. В группе с тяжелой ПЭ смертность составила 13,2% (11 детей). Ранняя неонатальная смертность встречалась в 54,5% (6 детей); поздняя неонатальная смертность – в 27,3% (3 детей) и в 2 случаях (18,2 %) – младенческая смертность. Причинами смерти в неонатальном периоде явились: развитие диссеминированного внутрисосудистого свертывания крови и полиорганной недостаточности, тяжелое течение инфекционного процесса, в т.ч. врожденного неонатального сепсиса (в 5 случаях) на фоне недоношенности.
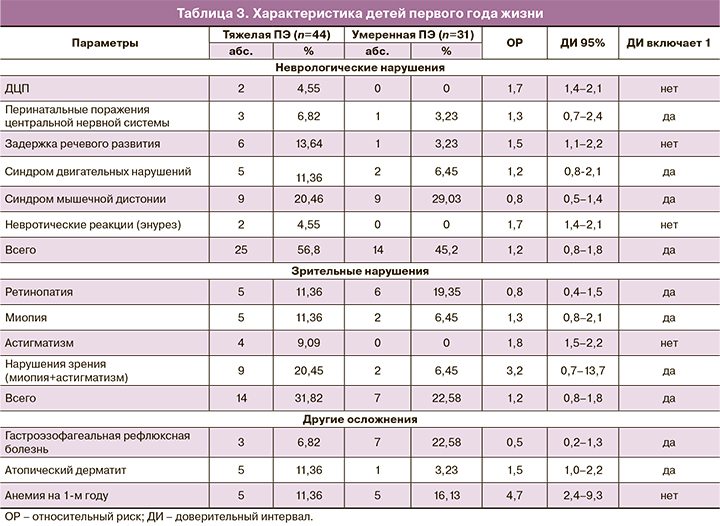
Из 123 новорожденных 75 детей наблюдаются в НКПО, остальные – по месту жительства. Среди детей, наблюдающихся в НКПО, 26 не имеют отклонений в состоянии здоровья и нарушений развития – 12 (27,3%) из группы тяжелой ПЭ и 14 (45,2%) из II группы. У остальных детей наблюдались осложнения, требующие наблюдения профильных специалистов. Так, 39 детей наблюдались у невролога, 21 ребенок – у окулиста, 10 детей – у гастроэнтеролога, 6 детей – у аллерголога. При анализе отдельных нозологий среди детей первого года жизни, наблюдающихся у невролога, встречались: детский церебральный паралич (ДЦП) в 1,7 раза чаще (95% ДИ 1,4–2,1), задержка речевого развития в 1,5 раза чаще (95% ДИ 1,1–2,2) и невротические реакции в 1,7 раза чаще (95% ДИ 1,4–2,1) в группе с тяжелой ПЭ, чем в группе с умеренной ПЭ (табл. 3). У детей, наблюдающихся с диагнозом ДЦП, отмечаются выраженные нарушения моторного и речевого развития, тяжелые спастические парезы, параличи. Несмотря на то что достоверных различий в частоте развития синдрома мышечной дистонии в исследуемых группах не выявлено, тем не менее, в группе с тяжелой ПЭ наблюдались более тяжелые формы заболевания. Нарушение зрения (миопия, миопия в сочетании с астигматизмом, предмиопия), потребовавшее коррекции на 1-м году жизни, отмечалось чаще у новорожденных в группе с тяжелой ПЭ (ОР=3,2; 95% ДИ 0,7–13,7). Ретинопатия в основном наблюдалась у недоношенных детей: в I группе – 1–2-я степень заболевания, во II группе – только 1-я степень или предретинопатия. У гастроэнтеролога наблюдались дети преимущественно из II группы в связи с развитием функциональных нарушений желудочно-кишечного тракта. Младенцы из I группы чаще наблюдались с аллергическими реакциями (табл. 3).
Дополнительно было изучено состояние здоровья женщин после перенесенной ПЭ. Уже спустя 5–7 лет после беременности, осложненной ПЭ, у этих женщин наблюдалось более высокое среднее систолическое и диастолическое давление – 127/86 мм рт. ст., чем у женщин без этого осложнения беременности – 119/79 мм рт. ст. Перенесенная ПЭ во время беременности увеличивала риск артериальной гипертензии в 3,5 раза (95% ДИ 2,5–5,2). ОР возникновения метаболического синдрома у женщин после ПЭ составил 2,18 (95% ДИ 1,3–3,5) по сравнению с женщинами без ПЭ в анамнезе.
Обсуждение
Несмотря на многочисленные исследования, направленные на поиск методов прогнозирования, профилактики и терапии такого тяжелого осложнения беременности, как ПЭ, ее частота остается неизменной (2–8%); ПЭ оказывает отрицательное воздействие на здоровье новорожденного и дальнейшее состояние здоровья женщин. При ранней манифестации заболевания (до 34-й недели гестации) заболевание протекает всегда в тяжелой форме и усугубляет состояние плода.
Из-за конфликтующих интересов матери и ребенка выбор срока родоразрешения является одной из основных проблем в клинической практике, особенно у женщин с ранней ПЭ. Женщины с ПЭ подвержены риску развития острой почечной или печеночной недостаточности, разрыву печени, отеку легких, кровоизлиянию в мозг, диссеминированному внутрисосудистому свертыванию крови и эклампсии, в то время как риск отслойки плаценты, ЗРП и внутриутробной смерти плода повышен по сравнению с женщинами без ПЭ. С другой стороны, для внутриутробного пациента продление беременности из-за последствий недоношенности является важной задачей, хотя осложнения матери и риск декомпенсирования плацентарной недостаточности может поставить под угрозу это преимущество [8]. Если ПЭ диагностируется после 37 недель беременности, индукция родов является признанной тактикой выбора для матери и новорожденного [9]. Если ПЭ или гипертензия, вызванная беременностью, возникает на сроке 34–37 недель, ожидаемый мониторинг до клинического ухудшения оправдан, так как экстренное родоразрешение значительно увеличивает риск респираторного дистресс-синдрома новорожденных, а неблагоприятные исходы для матери не были клинически подтверждены [8]. Роды показаны независимо от срока беременности, если есть признаки критической ПЭ или эклампсии.
Масса тела при рождении детей от матерей с ранним началом ПЭ в среднем на 23% ниже, чем в норме при данном сроке беременности [10]. В соответствии с этим повышается уровень смертности плода: 5,2 на 1000 случаев гибели плода против 3,6 на 1000 по сравнению с неосложненной беременностью. У женщин с ранней ПЭ риск мертворождения в 7 раз выше по сравнению с нормальной беременностью [11]. Так, в нашем исследовании смертность была только в группе с тяжелой ПЭ и составила 13,2% (11 детей), из них у 5 (45,5%) диагностирован сепсис. Ранняя неонатальная смертность встречалась в 54,5% случаев; поздняя неонатальная смертность – в 27,3% случаев и в 18,2% случаев – младенческая смертность.
Из-за аномальной плацентации внутриутробная среда может навсегда изменить структуру органов и функцию систем биологической обратной связи организма и повысить индивидуальную восприимчивость к заболеваниям в более позднем возрасте [12,13]. Недавно Pinheiro et al. (2016) сообщили в метаанализе о противоречивых результатах у потомства с сердечно-сосудистыми заболеваниями после внутриутробного воздействия ПЭ. Большинство исследований выявили у детей, рожденных от матерей с ПЭ в возрасте от 9 до 17 лет, более высокое систолическое артериальное давление, другие – более высокое диастолическое артериальное давление, а некоторые – и то и другое [12]. Kajantie et al. (2009) обнаружили повышенный риск гипертонии у взрослых, чьи матери перенесли именно тяжелую ПЭ [14].
Связь между ПЭ и астмой у детей в возрасте 3 лет после анализа сопутствующих факторов, включая семейный анамнез, не была доказана. Восемь исследований описали интеллектуальное развитие детей от матерей, перенесших ПЭ, и обнаружили негативное влияние на когнитивные функции на протяжении всей жизни по сравнению с популяционными данными [12, 15]. Так, например, Van Wassenaer et al. (2011), обнаружили, что в проспективной когорте 4–5-летних детей, рожденных у матерей с тяжелой ПЭ, средний показатель IQ был на 8 баллов ниже, чем в нормальной популяции [16]. Несоответствие в долгосрочных результатах можно объяснить большим количеством конфаундерных факторов, включая тяжесть ПЭ, массу тела при рождении, пол плода, антенатальную терапию (например, кортикостероиды) и неонатальное лечение (например, вентиляция, использование антибиотиков) и генетические аспекты.
В нашем исследовании оценивали влияние ПЭ на здоровье детей в первый год жизни. Дети, рожденные у матерей с тяжелой ПЭ, как при рождении, так и в последующем страдают более тяжелыми заболеваниями, чем при умеренной ПЭ. Так, при анализе отдельных нозологий среди детей первого года жизни, наблюдающихся у невролога, ДЦП встречался в 1,7 раза чаще, задержка речевого развития – в 1,5 раза чаще и невротические реакции – в 1,7 раза чаще в группе с тяжелой ПЭ, чем в группе с умеренной ПЭ.
Остается важным вопросом долгосрочный прогноз детей касательно сердечно-сосудистых заболеваний. В 2015 г. было опубликовано большое 20-летнее наблюдение за детьми, рожденными у женщин с ПЭ. У 30% испытуемых к 20 годам жизни отмечалось повышенное артериальное давление. У детей, родившихся недоношенными от матерей с ПЭ, в 3 раза повышается риск развития гипертензии к 20 годам [17].
Помимо прямых опасных для жизни осложнений во время беременности, стало очевидным, что после ПЭ женщины подвергаются повышенному риску развития сердечно-сосудистых заболеваний.
Так, в данном исследовании уже спустя 5–7 лет у женщин после беременности, осложненной ПЭ, наблюдалось более высокое среднее систолическое и диастолическое давление – 127/86 мм рт. ст., чем у женщин без этого осложнения беременности – 119/79 мм рт. ст. Перенесенная ПЭ во время беременности увеличивала риск артериальной гипертензии в 3,5 раза, метаболического синдрома – в 2,18 раза по сравнению с женщинами без ПЭ в анамнезе.
В датском когортном исследовании, основанном на регистрах, было обследовано 700 000 женщин со средней продолжительностью наблюдения 14,6 года [18]. После тяжелой ПЭ отмечено 6-кратное (диапазон: 5,45–6,77) увеличение артериальной гипертензии, 1,7-кратное (диапазон: 1,22–2,40) увеличение ишемической болезни сердца, 1,9-кратное (диапазон: 1,35–2,70) увеличение тромбоэмболии и 4-кратное (диапазон: 3,04–4,46) увеличение диабета 2 типа. Bellamy et al. (2007) провели систематический обзор с метаанализами, исследуя более 3 млн женщин через 10–15 лет после беременности, получили аналогичные результаты: у женщин с ПЭ в анамнезе риск гипертонии повышен в 3,7 раза, риск развития ишемической болезни сердца – в 2,2 раза, риск инсульта – в 1,8 раза и риск развития тромбоэмболии – в 1,19 раза [19]. Даже вскоре после беременности (два года после родов) 30% женщин, у которых была гестационная гипертензия или ПЭ, имели гипертонию, а 25% страдали метаболическим синдромом [20]. Тяжесть ПЭ связана с тяжестью сердечно-сосудистых заболеваний в более позднем возрасте. Среди женщин с ранней ПЭ 45% имели гипертонию в сроке от 3 месяцев до 5 лет после беременности по сравнению с 25% – с поздним началом ПЭ [21]. У женщин с ранней ПЭ риск смерти от сердечно-сосудистых заболеваний повышался в 9–10 раз, в то время как у женщин с поздней ПЭ – в 2 раза [22]. Кроме того, увеличивается риск сердечно-сосудистых заболеваний, а также время начала гипертонии в более молодом возрасте: на 7,7 года раньше у женщин с гипертензивным расстройством во время беременности, чем у женщин без осложнений беременности в анамнезе [23]. В продольной канадской когорте с 25-летним наблюдением за 1 млн женщин, рецидивирующая ПЭ была в значительной степени связана с сердечно-сосудистыми исходами по сравнению с единовременной ПЭ [24]. Таким образом, ПЭ, возникшая во время беременности, может быть рассмотрена в качестве маркера развития сердечно-сосудистых заболеваний в относительно молодом возрасте.
Заключение
Таким образом, ПЭ – распространенное специфическое для беременности заболевание, которое оказывает серьезное влияние на долгосрочный исход как для женщин, так и для их детей. Женщины с ПЭ в анамнезе более склонны к сердечно-сосудистым заболеваниям. Это подразумевает возможность разработки и оценки профилактических программ в относительно молодом возрасте, сразу после беременности, осложненной ПЭ. Заболеваемость и смертность детей, рожденных у женщин с ПЭ, зависит от тяжести и сроков дебюта заболевания, сроков родоразрешения и наличия синдрома ЗРП. Требуются дальнейшие исследования по возможности терапии и пролонгирования беременности для снижения заболеваемости и смертности детей этой группы пациенток.



