Согласно современной классификации, к инфекциям, передаваемым половым путем (ИППП), вирусной этиологии относятся аногенитальная герпетическая инфекция (А56.0) и аногенитальные (венерические) бородавки (А63.0).
Генитальный герпес является одним из наиболее распространенных эрозивно-язвенных заболеваний аногенитальной области. Серо-эпидемиологические исследования демонстрируют повсеместное распространение генитальной герпетической инфекции. Ежегодно в мире генитальным герпесом заболевают около 500 тыс. человек, в Российской Федерации показатель заболеваемости в 2013 г. составил 15,4 случая на 100 тыс. населения, при этом за последнее десятилетие не наблюдается выраженной тенденции к динамике данного показателя [1, 2].
Аногенитальные (венерические) бородавки также представляют собой вирусное заболевание, которое обусловлено вирусом папилломы человека (ВПЧ). В Российской Федерации показатель заболеваемости аногенитальными бородавками в 2013 г. составил 23,7 случая на 100 тыс. населения [1,3].
В отличие от аногенитальной герпесвирусной инфекции, генитальная папилломавирусная инфекция часто элиминируется самостоятельно, особенно при низких количественных показателях ВПЧ, и в настоящее время не существует доказательств эрадикации ВПЧ путем лекарственной терапии [4].
Механизм врожденного иммунитета не имеет специфической памяти, но активирует необходимый иммунный ответ со стороны цитотоксических клеток – эффекторов, ускоряющих и усиливающих ответ на повторное поступление антигена [5, 6].
Поскольку любые повторные эпизоды вирусных ИППП связаны с неблагоприятными изменениями иммунного статуса, при рецидивирующем течении заболеваний может быть рекомендовано применение неспецифических противовирусных препаратов и системных иммуномодулирующих лекарственных средств [2, 3].
 Интерфероны (ИФН) представляют собой мультигенное семейство индуцибeльных цитокинов, обладающих разнообразными функциями, включающими противовирусное, антипролиферативное, противоопухолевое и иммуномодулирующее действия. ИФН обычно объединяют в два типа: I тип ИФН, также известный как вирусный ИФН, включает ИФН-α (лейкоцитарный), ИФН-β (фибробластный) и ИФН-ω; II тип ИФН, известный как иммунный, представлен ИФН-γ. Вирусные ИФН индуцируются в процессе вирусной инфекции, а синтез ИФН-γ инициируется митогенными или антигенными стимулами. Большинство типов инфицированных вирусом клеток способно синтезировать ИФН-α и β в клеточной культуре. В противоположность этому, ИФН-γ синтезируется только некоторыми клетками иммунной системы, включая естественные киллерные клетки, CD4 Th1 клетки и CD8 цитотоксические супрессорные клетки. При том, что ИФН-γ обладает уникальными иммунорегулирующими свойствами, которые особенно важны во врожденном ответе хозяина на инфекционный процесс, он также играет роль в защите против вирусной инфекции, особенно в долговременном контроле ее рецидивов [7–9].
Интерфероны (ИФН) представляют собой мультигенное семейство индуцибeльных цитокинов, обладающих разнообразными функциями, включающими противовирусное, антипролиферативное, противоопухолевое и иммуномодулирующее действия. ИФН обычно объединяют в два типа: I тип ИФН, также известный как вирусный ИФН, включает ИФН-α (лейкоцитарный), ИФН-β (фибробластный) и ИФН-ω; II тип ИФН, известный как иммунный, представлен ИФН-γ. Вирусные ИФН индуцируются в процессе вирусной инфекции, а синтез ИФН-γ инициируется митогенными или антигенными стимулами. Большинство типов инфицированных вирусом клеток способно синтезировать ИФН-α и β в клеточной культуре. В противоположность этому, ИФН-γ синтезируется только некоторыми клетками иммунной системы, включая естественные киллерные клетки, CD4 Th1 клетки и CD8 цитотоксические супрессорные клетки. При том, что ИФН-γ обладает уникальными иммунорегулирующими свойствами, которые особенно важны во врожденном ответе хозяина на инфекционный процесс, он также играет роль в защите против вирусной инфекции, особенно в долговременном контроле ее рецидивов [7–9].
Накоплен достаточный опыт применения интерферонов в терапии клинических проявлений папилломавирусной инфекции. Для лечения аногенитальных бородавок интерфероны применяют местно, внутриочагово и системно.
По данным ряда авторов, наиболее эффективным является внутриочаговое применение α- и β-интерферонов. Однако в исследовании J. Larsen, K. Peters и соавт. было показано, что местное иммуностимулирующее воздействие повышает частоту регрессии манифестных форм папилломавирусной инфекции, но эффективность такой терапии остается невысокой: клинический эффект при внутриочаговом введении интерферонов составляет не более 40% и может быть достигнут только при небольших по площади высыпаниях [10].
По мнению исследователей, интерферон и его индукторы, а также другие активаторы противовирусного иммунитета демонстрируют наибольшую эффективность в комбинации с различными методами деструкции аногенитальных бородавок. Однако, согласно данным The Condylomata International Collaborative Study Group, применение α-интерферона (3 раза в неделю в течение 4 недель) после удаления патологических высыпаний СО2-лазером, не дало каких-либо положительных результатов по сравнению с плацебо: полное излечение было зарегистрировано у 18% больных, рецидивы заболевания – у 35% больных [11–14].
Таким образом, приведенные данные позволяют предполагать эффективность применения ИНФ-γ в терапии рецидивирующих вирусных ИППП.
Ингарон (ИНФ-γ) представляет собой рекомбинантный интерферон-γ человека, полученный микробиологическим синтезом в рекомбинантном штамме Escherichia coli и очищенный колоночной хроматографией. Ингарон активирует такие эффекторные функции клеток, как микробоцидность, продукцию цитокинов, супероксидных и нитрооксидных радикалов, а также ингибирует В-клеточный ответ, интерлейкин-4, подавляя продукцию IgE и экспрессию CD23-антигена. Препарат блокирует репликацию вирусных ДНК и РНК, синтез вирусных белков и сборку зрелых вирусных частиц, оказывает цитотоксическое воздействие на вирус-инфицированные клетки.
Целью настоящего исследования стало изучение эффективности и безопасности применения препарата ингарон (ИНФ-γ) в терапии вирусных ИППП (аногенитальной герпетической инфекции и аногенитальных (венерических) бородавок).
Материал и методы исследования
В исследование были включены 45 пациентов обоего пола в возрасте от 20 до 48 лет, из них 15 пациентов с диагнозом «Аногенитальная герпетическая инфекция» (1-я группа) и 30 пациентов с диагнозом «Аногенитальные (венерические) бородавки» (2-я группа). У всех пациентов в течение последнего года регистрировалось не менее 4 рецидивов заболевания. Диагнозы были подтверждены результатами исследования методом полимеразной цепной реакции (идентификацией генетического материала инфекционных этиологических агентов). У всех пациентов, включенных в исследование, были исключены сопутствующие ИППП.
Пациенты обеих групп были рандомизированы на подгруппы в зависимости от проводимой терапии: пациентам 1А подгруппы (n=7) проводилась терапия препаратом ингарон, подкожно 500 000 МЕ 1 раз в сутки через день, на курс 5 инъекций; пациентам 1В подгруппы (n=8) проводилась терапия препаратом ацикловир 200 мг 5 раз в сутки в течение 5 дней; пациенты 2А подгруппы (n=15) получали терапию препаратом ингарон, подкожно 100 000 МЕ 1 раз в сутки через день, на курс 5 инъекций в комбинации с криодеструкцией аногенитальных бородавок; пациентам 2В подгруппы (n=15) проводилась криодеструкция аногенитальных бородавок.
Наблюдение за пациентами с целью оценки эффективности и безопасности терапии продолжалось в течение 100 (для пациентов 2-й группы) и 200 дней (для пациентов 1-й группы).
Результаты исследования
Эффективность применения препарата ингарон в терапии аногенитальной герпетической инфекции
На момент обращения за медицинской помощью длительность заболевания у пациентов 1-й группы составляла не менее трех лет. В течение последнего года у всех пациентов регистрировалось 4 и более рецидивов генитального герпеса. На момент включения пациентов в исследование все больные имели клинические проявления аногенитальной герпетической инфекции, при этом обе группы были сопоставимыми по степени их выраженности (таблица).
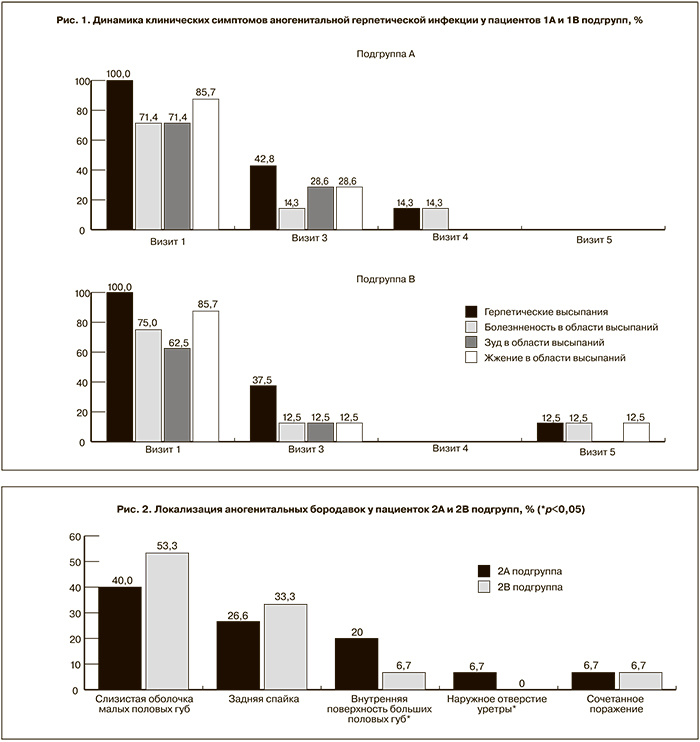
Оценка субъективных и объективных клинических проявлений аногенитальной герпетической инфекции проводилась: на скрининговом визите (визит 1), в начале активной терапии (визит 2), по окончании активной терапии (визит 3), через 40 дней (визит 4) и через 200 дней (визит 5) после завершения терапии.
Согласно полученным данным, на визите 3 (11-й день исследования) в 1А подгруппе клинические проявления заболевания в виде герпетических высыпаний сохранялись у 3 (42,8%) пациентов, болезненность в области высыпаний – у 1 (14,3%), зуд и жжение в области высыпаний – у 2 (28,6%) пациентов; в 1В подгруппе – у 3 (37,5%), 1 (12,5%) и 1 (12,5%) пациентов соответственно (p>0,05). К 4-му визиту рецидив аногенитальной герпетической инфекции был зарегистрирован только у 1 (14,3%) больного 1А подгруппы, за остальное время наблюдения рецидивы заболевания не были выявлены ни у одного из пациентов данной подгруппы. К 5-му визиту рецидив аногенитальной герпетической инфекции был установлен у 1 (12,5%) больного 1В подгруппы, за остальное время наблюдения рецидивы заболевания не были выявлены ни у одного из пациентов данной подгруппы (рис. 1).
Эффективность применения препарата ингарон в терапии аногенитальных (венерических) бородавок
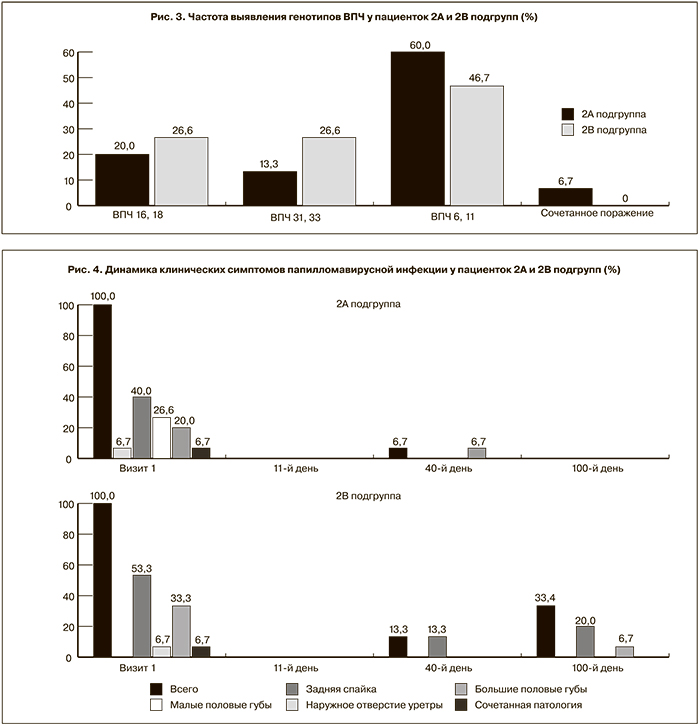
Согласно результатам физикального осмотра аногенитальные бородавки локализовались в области вульвы (на слизистой оболочке малых половых губ) у 6 (40%) пациенток 2А подгруппы и 8 (53,3%) пациенток 2В подгруппы, в области задней спайки – у 4 (26,6%) и 5 (33,3%) пациенток, на внутренней поверхности больших половых губ – у 3 (20%) и 1 (6,7%) пациенток соответственно, в области наружного отверстия уретры – у 1 (6,7%) пациентки 2А подгруппы. Сочетанное поражение слизистой оболочки малых половых губ и задней спайки наблюдалось у 1 (6,7%) пациентки 2А подгруппы, слизистой оболочки малых половых губ и наружной поверхности больших половых губ – у 1 (6,7%) пациентки 2В подгруппы (рис. 2).
У всех пациенток, включенных в исследование, диагноз «Аногенитальные (венерические) бородавки» был подтвержден идентификацией ВПЧ: генотипы ВПЧ 16, 18 были обнаружены у 3 (20%) пациенток 2А подгруппы и у 4 (26,6%) пациенток 2В подгруппы, генотипы 31, 33 – у 2 (13,3%) и у 4 (26,6%) пациенток, генотипы 6 и 11 – у 9 (60%) и у 7 (46,7%) пациенток соответственно. У 1 (6,7%) пациентки группы А был идентифицирован ВПЧ 16,18 в ассоциации с ВПЧ 31,33 (рис. 3).
После проведенного курса терапии эффективность лечения оценивалась на 11-й, 40-й и 100-й день исследования (рис. 4). Согласно полученным данным, рецидив аногенитальных бородавок был зарегистрирован у 1 (6,7%) пациентки 2А подгруппы на визите 4. Рецидивов заболевания на визитах 3 и 5 у пациенток 2А подгруппы выявлено не было. Во 2В подгруппе на визите 3 не было выявлено ни одного рецидива заболевания, однако на визитах 4 и 5 были зарегистрированы рецидивы аногенитальных бородавок у 2 (13,3%) и 5 (33,4%) пациенток соответственно, при этом высыпания в большинстве наблюдений локализовались на слизистой оболочке малых половых губ. У 1 (6,7%) пациентки были выявлены папилломатозные высыпания на слизистой оболочке боковых стенок влагалища, при этом до проводимой терапии аногенитальные бородавки локализовались только на слизистой оболочке вульвы. Рецидивы заболевания у 4 пациенток были обусловлены реактивацией ВПЧ 16-го, 18-го генотипов, у 4 пациенток – ВПЧ 6-го и 11-го генотипов.
При оценке показателей общего анализа крови и биохимических показателей клинически значимых изменений после проведенного лечения не было выявлено ни у одного из пациентов, включенных в исследование.
При проведении терапии препаратом ингарон у 2 пациенток (1 пациентка 1-й группы и 1 пациентка 2-й группы) через 12 часов после первой инъекции были зарегистрированы гриппоподобные симптомы (слабость, незначительный озноб), которые разрешились самостоятельно через 24 часа.
Заключение
Согласно результатам проведенного исследования было установлено, что в терапии аногенитальной герпетической инфекции препарат ингарон продемонстрировал клиническую эффективность, сопоставимую с таковой при использовании стандартной терапии заболевания: отсутствие субъективных жалоб и объективных клинических проявлений за время наблюдения было установлено у равного количества пациентов, получавших терапию ИНФ-γ и ацикловиром (85,7 и 87,5% соответственно).
В комплексной терапии другой ИППП вирусной этиологии – аногенитальных (венерических) бородавок была установлена достоверно более высокая эффективность комбинированной терапии в сравнении с изолированной деструкцией высыпаний: рецидивы заболевания регистрировались у 6,7% больных после комбинированной терапии, у пациентов группы сравнения этот показатель составил 46,7%. Корреляционной зависимости частоты рецидивов заболевания от типа ВПЧ выявлено не было.
Серьезных нежелательных побочных явлений, а также клинически значимых изменений в анализах крови не зарегистрировано, что свидетельствует о хорошей переносимости и безопасности терапии препаратом ингарон.
Таким образом, препарат ингарон обладает высоким профилем клинической эффективности и безопасности и может быть рекомендован для терапии вирусных ИППП, особенно у больных с рецидивирующим течением заболеваний.



