Ежегодно во всем мире регистрируется 239 000 новых случаев рака яичников (РЯ), 152 000 случаев заканчиваются летальным исходом [1]. РЯ занимает третье место в структуре злокачественных опухолей женского населения и является пятой по частоте причиной женской смертности [2, 3]. Распространенность процесса остается наиболее важным прогностическим фактором заболевания. Пятилетняя выживаемость для всех видов РЯ составляет 46% и значительно варьирует в зависимости от стадии заболевания.
На ранних стадиях заболевание, как правило, бессимптомно либо проявляется в виде неспецифической симптоматики, поэтому более чем в 60% случаев диагностируются запущенные стадии процесса [4]. Нередко у таких пациентов наблюдается перитонеальный карциноматоз, одной из причин которого является отсев опухоли внутри брюшной полости с током перитонеальной жидкости [5].
Одним из наиболее важных факторов риска является наличие РЯ у родственников первой линии [6]. К другим факторам риска относятся носительство мутации генов BRCA1, BRCA2, наличие наследственного неполипозного колоректального рака (синдром Линча). Менее значимыми факторами риска являются бесплодие, отсутствие родов в анамнезе, поздняя менопауза и раннее менархе [6].
В развитых странах более 90% злокачественных опухолей яичника имеют эпителиальное происхождение, 5–6% представляют собой опухоли стромы полового тяжа и только 2–3% являются производными половых клеток [7]. Стадия заболевания на момент постановки диагноза и 5-летняя выживаемость значительно зависят от гистологического подтипа опухоли [8].
Основные методы стадирования распространенного рака яичников
Стадирование РЯ основано на классификации FIGO, обновленной в 2017 г., которая базируется на гистопатологических данных оперативного вмешательства [9]. При определении тактики лечения и оценке прогноза заболевания данная классификация наиболее широко используется. Хирургическое стадирование является основным при РЯ; тем не менее, для определения тактики ведения пациентов и выявления нерезектабельных опухолей используют методы визуальной диагностики. Целью хирургического лечения является удаление всех видимых очагов опухолевого роста, то есть достижение полной циторедукции. Среди пациенток, которым проведена полная циторедукция, прогноз заболевания лучше, чем в случаях проведения оптимальной (<1 см) и субоптимальной (>1 см) циторедукции [10]. В случаях, когда процесс нерезектабелен, в качестве первичного лечения используется неоадъювантная химиотерапия, после которой проводится интервальное оперативное вмешательство. При выполнении системного лечения методы визуальной диагностики используют для проведения прямой биопсии для определения гистологического типа опухоли и выбора таргетных зон контроля полихимиотерапии [11].
Мультиспиральная компьютерная томография (МСКТ) в настоящий момент является стандартом предоперационного стадирования РЯ [12, 13]. МСКТ выполняется с пероральным и внутривенным введением контрастного вещества; сканирование проводят преимущественно в венозную фазу контрастирования. Пероральное контрастирование позволяет лучше визуализировать импланты по стенке кишечника и кальцинированные депозиты [14]. Однако малые депозиты по брюшине менее 1 см, особенно при отсутствии асцита, только по данным МСКТ обнаружить затруднительно. Чувствительность и специфичность выявления метастазов более 1 см составляют 85–93% и 91–96% соответственно, для депозитов менее 1 см – чувствительность составляет только 25–50% [6]. К другим недостаткам МСКТ можно отнести наличие лучевой нагрузки, потенциальные риски, связанные с введением контрастного вещества, а также менее выраженный, по сравнению с магнитно-резонансной томографией (МРТ), естественный контраст мягких тканей. По этим причинам МРТ чаще используется для оценки местного распространения первичной опухоли, для определения инвазии смежных структур. МР-сканирование позволяет оценить наличие отдаленных метастазов, особенно в случаях, когда наличие депозитов по брюшине или в печени, по данным МСКТ, неоднозначно. Внутривенное динамическое контрастирование позволяет визуализировать минимальные по размерам гиперваскулярные опухоли. Отображение химического сдвига или последовательности с избирательным подавлением сигнала от жировой ткани позволяет достаточно четко визуализировать наличие депозитов в структуре жировой клетчатки. Постконтрастные Т1-взвешенные изображения (Т1-ВИ) с функцией жироподавления значительно облегчают идентификацию мелких депозитов по брюшине. Диффузионно-взвешенные изображения (ДВИ) чувствительны к движению молекул воды на клеточном уровне [15]. Злокачественные опухоли чаще демонстрируют высокий сигнал при высоких значения b-фактора (1000) и низкий сигнал на ИКД-картах (измеряемый коэффициент диффузии), что является отображением истинного ограничения диффузии. Тем не менее некоторые доброкачественные образования яичников, в том числе неопухолевой природы, также могут ограничивать диффузию; рентгенологи должны быть знакомы с этими изменениями [16]. Мультипараметрическая МРТ (мп-МРТ), включающая динамическое контрастирование и ДВИ, позволяет улучшить первичную оценку опухоли, степень ее локального и отдаленного распространения, в том числе, в виде малых депозитов по брюшине, капсуле печени или стенке кишечника. Кроме того, мп-МРТ позволяет оценить наличие ответа на химиотерапию, выявить рецидив заболевания [17]. ДВИ имеют особенное значение в случаях известной непереносимости контрастных препаратов либо на фоне почечной дисфункции. Тем не менее МРТ имеет определенные недостатки, связанные, прежде всего, с наличием артефактов от тока жидкости при выраженном асците, чувствительностью к движениям пациента и перистальтике кишечника, относительно длительным временем сканирования, а также известными абсолютными противопоказаниями к исследованию (наличие металлоконструкций, искусственных водителей сердца и т.д.). Вышеописанные особенности, а также технические сложности, связанные с обучением и необходимостью достаточного опыта в выборе оптимального протокола исследования, правильной интерпретации полученных изображений ограничивают широкое использование МРТ в стадировании РЯ.
Первичное проведение позитронно-эмиссионной томографии (ПЭТ-КТ) для оценки распространенности процесса нецелесообразно. Поглощение фтордезоксиглюкозы значительно варьирует в зависимости от гистологического типа первичной опухоли. Тем не менее проведение ПЭТ-КТ зачастую используется для подтверждения IV стадии заболевания, при подозрении на наличие метастазов в грудную клетку или органы средостения, а также когда МРТ не может быть выполнена по объективным показаниям на фоне сомнительных результатов МСКТ.
Диагностическая лапароскопия является одним из наиболее эффективных инструментов стадирования распространенного РЯ и определения пациентов группы риска по остаточной ткани опухоли после оперативного вмешательства [18, 19]. Тем не менее это инвазивная процедура, которая сопряжена с потенциальными рисками интра- и постоперационных осложнений [20, 21].
В 2000 г. было продемонстрировано, что мп-МРТ с динамическим контрастным усилением и ДВИ позволяет более точно оценить поражение брюшины [22]. МРТ превосходит КТ в оценке индекса перитонеального канцероматоза (peritoneal cancer index, PCI) с чувствительностью 95%, специфичностью 70% и точностью 88%, соответствующие показатели для МСКТ составляют 55, 86 и 63% [23]. Согласованность заключений при вычислении PCI по данным оперативного вмешательства и МСКТ составляет 0,590–0,660, аналогичные показатели для мп-МРТ составляют 0,797–0,798. Таким образом, мп-МРТ позволяет более точно предсказать возможность оптимальной циторедукции [24]. ДВИ с высоким значением b-фактора (800–1000 s/mm2) повышает специфичность визуализации перитонеального карциноматоза. Espada и соавт. [25] в проспективном исследовании продемонстрировали, что чувствительность и специфичность ДВИ в стадировании распространенного РЯ составляет 69,2–100% и 81–96,6% соответственно. МСКТ демонстрирует высокую специфичность (95,5%), но достаточно низкую чувствительность (55,9%) в обнаружении депозитов по брюшине. Похожие цифры наблюдаются для иных локализаций: поражение толстой кишки (91 и 29%), корня брыжейки (90 и 36%), диафрагмы (100 и 48%) [26]. В исследовании Nasser и соавт. были получены схожие данные – МСКТ обладает высокой специфичностью обнаружения депозитов любых локализаций (98–99%), но низкой чувствительностью и специфичностью (67 и 78%) выявления метастазов в ретроперитонеальные лимфоузлы [27].
Основные характеристики метастазирования
При оценке изображений характерным для вторичных поражений является наличие мягкотканных включений по ходу листков брюшины, большого сальника или брыжейки тонкой кишки с накоплением контрастного препарата в раннюю артериальную, промежуточную или остроченную фазы, в зависимости от метаболической активности опухоли и с ограничением диффузии на ДВИ. При контрастировании метастатические депозиты, как правило, имеют более интенсивный сигнал относительно неизмененных тканей. На Т2-ВИ изо- и гипоинтенсивные участки более характерны для мягкотканного компонента и кальцинатов, гиперинтенсивные участки – для кистовидных включений в структуре опухоли. Гиперинтенсивные участки на Т1-ВИ с функцией жироподавления более соответствуют кровоизлияниям и участкам некроза.
Утолщение брюшины, наличие узлов в ее структуре, мягкотканные включения на уровне большого сальника, асцит – основные признаки вторичного поражения брюшины (рис. 1). Существует три типа имплантов: солидные, кистовидные и смешанные, а также различные паттерны метастазирования: нодулярный тип при наличии узловых мягкотканных включений по ходу брюшины округлой или овальной формы со спикулообразными краями или сливное поражение с диффузным неравномерным утолщением листков. Изменение толщины перитонеальных листков может наблюдаться после хирургических вмешательств или внутрибрюшной химиотерапии. Как правило, фокусы перитонеального канцероматоза более доступны оценке в перпендикулярных к изучаемому участку срезах.
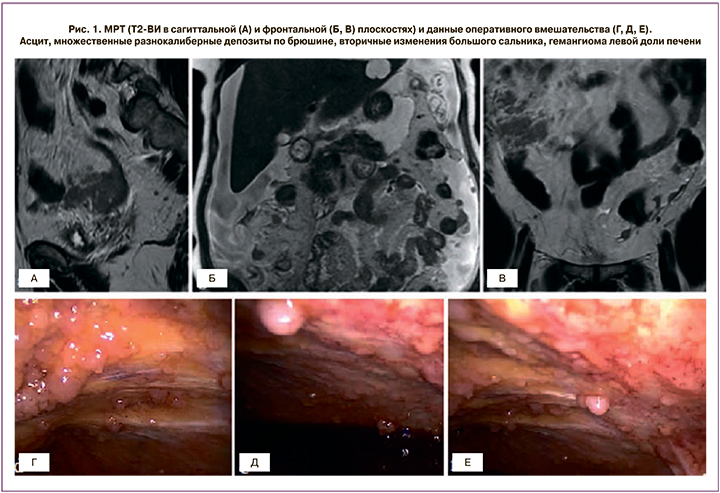
Мезентериальное поражение чаще наблюдается на уровне терминальных отделов подвздошной кишки и проявляется либо в виде сливных опухолевых масс, либо в виде отдельных депозитов различного размера. Оптимальная визуализация достигается путем исследования в трех взаимно перпендикулярных плоскостях.
Локализация и размеры метастазов в печень должны быть четко задокументированы (рис. 2). Удаление интрапаренхиматозных метастазов, депозитов на уровне гепаторенального пространства (кармана Моррисона), нижней полой вены, правой печеночной вены может вызвать массивное кровотечение. Наличие вторичных изменений серповидной связки печени, ямки желчного пузыря, перипортального пространства более 2 см является предиктором неоптимальной циторедукции [28]. Удаление субкапсулярных депозитов печени, как правило, не вызывает сложностей.
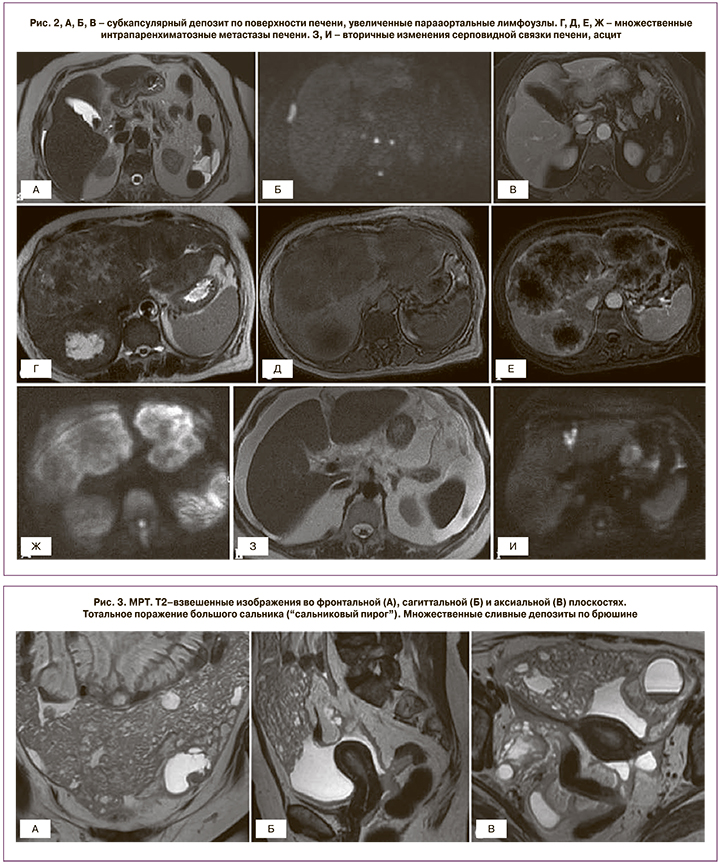
Вовлечение правого поддиафрагмального пространства на фоне тока перитонеальной жидкости из правого бокового кармана наблюдается достаточно часто. Метастатические депозиты на уровне этой области лучше всего визуализируются на корональных и сагиттальных изображениях в виде узловых включений или неравномерного утолщения диафрагмы.
Поражение кишечника проявляется в виде локального или протяженного утолщения стенки кишки, ее деформации с наличием опухолевых масс различных размеров. Отсутствие пониженного МР-сигнала от стенки кишечника на Т2-ВИ, как правило, является признаком инвазии опухоли. Расширенная резекция кишечника из-за выраженных функциональных нарушений не рекомендуется.
Признаки поражения большого сальника варьируют от тяжистой исчерченности жировой клетчатки до многоузловых или сливных депозитов с формированием «сальникового пирога» (рис. 3).
Мягкотканные включения на уровне малого сальника, лимфаденопатия желудочно-печеночной и печеночно-двенадцатиперстной связки должны быть четко задокументированы, так как вовлечение данной области, как правило, cущественно снижает шансы проведения полной циторедукции.
Наличие метастазов на уровне сальниковой сумки также обусловливает технические сложности и проявляется в виде узловых включений различного размера, исчерченности жировой клетчатки либо наличия жидкости в сумке.
Методики оценки резектабельности
Для определения степени распространения РЯ было предложено несколько методов. Целью любого из них является, с одной стороны, оценка резектабельности процесса, с другой – оценка объема оперативного вмешательства, требуемого для достижения оптимальной циторедукции [29]. На сегодняшний день доступно несколько методов – мини-лапаротомия, лапароскопия и неинвазивная предоперационная диагностика.
 Одним их первых появился PCI, который изначально был разработан Sugarbaker и соавт. в 1995 г. для оценки степени распространения рака толстой кишки [30]. Несколькими годами позднее Tentes и соавт. использовали эту методику для оценки РЯ [31]. PCI позволяет количественно оценить распространение опухоли по 13 областям брюшной полости и малого таза с учетом размеров метастатического поражения: 4 линии определяют 9 областей, которые пронумерованы по часовой стрелке со значением «0» в пупочной области, «1» – в правой поддиафрагмальной области. Области под номерами 9–12 делят тонкий кишечник на верхние и нижние отделы тощей и подвздошной кишки (рис. 4). PCI также учитывает размеры опухолевого поражения (lesion size, LS): LS-1 соответствует имплантам менее 0,5 см в диаметре, LS-2 – 0,5-5 см, LS-3 – более 5 см. Учитывается наибольший диаметр опухолевого узла. При наличии сливного опухолевого поражения выставляют 3 балла. Пятилетняя выживаемость среди пациентов с суммой баллов менее 10 составляет 80±12 месяцев, с суммой баллов более 10 – 38±7 месяцев [31].
Одним их первых появился PCI, который изначально был разработан Sugarbaker и соавт. в 1995 г. для оценки степени распространения рака толстой кишки [30]. Несколькими годами позднее Tentes и соавт. использовали эту методику для оценки РЯ [31]. PCI позволяет количественно оценить распространение опухоли по 13 областям брюшной полости и малого таза с учетом размеров метастатического поражения: 4 линии определяют 9 областей, которые пронумерованы по часовой стрелке со значением «0» в пупочной области, «1» – в правой поддиафрагмальной области. Области под номерами 9–12 делят тонкий кишечник на верхние и нижние отделы тощей и подвздошной кишки (рис. 4). PCI также учитывает размеры опухолевого поражения (lesion size, LS): LS-1 соответствует имплантам менее 0,5 см в диаметре, LS-2 – 0,5-5 см, LS-3 – более 5 см. Учитывается наибольший диаметр опухолевого узла. При наличии сливного опухолевого поражения выставляют 3 балла. Пятилетняя выживаемость среди пациентов с суммой баллов менее 10 составляет 80±12 месяцев, с суммой баллов более 10 – 38±7 месяцев [31].
Шкала, разработанная M. Eisenkop в 2003 г., была создана для оценки прогрессирующего РЯ на уровне 5 анатомических областей, которые включают центральный, правый и левый верхние квадранты брюшной полости, область таза и забрюшинное пространство [32]. Опухолевый процесс на уровне каждой области ранжируется в соответствии с результатами, соответствующими наивысшему рангу (0–3). Количество баллов от 0 до 15 отражает степень распространения процесса. При сумме баллов от 0 до 5 полная циторедукция была достигнута авторами в 98,9% случаев, от 6 до 10 баллов – в 93,8% случаев, более 11 – в 87% случаев [32].
Шкала G.D. Aletti отражает не степень распространения РЯ, а объем оперативного вмешательства [33]. Авторы разработали балльную систему оценки «сложности» операции: баллы присваиваются эмпирически от 1 до 3 в зависимости от типа вмешательства. Далее была разработана порядковая шкала, разделяющая пациентов на 3 группы: простая (3), промежуточная (4–7) и сложная операция (8).
Шкала А. Fagotti, разработанная в 2006 г., учитывает вовлечение большого сальника, перитонеальный и диафрагмальный карциноматоз, мезентериальную ретракцию, инфильтрацию кишечника и желудка, наличие метастазов в печень [34]. При наличии вышеописанных изменений по каждому пункту присваивается 2 балла. При сумме баллов более 8 все пациенты подвергались субоптимальной циторедукции со специфичностью 100%. Позже L. Brun и соавт. [35] несколько упростили эту шкалу (учитывают 4 из 7 показателей). При этом по точности она не уступает оригинальной: ни у одного из пациентов с суммой баллов более 4 не была достигнута оптимальная циторедукция.
Существуют определенные недостатки, связанные с надежностью балльных шкал, которые напрямую зависят от квалификации хирурга и сложности оперативного вмешательства. Кроме того, лапароскопия является инвазивным вмешательством, которое потенциально задерживает химиотерапию и требует большого опыта хирурга [36–38].
Во избежание возможных негативных последствий хирургического вмешательства вместо лапароскопии для оценки резектабельности было предложено использовать МСКТ с внутривенным контрастированием. Одно из первых исследований было проведено Dowdy S. и соавт. в 2004 г. [39]. В этом исследовании учитывались уровень СА-125, наличие асцита, вовлечение легких, а также 15 областей наиболее частого метастазирования на уровне брюшной полости, малого таза и забрюшинного пространства. Было установлено, что наличие выраженного асцита и диффузного перитонеального канцероматоза значительно коррелирует с низкой частотой выполнения оптимальной циторедукции (32%).
В другом исследовании, проведенном T. Janco в 2015 г. [40] с целью предикции полной и субоптимальной циторедукции, использовались следующие показатели: напряженный асцит, диффузный перитонеальный канцероматоз, обширная инфильтрация сальника, лимфаденопатия, вовлечение селезенки или печени, возраст пациента, индекс массы тела, общее состояние по шкале ECOG (Eastern Cooperative Oncology Group performance status), физический статус пациентов по классификации Американского общества анестезиологов ASA (American Society of Anesthesiologists Classification), уровень альбумина, СА-125 и тромбоцитоз. Авторами было создано две модели для оценки вероятности полной и субоптимальной циторедукции. Возраст, отсутствие асцита, обширного поражения большого сальника, диффузного перитонеального канцероматоза явились независимыми предикторами полной циторедукции (c-index=0,748). Предикторами субоптимальной циторедукции были: общее состояние по шкале ECOG ≥2, диффузный перитонеальный канцероматоз, лимфаденопатия и напряженный асцит, а также вовлечение в патологический процесс печени или диафрагмы (c-index=0,685).
Suidan R. и соавт. разработали две модели, одна из которых позволяет прогнозировать субоптимальную циторедукцию, другая – любую остаточную ткань опухоли [41, 42]. Авторы продемонстрировали высокие показатели чувствительности и специфичности, используя комбинацию клинических и рентгенологических показателей. Изначально было выявлено 3 клинических и 6 лучевых показателей по данным МСКТ, которые значительно коррелируют с выполнением субоптимальной циторедукции: возраст ≥60 лет, уровень CA-125 ≥500 ед/мл, ASA 3–4, поражение супраренальных лимфоузлов, поражение тонкой кишки и ее брыжейки, вовлечение верхней брыжеечной артерии, периспленальной области, сальниковой сумки [41]. Кроме того, авторами был разработан «показатель прогностической ценности», где каждому из критериев присваивается определенное количество баллов. Пациенты с суммой баллов 0 имели частоту субоптимальной циторедукции 5%. Для суммы баллов 1–2, 3–4, 5–6 и 7–8 частота субоптимальной циторедукции составила 10, 17, 34 и 52% соответственно. Наиболее высокие показатели субоптимальной циторедукции (74%) наблюдались среди пациентов с суммой баллов 9 и более.
Позднее Suidan R. и соавт. [42] выявили 3 клинических и 8 радиологических показателей, которые значительно коррелировали с наличием остаточной ткани опухоли: возраст >60 лет, уровень CA-125 ≥600 ед/мл, ASA 3–4, депозиты на уровне корня верхней брыжеечной артерии, ворот селезенки, сальниковой сумки, ворот печени, ямки желчного пузыря, поражение супраренальных лимфоузлов, тонкой кишки, асцит. Также был разработан «показатель прогностической ценности». Для суммы баллов 0–2 при первичной циторедукции остаточная ткань опухоли наблюдалась в 45% случаев. Для суммы баллов 3–5 и 6–8 остаточная ткань опухоли наблюдалась в 68 и 87% случаев. Среди пациентов с суммой баллов 9 и более соответствующий показатель составил 96%. Позже было продемонстрировано, что модель, направленная на выявление случаев с неоптимальной циторедукцией (остаточная опухоль >1 см), имеет низкую прогностическую точность и не может применяться в клинической практике. Модель, разработанная для идентификации случаев с наличием любой остаточной ткани опухоли, после выполнения первичной циторедукции валидирована [29].
Заключение
Надежные методики, позволяющие с высокой точностью установить стадию заболевания, являются одним из наиболее важных компонентов обследования женщин с РЯ. Планирование оперативного вмешательства, необходимость проведения системной терапии зависят от результатов визуальной диагностики и данных диагностической лапароскопии. Рентгенологи должны быть знакомы с особенностями проведения исследований, интерпретации полученных данных и выбором оптимального метода обследования. Несмотря на то что МСКТ является стандартом обследования женщин с распространенным РЯ, функциональные методы, применяемые в МРТ, развиваются и потенциально могут иметь решающее значение в стадировании и оценке резектабельности РЯ при решении вопроса о проведении оптимальной циторедукции в ближайшем будущем. При этом ни один из предложенных методов прогнозирования не является общепринятым; единого мнения о наиболее оптимальной методике не существует.



