Гемангиома относится к группе доброкачественных нетрофобластических опухолей плаценты [1]. Поскольку источником развития данной опухоли считаются сосуды ворсин хориона, то для ее обозначения используются также термины ангиома, хорангиома (сhorangiomas), хориоангиома (сhorioangioma) и иногда фиброангиомиксома [2–4].
Средняя частота выявления гемангиомы в плаценте у беременных составляет 0,61–1% [5, 6]. Более редкой формой считается так называемая гигантская хорангиома, диаметром более 4 см, которая встречается в 0,11–0,29% исследованных плацент (1 на 3500–9000) [5, 6]. Такие гигантские гемангиомы выявляются, как правило, при ультразвуковом исследовании (УЗИ) беременной. Однако окончательная верификация поражения возможна лишь при морфологическом изучении плаценты [7, 8].
Приводим собственное наблюдение.
Беременная Г., 29 лет, поступила на сроке 34 недели 2 дня для обследования и определения тактики последующего ведения беременности.
Из анамнеза известно, что в 2013 г. пациентка перенесла lues. Первая беременность в 2013 г., роды индуцированные в 41 неделю, без осложнений; родился живой доношенный мальчик массой 3670 г, рост 54 см, в удовлетворительном состоянии.
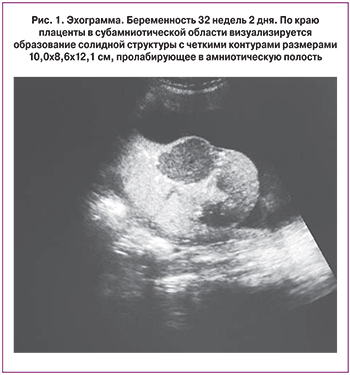
Данная беременность – вторая, наступила самопроизвольно. I триместр протекал без осложнений, пренатальный скрининг – норма. II триместр – без осложнений, пренатальный скрининг – норма. В III триместре на сроке беременности 32 недели при УЗИ размеры плода соответствуют сроку беременности 32 недели, анатомическое строение в норме, пуповина без особенностей, содержит три сосуда. Плацента толщиной 3,4 см, расположена по задней и правой боковой стенке. По краю плаценты в субамниотической области визуализируется образование солидной структуры с четкими контурами размерами 10,0×8,6×12,1 см, пролабирующее в амниотическую полость (рис. 1). При цветовом допплеровском картировании кровоток в пределах образования имел мозаичный характер. Питающий образование артериальный сосуд имел низкое сосудистое сопротивление (пульсационный индекс 0,4).
В 34 недели выявлено выраженное многоводие, минимальный карман вод 9,8 см. В связи с многоводием получала антибактериальную терапию препаратом цефалоспоринового ряда на догоспитальном этапе.
При кардиотокографическом исследовании выявлены признаки нарушения состояния плода, которые проявлялись сниженной вариабельностью сердечного ритма.
 В 35 недель осмотрена консультативно на перинатальном консилиуме и, учитывая нарушение состояния плода, нарастающее многоводие при наличии гемангиомы больших размеров и высокий риск перинатальных осложнений, дальнейшее пролонгирование беременности признано нецелесообразным.
В 35 недель осмотрена консультативно на перинатальном консилиуме и, учитывая нарушение состояния плода, нарастающее многоводие при наличии гемангиомы больших размеров и высокий риск перинатальных осложнений, дальнейшее пролонгирование беременности признано нецелесообразным.
После подготовки шейки матки осмотическими дилататорами и гелем с динопростоном произведена амниотомия и постепенно выведено около 7 литров светлых вод. После амниотомии головка плода прижалась ко входу в таз и развилась родовая деятельность. В родах осуществляли тщательное наблюдение за состоянием плода с помощью кардиотокографии, показатели которой квалифицированы как II тип (сомнительная). Роды прошли без осложнений за 6 часов. Родился живой недоношенный мальчик массой 2693 г и длиной тела 48 см. Оценка по Апгар на 1-й минуте 8 баллов, через 5 минут – 8 баллов. В связи с развитием дыхательных нарушений ребенок получал респираторную терапию в отделении реанимации, а после стабилизации состояния переведен в отделение патологии новорожденных, где прошел лечение по поводу врожденной пневмонии, анемии, неонатального холестаза. Выписан в удовлетворительном состоянии на 22-е сутки.
Плацента во время родов отделилась самостоятельно, плодные оболочки целы. Под амниотическими оболочками по краю плаценты обнаружено образование размерами 11,5х8,0х5,5 см, консистенция более плотная, чем неизмененная ткань плаценты. Послед направлен на гистологическое исследование.
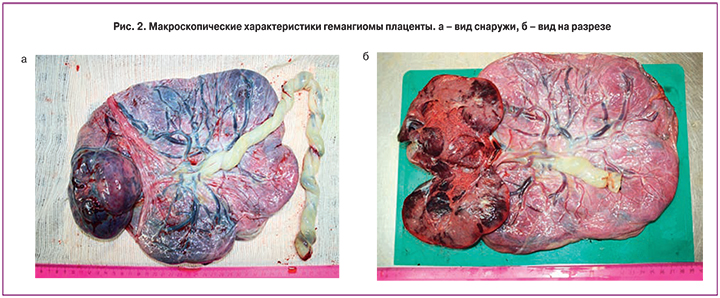
При морфологическом исследовании плодные оболочки блестящие серовато-розоватого цвета без наложений. Пуповина длиной 42 см и толщиной 1,8 см, с наличием 8 витков влево (индекс извитости пуповины 0,19), прикрепление эксцентричное, на разрезе определяется три сосуда. Плацентарный диск размерами 24×23×1,5 см, в краевой его части определяется опухолевидное образование округлой формы, размерами 11,5×8,0×5,5 см, выступающее над плодной поверхностью (рис. 2а).
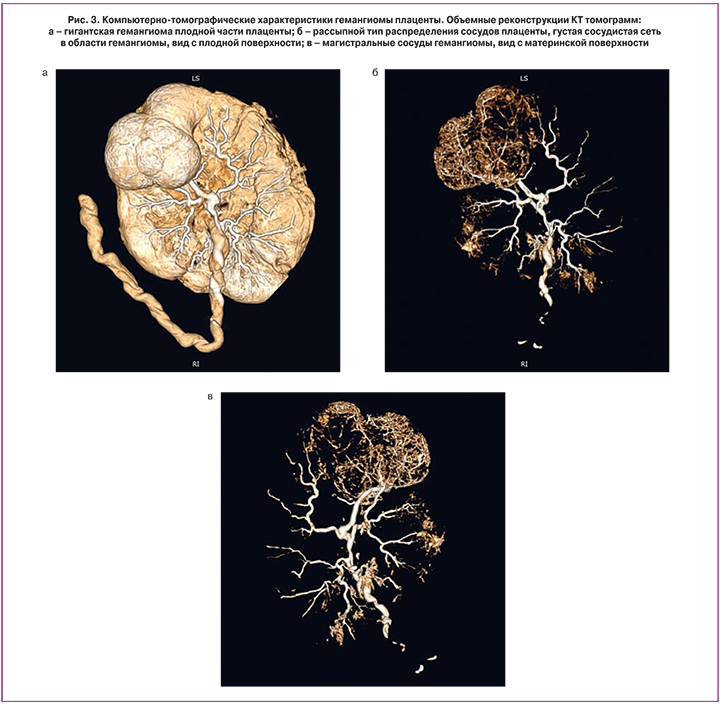
Для определения особенностей кровоснабжения плаценты и выявленного объемного образования проведена компьютерная томография с введением контрастного препарата в вену пуповинного остатка на расстоянии 10 см от места прикрепления к плаценте. Через 10 минут после введения контрастного вещества было проведено сканирование плаценты с последующей трехмерной реконструкцией полученных томограмм.
На полученных томограммах плацента овальной формы диаметром 22×28 см и толщиной от 1,4×см до 2,3 см (рис. 3а). Размеры новообразования плаценты (с учетом внутриплацентарной его части) составили 14×10,7×4,7 см. Пуповина прикреплена эксцентрично, в толще ее определяются три сосуда. Плацента имеет рассыпной тип распределения венозных сосудов. В области образования отмечается наиболее густая сеть разветвленных сосудов среднего и малого диаметра по сравнению с непораженной частью плаценты (рис. 3б). Непосредственно от места прикрепления пуповины прослеживается заполненный контрастным препаратом венозный сосуд диаметром 8,5 мм, продолжающийся до новообразования. Также к указанной области дает ветвь диаметром 6 мм венозный сосуд, расположенный слева. В толще новообразования данные крупные сосуды распадаются на более мелкие сосудистые ветви, густой сетью полностью пронизывающие узел (рис. 3в).
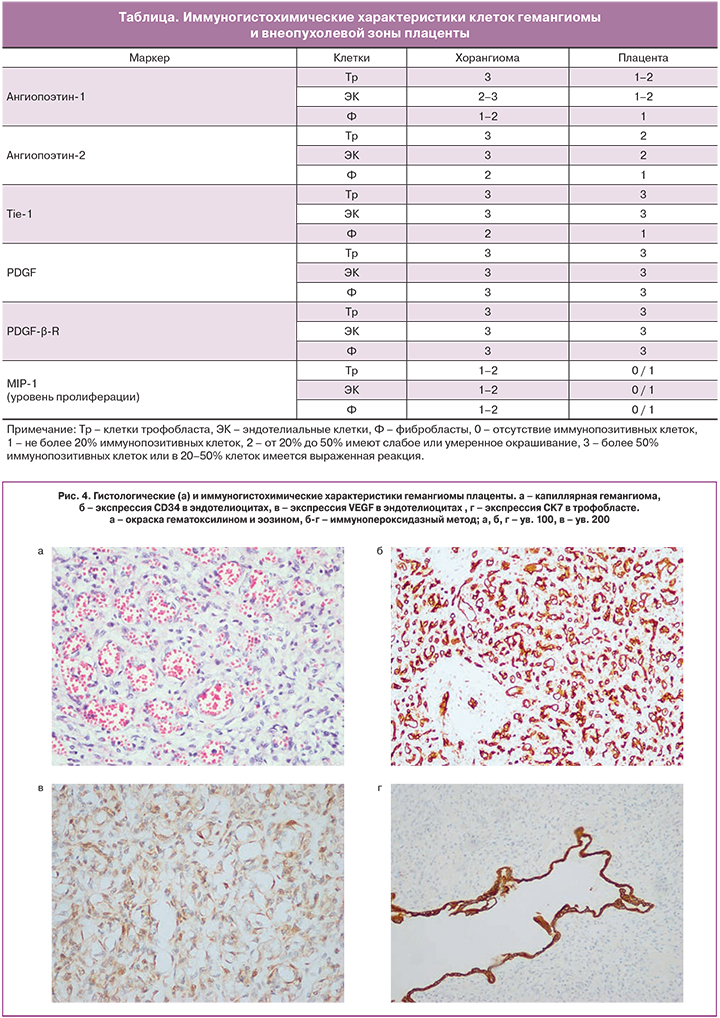
При последующем морфологическом исследовании после отделения пуповины и плодных оболочек масса плаценты составила 792 г, ткань ее на разрезе полнокровная. Узел четко отграничен от ткани плаценты, на разрезе синюшно-розоватого цвета с участками неправильной формы темно-красного цвета (рис. 2б). При микроскопическом исследовании гистологических препаратов узел представлен преимущественно капиллярами с небольшим количеством более крупных сосудов (рис. 4а), расположенными в скудной строме и окруженными преимущественно одним слоем трофобласта. При иммуногистохимическом исследовании в стенках сосудов образования определяется положительная экспрессия маркеров эндотелиальных клеток (CD34 (рис. 4б), CD105) и фактора роста эндотелия сосудов (VEGF) (рис. 4в), в выстилающем трофобласте – реакция с цитокератином 7 (рис. 4г).
Следовательно, в приведенном наблюдении речь идет о гигантской капиллярной гемангиоме плаценты. В зависимости от гистологического строения выделяют следующие варианты гемангиом: капиллярный, кавернозный, эндотелиоматозный, фиброзированный и фиброматозный [4]. Необходимо отметить, что в большинстве случаев гемангиомы определяются лишь при микроскопическом исследовании. Так, по данным M. Guschmann с соавт. [5], среди 136 хорангиом, выявленных при изучении 22 439 плацент, 19,5% опухолей были диаметром 1–2 см, 18% – 2–5 см и лишь 7,5% – более 5 см. Чаще всего опухоли локализуются субхориально, реже – по внешнему краю плацентарного диска [5].
Проводя микроскопическое изучение ткани плаценты, следует помнить, что одним из нарушений васкуляризации ворсин является хорангиоз, который следует дифференцировать с гемангиомой [9].
Под хорангиозом подразумевают увеличение количества капилляров в терминальных ворсинах плаценты. Данный процесс не относится к опухолевым, а рассматривается в качестве индикатора хронической пренатальной гипоксии. Соответственно формирование его происходит в течение нескольких недель. Диагноз хорангиоза ставится в том случае, если при микроскопическом (объектив х10) изучении препаратов плаценты, взятых из различных ее участков вне зон инфарктов и ишемии, в каждом из них определяется не менее 10 ворсинок, каждая из которых содержит не менее 10 капилляров [10].
Большинство исследователей считает обязательным гистологическое, а в ряде случаев и иммуногистохимическое изучение гемангиом плаценты. Так, выявление маркеров эндотелиальных клеток позволяет визуализировать тип кровеносных сосудов. Действительно, при помощи антител к CD31 нами установлен капиллярный вариант хорангиомы, в то же время использование антител к CD105 и VEGF (фактору роста эндотелиальных клеток) позволило установить особенности неоангиогенеза и локализации основного ангиогенного фактора в опухолевых клетках.
Согласно данным литературы [6], опухолевые клетки гемангиомы характеризуются более высокими уровнями экспрессии факторов роста, особенно ангиопоэтинов, по сравнению с неопухолевой тканью плаценты (таблица).
Необходимость проведения иммуногистохимического исследования обусловлена еще и тем, что в литературе имеются указания о возможности развития в плаценте хорангиосаркомы и хорангиокарциномы. В первом случае речь идет о гемангиомах с участками солидного строения, представленными пролиферирующим эндотелием с наличием митозов и признаков атипии ядер [11]. С другой стороны, выявление гемангиом с выраженной пролиферацией и признаками клеточной атипии трофобласта было основанием для постановки диагноза хорангиокарцинома [12, 13]. Однако во всех описанных наблюдениях отсутствовали метастазы, считающиеся достоверным признаком злокачественных новообразований. Видимо, поэтому такие необычные микроскопические проявления гемангиом T.Y. Khong [14] предложил обозначать термином «хорангиома с пролиферацией трофобласта» для последующего обобщения наблюдений и проведения клинико-морфологических сопоставлений, как в отношении матери, так и плода-новорожденного.
Характеризуя микроскопические варианты строения гемангиом, необходимо отметить, что с клинических позиций подобное подразделение, по крайней мере, на сегодняшний день, не целесообразно, поскольку клиническая значимость новообразования зависит в основном от его локализации и размеров.
Установлено, что в зависимости от размеров, локализации и особенностей кровоснабжения, гемангиома может стать причиной различных осложнений как у беременной, так и у плода. Наиболее частыми осложнениями являются многоводие, преэклампсия, преждевременный разрыв плодных оболочек, отслойка плаценты, преждевременные роды, а также задержка роста плода, развитие неиммунной водянки и даже гибель плода [15].
Развитие многоводия отмечается в основном при гигантской гемангиоме, где оно встречается в 14–38% случаев [16, 17]. Вместе с тем, в обстоятельном исследовании M. Guschmann с соавт. [5] многоводие диагностировано лишь в 0,7% наблюдений. Патогенез многоводия связан с повышенным образованием мочи в условиях нарушенной гемодинамики плода и/или с транссудацией жидкости опухолевой тканью, когда последняя сдавливает вену пуповины [16]. В свою очередь многоводие повышает риск развития преждевременных родов, отслойки плаценты и послеродовых кровотечений.
По данным M. Guschmann с соавт. [5], у 32% беременных, имеющих гемангиому плаценты, произошли преждевременные роды. При этом только часть (10%) таких преждевременных родов была связана с инфицированием и/или преждевременным разрывом плодных оболочек. В этой связи авторы считают, что оставшаяся часть (22%) преждевременных родов была обусловлена наличием гемангиомы плаценты размером более 2 см.
У 13,2% женщин с гемангиомой плаценты отмечались симптомы артериальной гипертензии в рамках преэклампсии и HELLP-синдрома, что почти в 7 раз превышало частоту (1,8%) аналогичных симптомов в общей группе беременных. Более того, при наличии HELLP-синдрома гемангиомы плаценты характеризовались бóльшими размерами и более высокими показателями пролиферации опухолевых клеток [18]. Возможной причиной развития гестационной гипертензии у пациенток может являться, на наш взгляд, повышенная экспрессия VEGF опухолевыми эндотелиоцитами. Ранее нами было показано, что развитие преэклампсии сопровождается повышением экспрессии VEGF и VEGFR-1 в структурах плаценты [19]. В настоящем наблюдении при иммуногистохимическом исследовании нами выявлена экспрессия VEGF в опухолевых клетках, что в связи с большим объемом новообразования, несомненно, сопровождалось повышением содержания VEGF в материнском кровотоке с развитием гипертензии.
У беременных, страдающих гемангиомой плаценты, в 3 раза чаще по сравнению с общей популяцией (6,4% против 2,2%) выявлялся сахарный диабет. Кроме того, по 2,2% женщин страдали бронхиальной астмой и ожирением [5]. Кроме того, в литературе описаны наблюдения развития кист желтого тела (лютеиновых кист) в яичниках во время беременности. Причиной развития таких кист считается более высокий уровень хорионического гонадотропина при хорангиоме плаценты по сравнению с нормальной беременностью.
У плодов при наличии гемангиомы плаценты также чаще встречаются различного вида осложнения. По данным M. Guschmann [5] в 10,3% наблюдений имелись нарушения кардиотокограммы, в 5,6% отмечались признаки гипотрофии и в 4,4%, наоборот, макросомии, у 3,6% плодов имелись пороки развития, а у 1,4% – шейное обвитие пуповины.
Формирование нарушений задержки роста плода при гемангиоме плаценты объясняется развитием маточно-плацентарной недостаточности и гипоксии плода вследствие оттока крови из межворсинкового пространства и депонирования ее в сосудах хориоангиомы [20, 21]. Подобное экстракорпоральное скопление крови в ткани новообразования расценивается и в качестве звена патогенеза анемии и тромбоцитопении у плода [22]. При этом другие авторы считают, что основным механизмом развития анемии и тромбоцитопении является гемолиз вследствие повреждения эритроцитов в аномальных микрососудах гемангиомы [23]. Несмотря на неоднозначность в отношении патогенеза, все исследователи едины во мнении о закономерном прогрессировании у плода застойной сердечной недостаточности при больших размерах гемангиомы плаценты [24].
Неслучайной ассоциацией при гемангиоме плаценты является и выявление у новорожденного гемангиоматоза, в том числе диффузной формы с поражением внутренних органов и распространенного гемангиоматоза [25].
Учитывая вышеприведенные осложнения, актуальным моментом ведения беременной является своевременная диагностика гемангиомы плаценты. Основным методом пренатальной диагностики является УЗИ. При УЗИ хорангиома представлена, как правило, в виде гипоэхогенного или гиперэхогенного четко отграниченного образования плаценты. При развитии вторичных изменений (некроза, тромбоза, обызвествления) в ткани опухоли могут отмечаться соответствующие им картины. Решающее значение для диагностики и дифференциальной диагностики принадлежит цветовому допплеровскому картированию (ЦДК), позволяющему выявить в толще гемангиомы многочисленные сосудистые образования, получающие кровь от плода [26]. Более того, считается, что выявление при ЦДК заметного снижения кровотока в структуре гемангиомы указывает на относительно благоприятный исход беременности [26].
Другим перспективным методом диагностики является магнитно-резонансная томография [27]. Наличие изоинтенсивного сигнала на томограммах, полученных в Т1-режиме исследования свидетельствует о неосложненном течении гемангиомы, в то время как гиперинтенсивный сигнал указывает на кровоизлияние. Выявление гетерогенного усиления сигнала в Т2-режиме говорит в пользу гемангиомы.
Компьютерно-томографическое исследование плаценты у беременных обычно не применяется из-за воздействия ионизирующего излучения и сравнительно низкой контрастности ее структуры на получаемых томограммах. Однако данный метод может быть использован при определенных обстоятельствах, в частности, при травме беременной [28] и для оценки трофобластических опухолей [29].
В настоящей работе нами было выполнено компьютерно-томографическое исследование «родившейся» плаценты. Для лучшей визуализации ангио-архитектоники было использование контрастное усиление, при котором установлена более высокая по сравнению с окружающей тканью плаценты васкуляризация новообразования, а также установлены точная локализация и размеры сосудов в непораженной ткани плаценты и в гемангиоме. В этой связи компьютерно-томографическое исследование «родившейся» плаценты с применением контрастирования является, на наш взгляд, эффективным методом анализа ее кровоснабжения и выявления патологических изменений.
К сожалению, в связи с относительной редкостью патологии тактика ведения беременных с гемангиомой плаценты на сегодняшний день разработана явно недостаточно. Имеющиеся в литературе данные [5, 15, 21, 23] указывают, что акушерская тактика при хориоангиоме зависит от ее размеров и состояния плода. При небольших размерах и отсутствии нарушений состояния плода применяется консервативно-выжидательная тактика с естественным родоразрешением. Однако при больших размерах опухоли и наличии сопутствующих нарушений появляется необходимость досрочного родоразрешения или внутриматочного вмешательства. Наиболее частыми показаниями для активной тактики является нарушение его роста, наличие гемодинамических нарушений у плода, вплоть до развития неиммунной водянки, прогрессирующее многоводие.
Родоразрешение является предпочтительным выбором, однако его возможности могут быть ограничены недоношенным сроком беременности и глубокой незрелостью плода. При наличии выраженного многоводия может быть применена паллиативная тактика амниоредукции, позволяющая пролонгировать беременность. Так как наиболее частой причиной страдания плода является «обкрадывание» его кровотока при больших размерах опухоли, функционирующей как артериовенозный шунт, то в этой ситуации возможно проведение внутриутробной хирургической коррекции путем фетоскопии с коагуляцией питающих опухоль сосудов [30]. Также описано склерозирование опухоли с помощью введения спирта в питающую опухоль вену [31].
В связи с возможным развитием гемодинамических нарушений у плода на фоне схваток, в родах необходим тщательный мониторный контроль за его состоянием, при многоводии – соответствующая тактика постепенной редукции объема околоплодных вод. Для профилактики и снижения тяжести неонатальной анемии следует рекомендовать у данной группы пациенток отсроченное пережатие пуповины после рождения ребенка.
Заключение
Таким образом, нами представлено наблюдение гигантской гемангиомы плаценты. Данное наблюдение представляет, на наш взгляд, интерес в связи с относительной редкостью и малой изученностью подобных опухолей в отношении их значения для развития плода и возможных осложнений беременности. Важным является выбор оптимальной акушерской тактики ведения и родоразрешения беременных с гемангиомой плаценты.



