Артерио-венозная мальформация (АВМ) матки – достаточно редкое заболевание, которое встречается преимущественно среди женщин репродуктивного возраста [1]. Клинические симптомы АВМ матки вариабельны: от случайных ультразвуковых находок, до обильных маточных кровотечений в результате спонтанного разрыва измененных сосудов, требующих гемотрансфузий [2]. Особенностью таких кровотечений является отсутствие эффекта от консервативных методов лечения, что особенно опасно при беременности. Описано несколько случаев привычного невынашивания беременности на фоне истинной АВМ матки [1].
В настоящее время широко используется классификация АВМ матки на врожденную и приобретенную [3]. Приобретенные АВМ встречаются чаще и являются следствием травм матки, абортов в анамнезе, либо неопластических процессов [4]. Врожденные АВМ матки – достаточно редкое заболевание, на сегодняшний день описано менее 150 случаев [5]. Данная аномалия наблюдается у 0,22% женщин после родов, однако, во многих случаях АВМ матки бессимптомна и, таким образом, женщины могут жить с заболеванием долгие годы и не подозревать о нем, пока АВМ не проявится клинически [6].
В основе заболевания лежит аномальное эмбриологическое развитие примитивных сосудистых структур, которое приводит к формированию патологических сообщений между артериями и венами. Как правило, врожденные АВМ имеют несколько питающих артерий, центральный узел («клубок» сосудов с гистологическими характеристиками, как артерий, так и вен) и многочисленные дренирующие вены.
К скрининговым методам диагностики сосудистых аномалий развития женских половых органов относится эхография. Мелкие кистовидные очаговые поражения миометрия при обычном трансвагинальном ультразвуковом исследовании (УЗИ) в серой шкале подозрительны на наличие патологии, аномальная гиперваскулярная зона с наличием множества сосудов по данным цветовой допплерографии – характерная черта АВМ. В настоящее время наиболее информативным методом диагностики сосудистых аномалий остается ангиография, однако, использование высокочастотных трансвагинальных датчиков позволяет выявить сосудистые аномалии уже на первых этапах обследования [5].
Тактика лечения АВМ матки зависит от гемодинамических факторов, тяжести кровотечений, возраста и репродуктивного потенциала женщины. Ранее данная патология не оставляла выбора в тактике лечения, и всем пациенткам проводилась гистерэктомия. На сегодняшний день выполнение гистерэктомии проводится намного реже и только среди женщин, не заинтересованных в беременности. Одним из современных вариантов лечения АВМ матки среди женщин репродуктивного возраста является эмболизация маточных артерии (ЭМА) и непосредственно самой АВМ [7]. В основе метода лежит артериальный блок с помощью специальных веществ, вводимых посредством катетера, как правило, через бедренную артерию по стандартной методике Сельдингера. Впервые этот метод лечения был предложен в 1995 г. [8]. В качестве эмболизата в настоящее время используются специальные микроэмболы различных размеров. Частота успешных случаев лечения при выполнении двусторонней ЭМА при АВМ матки доходит до 90% [6].
Клиническое наблюдение
Пациентка С., 1971 г.р., поступила в НМИЦ АГП им. В.И. Кулакова по поводу органосберегающего лечения АВМ сосудов матки и правой подвздошной области. Из анамнеза известно, что в 2006 г. после правосторонней трубной беременности диагностировано повышение уровня хорионического гонадотропина. Установлен диагноз «трофобластическая болезнь». В РОНЦ им. Н.Н. Блохина было проведено 10 курсов полихимиотерапии (метотрексат/лейковорин) с положительным эффектом. Далее в течение полугода проводился контроль, зафиксировано выздоровление. При дальнейшем наблюдении у гинеколога по данным эхографии с цветной допплерографией отмечалось расширение сосудов матки и малого таза. В 2013 г. произошел эпизод массивного кровотечения, завершившийся самостоятельно. В апреле 2016 г. во время гистероскопии по поводу полипа эндометрия при контрольном УЗИ заподозрена АВМ матки. Диагноз верифицирован по данным КТ- ангиографии.
Исследование выполнено на аппарате Toshiba Aquilion Prime в режиме спирального сканирования с толщиной среза 0,8 мм согласно протоколу компъютерной томографии (КТ) органов малого таза с внутривенным контрастированием. Реакции на введение контрастного препарата не отмечено. В полости мочевого пузыря расположены немногочисленные пузырьки газа. В раннюю артериальную фазу определяется заполнение расширенных маточных артерий справа с ранним сбросом контрастного вещества в маточные вены и внутреннюю подвздошную вену справа. Яичниковая артерия справа отходит от аорты, имеет извитой ход, диаметр – 0,5–0,6 см. Внутренняя подвздошная артерия справа расширена, диаметр – до 0,7 см, рассыпается на ветви проекционно в стенке тела матки. Дополнительно от наружной подвздошной артерии справа, на уровне пупартовой связки расположена дополнительная питающая ветвь, диаметром 0,4 см, входящая в правый угол матки. В стенке тела матки расположены многочисленные извитые сосуды с формированием расширенных сосудов до 1,7 см в диаметре, со сбросом контрастного вещества во внутреннюю подвздошную вену справа. Слева яичниковая артерия диаметром 0,2 см, имеет извитой ход. Яичниковая вена слева впадает в левую почечную вену, диаметром – 0,4 см. Ретроаортальный ход левой почечной вены. Заключение: КТ картина АВМ в стенке матки справа (рис. 1).
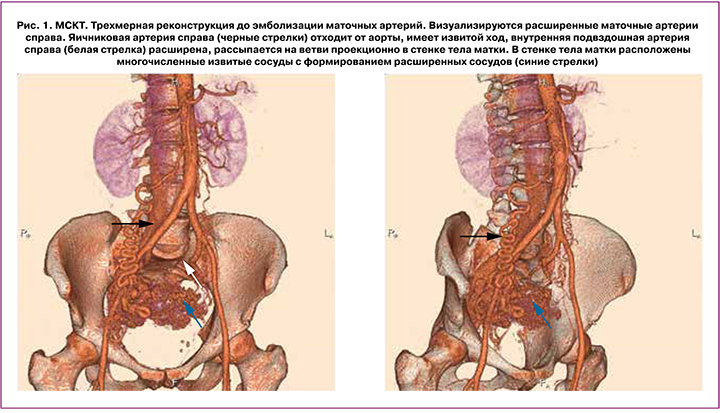
По результатам исследования проведена консультация ангиохирурга, выполнена технически успешная двусторонняя ЭМА, ветвей внутренних подвздошных артерий. Описание операции: под местной анестезией раствором новокаина пунктирована правая бедренная артерия. Установлен интродьюсер 5F. Катететром С2 катетеризирована правая почечная и правая добавочная почечная артерии. Выполнена ангиография. Отмечено кровоснабжение правой яичниковой артерии из измененных ветвей почечных артерий справа. Пупочный артериальный катетер проведен в левую и правую внутренние подвздошные артерии, выполнена ангиография. На ангиограммах отмечается контрастирование обширной зоны патологической васкуляризации в проекции малого таза. Питание осуществляется из маточной артерии слева, маточной артерии справа (определяется крупная артерио-венозная фистула с преимущественным сбросом контрастного препарата в подвздошные вены справа), ветвей внутренней подвздошной артерии справа. Выполнена ЭМА слева цилиндрическими эмболами, маточной артерии справа спиралью 14 см × 15 мм, ветвей внутренней подвздошной артерии справа цилиндрическими эмболами.
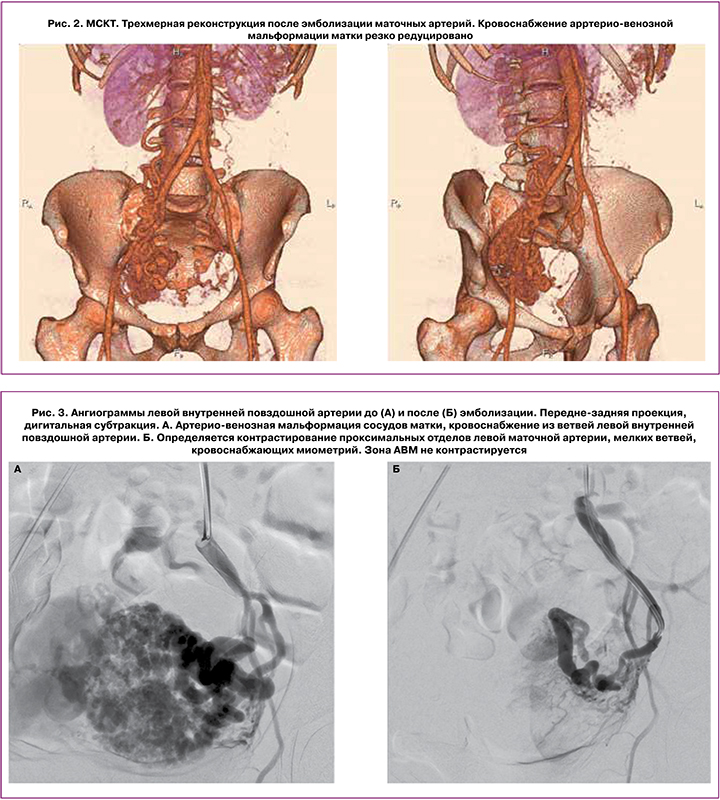
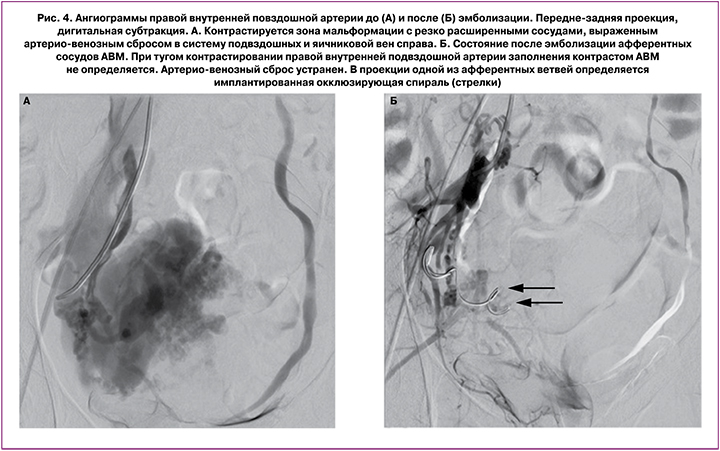
На контрольных ангиограммах кровоснабжение патологического сосудистого сплетения резко редуцировано. Катетер и интродьюсер удалены, компрессионный гемостаз, наложена асептическая давящая повязка. Использовано эмболизирующего материала: цилиндры (ААА 750 мкм × 10 мм) – 8 фл., цилиндры (ААА 600 мкм × 10 мм) – 1 фл. Эффективная эквивалентная доза: 1,37 мЗв. Использовано контрастного препарата: 600 мл (рис. 3, 4).
Обсуждение
Несмотря на то, что АВМ матки – одна из наиболее редких причин маточных кровотечений, она расценивается как потенциально жизнеугрожающее состояние. В исследовании, опубликованном в 2006 г., заболеваемость АВМ матки составила 4,5% [3]. Первое клиническое наблюдение этого заболевания было описано в 1926 г., как множественные аномальные сообщения между артериями и венами без капиллярного слоя с зонами высокой и низкой скорости кровотока, склонными к кровотечениям.
К основным методам визуальной диагностики при данной патологии относятся эхография с цветной допплерографией и традиционная ангиография, которая выполняется, как с диагностической, так и (в большинстве случаев) с лечебной целью. Дополнительное проведение МСКТ-ангиографии позволяет установить локализацию всех сосудов, интересуемой области, выявить особенности сосудистого рисунка, а также получить полноценное представление о характере и распространении патологического процесса. Точная и своевременная диагностика в совокупности с клиническим и лабораторным обследованием способствует адекватному выбору метода лечения.
Заключение
В настоящее время ЭМА является приоритетным методом лечения АВМ матки, позволяющим избежать гистерэктомии у женщин репродуктивного возраста.



