Работа поддержана Грантом Президента Российской Федерации НШ-1694.2014.7.
Экстракорпоральное оплодотворение (ЭКО) рассматривается в настоящее время как один из наиболее перспективных методов лечения женского бесплодия. Однако, несмотря на разработку новых модифицированных схем стимуляции и усовершенствование эмбриологического этапа, результативность программ ЭКО/ИКСИ остается на недостаточно высоком уровне. По данным Европейского регистра вспомогательных репродуктивных технологий (European IVF Monitoring, European Society of Human Reproduction and Embryology, EIM ESHRE), частота наступления беременности в Европе в 2009 г. из расчета на перенос эмбриона составила в среднем 32% [1], а в России по данным РАРЧ в 2011 г. результативность программ ЭКО/ИКСИ составила 37,1%/36,2% [2].
Одной из причин неудач программ ЭКО являются потери на этапе имплантации эмбрионов. Помимо качества эмбриона, важным фактором, определяющим наступление беременности, является рецептивность эндометрия. В многочисленных исследованиях было установлено, что семенная плазма оказывает иммуномодулирующее действие на функции эндометрия [3], и были предприняты попытки использовать введение семенной жидкости в репродуктивный тракт женщин для улучшения рецептивности эндометрия и повышения эффективности программы ЭКО. Согласно данным М. von Wolff и соавт., у пациенток, проходящих лечение по программе ЭКО/ИКСИ, которым вводилась семенная плазма в цервикальный канал и задний свод влагалища в день трансвагинальной пункции фолликулов яичников (ТВП), частота наступления беременности была на 45% выше, чем в группе, получавшей плацебо [4]. Эти результаты были подтверждены в недавно опубликованных работах [5, 6]. Таким образом, в настоящее время использование аппликаций семенной плазмы при проведении процедуры ЭКО рассматривается как перспективное направление повышения эффективности лечения бесплодия.
Однако нельзя исключить, что эффективность наступления беременности может определяться не только свойствами семенной плазмы, но и особенностями состояния иммунной системы женщин, включенных в программу ЭКО. На сегодняшний день накоплено большое количество данных, свидетельствующих о ключевой роли регуляторных Т-клеток (Трег) в иммунной регуляции беременности. Одной из наиболее изученных популяций регуляторных клеток являются так называемые естественные регуляторные Т-клетки (nTрег), тимусного происхождения, с поверхностным фенотипом CD4+CD25+ и конститутивной экспрессией транскрипционного фактора Foxp3 (forkhead box р3), ответственного за их регуляторную активность [7]. Помимо естественного пути образования, T-регуляторные клетки с идентичными фенотипическими характеристиками могут формироваться из периферических CD4+CD25- лимфоцитов при воздействии трансформирующего фактора роста-β и ретиноевой кислоты [8]. С помощью экспериментальных моделей было установлено, что истощение пула Трег приводит к нарушениям имплантации [9, 10].
 Данные о значимости оценки содержания Tрег для прогноза наступления беременности при ЭКО противоречивы. В некоторых работах обнаруживалось повышенное содержание Tрег в периферической крови в группе пациенток с наступившей беременностью по сравнению с группой женщин, у которых беременность не наступила [11]. В работе других авторов не было выявлено зависимости между содержанием Tрег с указанным фенотипом в периферической крови пациенток и наступлением беременности [12].
Данные о значимости оценки содержания Tрег для прогноза наступления беременности при ЭКО противоречивы. В некоторых работах обнаруживалось повышенное содержание Tрег в периферической крови в группе пациенток с наступившей беременностью по сравнению с группой женщин, у которых беременность не наступила [11]. В работе других авторов не было выявлено зависимости между содержанием Tрег с указанным фенотипом в периферической крови пациенток и наступлением беременности [12].
Целью настоящего исследования стало выявление зависимости между содержанием Tрег с фенотипом CD4+CD25highCD127low/- в периферической крови пациенток и наступлением беременности в программе ЭКО при введении семенной жидкости в репродуктивный тракт женщины.
Материал и методы исследования
Проводилось проспективное пилотное исследование. Исследуемую группу составили 36 пациенток, проходивших лечение методом ЭКО в отделении вспомогательных технологий в лечении бесплодия ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России.
Критериями включения пар в исследование были: трубный фактор бесплодия, возраст пациентки не более 40 лет, нормальный овариальный резерв, число предшествующих безуспешных циклов ЭКО не более 2, нормальное анатомическое строение матки, отсутствие системных аутоиммунных заболеваний. Критериями исключения были наружный и внутренний эндометриоз III и IV стадии, миома матки больших размеров, олигоастенотератозооспермия III–IV степени, злокачественные новообразования любой локализации, пороки развития внутренних половых органов. Стимуляция суперовуляции у всех пациенток проводилась с использованием препаратов рекомбинантного фолликулостимулирующего гормона и антагонистов гонадотропин-рилизинг-гормона [13].
Окончательное созревание ооцитов достигалось с помощью 10 000 МЕ хорионического гонадотропина человека (ХГЧ) при наличии при ультразвуковом исследовании (УЗИ) не менее трех фолликулов диаметром >17 мм. Получение ооцитов производилось через 36 ч после назначения ХГЧ путем ТВП под контролем УЗИ. После проведения ТВП всем пациенткам вводилась семенная плазма супруга в объеме 0,5 мл в задний свод влагалища. После культивирования лучшие эмбрионы переносились на 3-й и/или 5-й день после получения ооцитов. Перенос одного эмбриона и перенос двух эмбрионов производились в 19% случаев (n=7) и 81% (n=29) соответственно. Поддержка лютеиновой фазы назначалась всем пациенткам в течение двух недель после переноса эмбрионов. Беременность определялась как возрастание уровня β-субъединицы хорионического гонадотропина в сыворотке крови более 20 МЕ/л на 14-й день после переноса эмбриона с последующей визуализацией плодного яйца при вагинальном УЗИ на 21-й день после переноса эмбриона.
Забор крови проводили в день проведения ТВП яичников. Поверхностный фенотип клеток периферической крови определяли с помощью стандартного набора моноклональных антител, меченных флуоресцеин-изотиоцианатом (ФИТЦ) или фикоэритрином, против антигенов CD3, CD4, CD5, CD8, CD16, CD19, СD56/16 (Becton Dickinson, США). Оценивали содержание основных субпопуляций иммунокомпетентных T-клеток (СD3+, CD4+, CD8+), В-клеток (CD19+), B1-клеток (CD19+CD5+), NK-клеток (СD56/16+), а также содержание Трег (СD4+CD25highCD127low/-) среди CD4+ лимфоцитов периферической крови. Лимфоцитарный гейт, позволяющий исключить из анализа другие клетки крови, выявляли с помощью мАт к СD45, меченных перидинин-хлорофилл протеином (Per-CP), (Dako, Дания). Для оценки процентного содержания Трег среди CD4+ лимфоцитов использовали стандартный набор, содержащий моноклональные антитела к антигенам CD4, меченые ФИТЦ, CD25, меченые фикоэритрином-цианином-7, и СD127, меченые флуоресцентным зондом AlexaFluor 647 (Human Regulatory T Cell Cocktail, Becton Dickinson, США). Моноклональные антитела добавляли непосредственно к цельной крови, затем лизировали с помощью раствора FACS Lysing Solution (Becton Dickinson, США). Анализ проводили с использованием проточного цитофлуориметра FACSСalibur (Becton Dickinson, США).
Статистическая обработка результатов проводилась с использованием пакета прикладных программ «Microsoft» и «MedCalc». При характеристике выборок, удовлетворяющих критериям нормального распределения, использовали среднее значение и стандартное отклонение. Для выборок, не удовлетворяющих критериям нормального распределения, использовали значение медианы и указывали максимальное и минимальное значение соответствующих показателей. Для определения достоверности различия значений в двух независимых выборках использовали критерий Стьюдента и непараметрический критерий Манна–Уитни.
Результаты исследования
Средний возраст пациенток, включенных в исследование (n=36), составил 31,2±3,3 года. Продолжительность бесплодия колебалась от 1 до 11 лет и составила в среднем 4,3±2,9 года. Среднее количество полученных ооцитов составляло 8,1±3,4. Перенесенные эмбрионы были получены в результате ЭКО в 66,7% случаев, ИКСИ в 30,6% случаев и в результате сочетания ЭКО и ИКСИ в 2,8% случаев. Всего беременность наступила у 15 пациенток. Частота наступления клинической беременности из расчета на перенос эмбрионов составила 41,7%, частота имплантации – 32,3%.
В соответствии с результатами лечения бесплодия были сформированы две группы: в I группу были включены пациентки с благополучным результатом лечения бесплодия, во II – пациентки, у которых беременность не наступила.
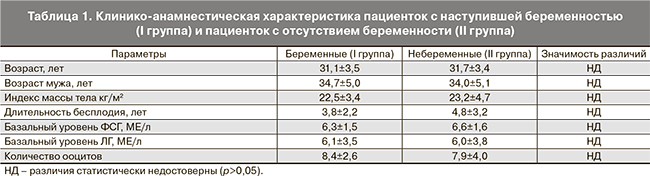
Как показано в табл. 1, статистически значимых различий по возрасту, длительности бесплодия, индексу массы тела, базальному уровню ФСГ и ЛГ между группами пациенток не выявлено. Различий в содержании Т-клеток, В-клеток и NK-клеток в периферической крови женщин с наступившей беременностью (I группа) и пациенток с отсутствием беременности (II группа) выявлено не было (P>0,05).
На рис. 1 представлены результаты оценки процентного содержания Трег среди CD4+ лимфоцитов периферической крови. У пациенток I группы было выявлено снижение доли Трег среди CD4+ лимфоцитов по сравнению с пациентками II группы (P=0,0045) – медиана составила 5,0% (3,0–7,6%) и 6,7% (3,8–14,2%) соответственно.
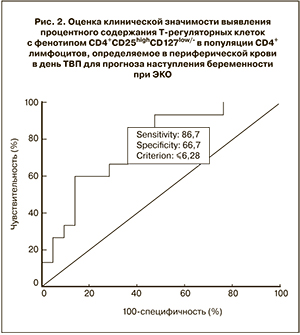
С помощью построения характеристических кривых (Receiver Operating Characteristics) (ROC) [14] определяли диагностическую значимость оценки процентного содержания Трег среди CD4+ лимфоцитов для прогноза наступления беременности (рис. 2).
Прогностическая значимость показателя была достаточно высокой: площадь под кривой составила 0,781, чувствительность теста – 86,7%, специфичность – 66,7% при значении показателей ≤6,3%.
Частота наступления беременности в группе женщин с долей Трег среди CD4+ лимфоцитов, не превышающей 6,3%, составила 65,0%, при больших значениях этого показателя частота наступления беременности была существенно ниже, составляя 22,5% (P<0,001).
Обсуждение
В результате лечения бесплодия с использованием стандартных методов ВРТ, дополненных введением семенной жидкости в репродуктивный тракт женщины, беременность наступила у 41,7% пациенток. Частота наступления беременности по данным других авторов, использовавших введение семенной жидкости при ЭКО, составляла 37,3% [4], 55,5% [5] и 36,9% [6]. Таким образом, полученные нами результаты сопоставимы с данными, полученными другими исследователями.
В представленной работе установлено пониженное содержание Tрег в периферической крови в день ТВП в группе женщин с наступившей беременностью по сравнению с пациентками, у которых беременность не наступила. В работе J. Zhou и соавт., напротив, обнаруживалось повышенное содержание Tрег в периферической крови в день ТВП в группе пациенток с наступившей беременностью [11]. Другими авторами не было выявлено зависимости между содержанием Tрег в периферической крови пациенток и наступлением беременности [12].
 Мы предполагаем, что различия в результатах фенотипирования лимфоцитов могут зависеть от методических приемов, используемых при подготовке периферической крови женщин к анализу. Для оценки содержания Трег в ранее проведенных исследованиях была использована фракция мононуклеарных клеток периферической крови, полученная с помощью сепарации крови в градиенте плотности различных сред. Существенным отличием нашей работы является использование цельной крови, исключающее избирательную потерю отдельных субпопуляций лимфоцитов, а также оптимизированной схемы фенотипирования лимфоцитов [15].
Мы предполагаем, что различия в результатах фенотипирования лимфоцитов могут зависеть от методических приемов, используемых при подготовке периферической крови женщин к анализу. Для оценки содержания Трег в ранее проведенных исследованиях была использована фракция мононуклеарных клеток периферической крови, полученная с помощью сепарации крови в градиенте плотности различных сред. Существенным отличием нашей работы является использование цельной крови, исключающее избирательную потерю отдельных субпопуляций лимфоцитов, а также оптимизированной схемы фенотипирования лимфоцитов [15].
Содержание Трег, выявленное в работе J. Zhou и соавт., было почти в 10 раз ниже по сравнению с полученными нами данными – процент CD4+CD25+Foxp3+ среди CD4+ лимфоцитов, определяемый в день ТВП, составлял 0,77 и 0,59% в группе женщин с наступившей беременностью и с отсутствием беременности соответственно [11]. В нашей работе значения соответствующих показателей составляли 5,0 и 6,7%. Возможно, сепарация клеток с помощью градиента фиколл-гипак, а также дополнительная процедура пермеабилизации лимфоцитов для выявления внутриклеточного содержания Foxp3+, требующая дополнительных отмывок клеток, приводила к существенным потерям лимфоцитов в указанной выше работе.
В последние годы все большее распространение для идентификации популяции Foxp3-позитивных T-регуляторных клеток человека приобретает использование маркера СD127, представляющего собой α-цепь рецептора к интерлейкину-7, выявляемого на поверхности CD4+CD25+ лимфоцитов, так как было установлено, что субпопуляция Т-клеток с фенотипом CD4+CD25highCD127low/- представлена Т-регуляторными клетками (CD4+CD25+ Foxp3) [16]. Данные, полученные нами с помощью указанного маркера, находятся в соответствии с референсными значениями содержания CD25+СD127+low среди СD4+ клеток у здоровых доноров (6,35±0,26%) [16]. Очевидно, что использование цельной крови, а также фенотипирование лимфоцитов с помощью поверхностных маркеров, позволяющее избежать процедуры пермеабилизации и анализировать живые клетки, является оптимальным подходом для оценки содержания Трег в периферической крови.
Нами было установлено, что низкое содержание Трег в периферической крови женщин в день ТВП является позитивным прогностическим фактором для имплантации. Нельзя исключить, что снижение содержания Трег в периферической крови отражает усиление миграции Трег в область матки, что обеспечивает иммунорегуляцию имплантации. Изучению механизмов миграции Трег и подтверждению влияния миграции на процессы имплантации посвящены многочисленные экспериментальные исследования [17].
Подтверждена миграция Трег периферической крови беременной женщины в децидуальную ткань [18]. Установлено, что Трег экспрессируют хемокиновый рецептор ССR7 [19], обеспечивающий миграцию клеток в матку [20] и их взаимодействие с соответствующим лигандом CCL19, локализованном на поверхности железистого и покровного эпителия матки [21]. При отсутствии экспрессии ССR7 регуляторными клетками наблюдается нарушение имплантации [20].
Важную роль в регуляции миграции Трег могут играть иммунно-эндокринные механизмы. Наиболее ранним эмбриональным сигналом, необходимым для эмбрио-эндометриального взаимодействия, является продукция ХГЧ, которая обнаруживается уже на стадии 2-клеточного эмбриона [22] и существенно увеличивается при последующих делениях, происходящих перед имплантацией [23]. Так как на поверхности Tрег присутствуют рецепторы к ХГЧ [24], эмбрион может осуществлять не только тонкую настройку рецептивности эндометрия, но и стимулировать миграцию Трег в зону имплантации. Сигналами, усиливающими миграцию Трег в область имплантации до переноса эмбриона, могут являться как усиление секреции ХГЧ железистым и покровным эпителием эндометрия в секреторную фазу менструального цикла [25], так и секреция хемоаттрактантов маточным эпителием, индуцируемая ХГЧ [26]. Нельзя исключить, что введение пациенткам ХГЧ за сутки до ТВП, включенное в стандартный протокол ЭКО, может также приводить к активации клеток эндометрия и служить дополнительным фактором, усиливающим синтез хемоаттрактантов и миграцию Трег.
Известно, что имплантация и самые ранние стадии первого триместра физиологической беременности протекают на фоне провоспалительных Th1-реакций [27–29], при которых усиливается продукция хемокинов иммунокомпетентными клетками – макрофагами, дендритными клетками, Т- и В-лимфоцитами [30], локализованными в эндометрии, которые также могут усиливать миграцию Трег. Активная миграция Трег из периферической крови может являться одним из механизмов иммунорегуляции начальных стадий беременности. Нами показано, что низкое содержание доли клеток с фенотипом CD4+CD25highCD127low/- среди CD4+ лимфоцитов в момент проведения пункции является показателем, свидетельствующим о высокой вероятности наступления беременности при ЭКО. По-видимому, содержание Трег в периферической крови в день ТВП может служить интегральным маркером сбалансированности иммуно-эндокринных изменений, обеспечивающих дальнейшее усиление рецептивности эндометрия, достигающей максимума в период «окна имплантации».
Таким образом, в представленной работе выявлены клинически значимые показатели клеточного иммунитета, позволяющие прогнозировать наступление беременности при проведении программ ВРТ в день ТВП. Оценка процентного содержания доли клеток с фенотипом CD4+CD25highCD127low/- среди CD4+ лимфоцитов до проведения пункции может быть использована для прогноза наступления беременности, что может явиться одним из подходов к повышению эффективности ЭКО.



