Авторы систематического обзора, выполненного в 2022 г., подчеркивают отсутствие согласованного определения «маточного фактора» бесплодия, включающего, кроме врожденных аномалий, и другие заболевания матки [1]. Вместе с тем в МКБ-10 бесплодие маточного происхождения содержит две нозологии – врожденные аномалии матки и дефект имплантации яйцеклетки. Последнее состояние многие исследователи связывают с хроническим эндометритом (ХЭ), который представляет собой локальное персистирующее воспаление слизистой оболочки матки инфекционной этиологии с инфильтрацией плазмоцитами стромы эндометрия. Распространенность ХЭ в общей популяции составляет от 14,1 до 24,4% [2, 3]. До недавнего времени диагностика ХЭ была затруднена, в связи с чем нередко в литературе встречается термин «бесплодие неясного генеза», частота которого указывается в более широком диапазоне – от 2,8 до 56,8%, что отражает отсутствие четких критериев [4–6]. При использовании вспомогательных репродуктивных технологий (ВРТ) рецидивирующие неудачи имплантации (РНИ) при диагностированном ХЭ наблюдаются у 7,7–67,5% пациенток [7, 8].
Исследования последних лет свидетельствуют о том, что нарушение репродуктивной функции при ХЭ обусловлено изменением рецептивности эндометрия, являющейся результатом провоспалительного состояния в эндометрии вследствие активации местной иммунной защиты, сопровождающейся секрецией цитокинов и хемокинов, неполноценной децидуализации и васкуляризации эндометрия, дискоординированной сократительной активности матки [9].
Зарубежные авторы указывают на высокую эффективность антибактериальной (АБ) терапии ХЭ и восстановление фертильности после нее с увеличением показателя живорождений в программах ЭКО (ОР=9,75) при условии излечения ХЭ по сравнению с продолжающейся после лечения персистенцией патологического процесса [10, 11]. При дополнении АБ-терапии внутриматочным введением богатой тромбоцитами плазмы частота наступления беременности увеличивалась до 75,9%, показатель живорождений достигал 62,7% при излечении ХЭ; тогда как при сохраняющихся признаках ХЭ они были ниже – 40,0 и 36,7% соответственно [12]. Поэтому поиски методов излечения ХЭ продолжаются, и в настоящее время широко исследуются состав микробиоты эндометрия и ее взаимодействие с иммунной системой, а также иммунопатологические процессы, следствием которых является нарушение имплантации [13–15].
Новым направлением терапии ХЭ и достижения беременности являются иммуномодулирующие средства, которые в метаанализе 53 исследований признаны «полезными» для пациентов с бесплодием и РНИ [16]. Сетевой метаанализ 16 РКИ, обобщивший результаты влияния иммуномодуляторов у пациенток с РНИ, показал наилучшие результаты при внутриматочном введении аутологичных мононуклеарных клеток периферической крови (МКПК), получаемых от пациенток перед ЭКО, с увеличением шансов на живорождение в 2 раза по сравнению с другими средствами [17]. Результат подтвержден в другом сетевом метаанализе (21 РКИ) с улучшением данного показателя в 3 раза [18].
Ряд отечественных исследований посвящен изучению эффективности лекарственного средства (ЛС), содержащего комплекс природных противомикробных пептидов и цитокинов, который получают из МКПК (лейкоцитов крови свиней). Показано его положительное влияние на элиминацию возбудителей и разрешение ХЭ, экспрессию определенных генов, нормализацию баланса про- и противовоспалительных цитокинов, частоту наступления беременности и живорождений [19–21]. Преимуществами данного ЛС являются локальное действие и удобство применения пациентками самостоятельно в виде вагинальных или ректальных свечей.
Результаты выполненных исследований свидетельствуют о необходимости дальнейшего изучения данной проблемы среди пациенток, нуждающихся в ВРТ, и проведения качественных РКИ для получения доказательств высокого уровня, подтверждающих эффективность иммуномодулирующей терапии.
Цель исследования: повысить эффективность экстракорпорального оплодотворения у пациенток с маточной формой бесплодия, обусловленной ХЭ, путем комплексного лечения в прегравидарном периоде с использованием комплекса природных противомикробных пептидов и цитокинов.
Материалы и методы
Дизайн – рандомизированное контролируемое испытание в параллельных группах. Дизайн был открытым для пациенток и исследователей, слепым – для специалистов, выполнявших анализ полученных результатов, для создания условий независимой оценки.
Организация исследования. Набор материала и наблюдение проводились с сентября 2019 по июнь 2023 гг. на базе женской консультации ГБУЗ ТО «Перинатальный центр» (Тюмень, Россия). Исследованию присвоено название «ТЮЛЬПАН 2» (аббревиатура от: ТЮменский перинатаЛЬный центр, течение и исходы беременности у ПАциенток с хроническим эНдометритом; второе исследование). Первое исследование «ТЮЛЬПАН» было посвящено прегравидарной подготовке пациенток с тем же диагнозом и лечением, из которого часть пациенток, у которых не наступила спонтанная беременность (n=332), были включены в настоящее исследование.
Этические аспекты. При создании протокола исследования учитывались требования Хельсинкской декларации Всемирной медицинской ассоциации (пересмотр 64-й Генеральной ассамблеи Всемирной медицинской ассоциации, г. Форталеза, Бразилия, 2013 г.), положения «Международных этических рекомендаций по проведению биомедицинских исследований с участием людей» Совета международной организации медицинских наук (ред. 2002 г.), Национального стандарта РФ ГОСТ Р52379-2005 «Надлежащая клиническая практика» (2005 г.), других законодательных и нормативных документов РФ. Протокол исследования одобрен локальным Этическим комитетом (окончательная версия протокола v3.0 от 20 июля 2019 г.). Все пациентки дали письменное информированное добровольное согласие на участие в исследовании.
Контингент. Приемлемыми для участия в исследовании признаны 4153 пациентки с маточной формой бесплодия, обратившиеся в Тюменский перинатальный центр и предварительно обследованные для установления причины бесплодия (блок-схема представлена на рисунке).
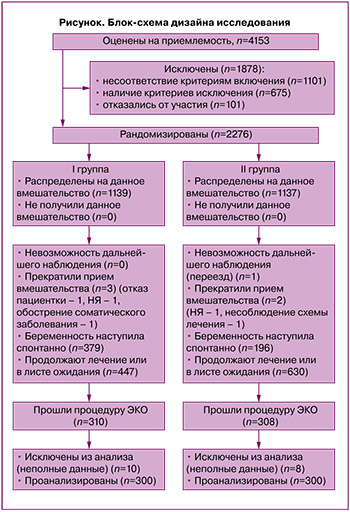
Расчет выборки не требовался, так как в исследование были включены все пациентки, обратившиеся за медицинской помощью за указанный период с диагнозами: женское бесплодие маточного происхождения, дефект имплантации яйцеклетки (N97.2), хроническая воспалительная болезнь матки (N71.1), подтвержденными гистологически и иммуногистохимически, и отвечавшие критериям включения: возраст 18–45 лет, овуляторный менструальный цикл, достаточный овариальный резерв, толщина М-эхо 8 мм и более на 12–14-й день менструального цикла по данным УЗИ, интактные маточные трубы, изокоагуляция крови, отсутствие противопоказаний к применяемым ЛС, наличие подписанного информированного добровольного согласия. Критерии исключения: гипопластический вариант ХЭ (М-эхо менее 8 мм), мужской фактор бесплодия (тератозооспермия III–IV ст.), гинекологические заболевания (миома матки, эндометриоз, кисты яичников, интраэпителиальные поражения шейки матки), пороки развития половых органов, иные причины бесплодия, инфекции, передающиеся половым путем и/или инфекционно-воспалительные заболевания нижнего отдела полового тракта в течение последних 6 месяцев, тяжелые соматические заболевания, резус-отрицательная кровь, повышенная чувствительность к компонентам применяемых ЛС.
Рандомизация пациенток на 2 группы (по 300 человек) проведена с помощью метода генерации случайной последовательности распределения (использовали таблицы случайных чисел) с вероятностью распределения в группы, равной 50%; сокрытие случайной последовательности выполнено с помощью конвертов.
Методы лечения. Для лечения ХЭ и восстановления рецептивности эндометрия в прегравидарном периоде использовалась схема терапии в рамках помощи пациентам с соответствующим диагнозом, утвержденная в Тюменском перинатальном центре. Применяли ЛС, перечисленные ниже.
АБ-терапия: таблетки диспергируемые доксициклина моногидрат (препарат «Юнидокс Солютаб», «ЗиО-Здоровье», Россия) по 100 мг 2 раза в день в течение 10 дней; по показаниям применяли ЛС, содержащее неомицина сульфата 100 мг, тернидазола 200 мг, нистатина 100 000 ЕД и преднизолона метасульфобензоата натрия 3 мг (препарат «Тержинан», Laboratoires Bouchara-Recordati, Франция) по 1 таблетке во влагалище утром 10 дней; далее после АБ-лечения – пробиотик, содержащий лактобактерии не менее 1×107-8 КОЕ, по 1 суппозиторию вагинально утром в течение 10 дней.
Иммуномодулирующая терапия: комплекс природных противомикробных пептидов и цитокинов (МНН: белково-пептидный комплекс из лейкоцитов крови свиней) – препарат «Суперлимф» (ООО «Альтфарм», Россия), суппозитории по 25 ЕД 1 раз в день вагинально вечером в течение 20 дней на один курс.
Гестагены: дидрогестерон (препарат «Дюфастон», Abbott Biologicals B.V., Нидерланды) по 1 таблетке 10 мг 1 раз в день 10 дней с 14-го по 25-й дни менструального цикла.
Все ЛС использовали в соответствии с действующими инструкциями по медицинскому применению, опубликованными в Реестре лекарственных средств.
Схема лечения. В обеих группах с первого цикла начинали прием гестагена во 2-ю фазу по указанной выше схеме и продолжали в течение 6 месяцев. В группе I лечение включало препарат «Суперлимф» и АБ-терапию (1 курс), во II – только АБ-терапию (1 курс). После окончания первого курса проводили контроль готовности эндометрия к ЭКО с 19-го по 22-й дни менструального цикла при помощи гистологического, иммуногистохимического исследований, а таже с учетом показателей оптической спектрометрии с использованием отечественного прибора «Фотон-Био» на 10–12-й день менструального цикла на основании показателей состояния эндометрия – индексов оксигенации, пролиферативной активности, структурированности и порфиринового индекса. В случае если показатели готовности эндометрия достигали удовлетворительных значений, пациентку направляли в центр ЭКО. В случае неудовлетворительных показателей пациентка продолжала лечение, применяя гестаген в обеих группах и в I группе – препарат «Суперлимф» по указанной выше схеме (второй курс с интервалом 2–3 месяца). Выполнение ЭКО планировалась после завершения лечения и процедур контрольного обследования и в соответствии с очередностью получения квоты. Решение об использовании метода ВРТ пациенткой принималось совместно с лечащим врачом после консультации врача-репродуктолога. Контролируемая стимуляция овуляции, забор ооцитов, витрификация и перенос эмбрионов проводились в отделении ВРТ на базе медицинского центра «Малыш» (Тюмень, Россия), клинического госпиталя «Мать и дитя» (Тюмень, Россия) согласно утвержденным в учреждениях протоколам. Использование замороженного эмбриона для переноса являлось обязательным условием для продолжения участия в данном РКИ. После витрификации вновь оценивали состояние эндометрия и при неудовлетворительных показателях проводили еще 1–2 курса приема препарата «Суперлимф», продолжая прием прогестерона; во II группе – только прогестерон (но не более 6 месяцев). Таким образом, интервал от витрификации до переноса составлял от 1 до 6 месяцев, из них: в I и II группах соответственно через 1 месяц – у 2,3 и 4,0% пациенток (р=0,23), 2 месяца – 22,0 и 19,7% (р=0,48), 3 месяца – 35,3 и 28,0% (р=0,05), 4 месяца – 16,7 и 17,0% (р=0,91), 5 месяцев – 14,7 и 15,7% (р=0,73), 6 месяцев – 9,0 и 15,7% (р=0,01).
Перед криопереносом пациенткам обеих групп выполнялась подготовка (праймирование) эндометрия согласно протоколу: за 132 ч до предполагаемой овуляции или 168 ч от пика лютеинизирующего гормона до переноса эмбриона назначался дидрогестерон 10 мг 2 раза в день, прием которого продолжали до 20 недель беременности. Качество эмбрионов в день переноса по классификации D. Gardner – от 3АА и выше. Осуществляли перенос только одного эмбриона.
Гипотеза. Эффективность программ ЭКО с переносом размороженного эмбриона выше у пациенток с маточной формой бесплодия, обусловленной ХЭ, получавших на прегравидарном этапе комплексное лечение, включающее препарат «Суперлимф»/АБ/прогестерон, по сравнению с пациентками, получавшими только АБ/прогестерон.
Комплаенс. Прием ЛС пациентками контролировался врачом-исследователем с помощью «подсчета таблеток/суппозиториев», которые участники возвращали после окончания курса лечения. Комплаентность (соблюдение схемы вмешательства) считали адекватной, если пациенткой было принято более 80% исследуемых ЛС с даты начала до конца курса лечения.
Методы обследования пациенток включали комплекс клинических, принятых в акушерстве и гинекологии, и лабораторных исследований на этапе отбора пациенток в исследование – жалобы, анамнез, общий и гинекологический осмотр, микроскопия мазков влагалищного содержимого, полимеразная цепная реакция в режиме реального времени для идентификации вирусов и исключения инфекций, передающихся половым путем (Фемофлор, ООО «ДНК-технологии», Россия); морфологическое исследование эндометрия (окраска гематоксилином и эозином, увеличение ×400) и иммуногистохимическое исследование (ИГХ) с окраской синдеканом-1 для определения плазмоцитов (CD138+) (ИФА набор Syndecan-1/CD138, CD138, SDC1)/Human Syndecan-1/CD138(SDC1) ELISA Kit; CUSABIO BIOTECH Co., Ltd., Китай), увеличение ×400 (положительной считали реакцию при визуализации одной плазматической клетки в 10 случайных полях зрения). Безопасность лечения (наличие/отсутствие побочных эффектов) оценивали на основании дневников наблюдения, которые пациентки заполняли самостоятельно и предъявляли врачу-исследователю на каждом визите.
Наблюдение проводили после выполнения криопереноса (оценивали частоту наступления клинической беременности на основании визуализации плодного яйца по данным УЗИ в сроке 6–8 недель), в дальнейшем – на протяжении беременности до родов с оценкой первичных и вторичных результатов лечения.
Оценка результатов. Первичные результаты – частота наступления клинической беременности после ЭКО и частота живорождения (в срок 240 недели и более). Вторичные – частота и гестационный срок выкидышей (до 116 и 120–236 недель), преждевременных (240–366 недель) и срочных родов (370–416 недель), течение беременности (частота осложнений), состояние новорожденного, частота нежелательных явлений.
Сведения о результатах получали путем выкопировки из индивидуальных карт беременной и родильницы (уч. форма № 111/у-20), медицинских карт беременной, роженицы и родильницы, получающей медицинскую помощь в стационарных условиях (№ 096/у-20) и историй развития новорожденных (№ 097–1/у-97). Данные внесены в электронную базу (предварительно анонимизированы) и подвергались проверке специалистом-статистиком на готовность к анализу (удалялись пациентки с неполными данными). Окончательный анализ проводился по первичному критерию (частота наступления клинической беременности) среди 287 пациенток.
Статистический анализ
Статистический анализ данных выполняли, используя программу Statistica for Windows 10.0 (StatSoft Inc., США). Распределение признаков оценивали при помощи критерия Колмогорова–Смирнова. Непрерывные переменные с нормальным распределением выражали в виде средних значений (М) и стандартного отклонения (SD), иные – в виде медианы (Ме) и межквартильного диапазона (Q1; Q3). Качественные признаки указывали абсолютными числами (n), а их доли – относительными величинами (%). Анализ различий в независимых выборках проводили с помощью U-критерия Манна–Уитни, качественных признаков – при помощи критерия χ2. Значимыми считали различия при р<0,05 и уровнях ошибки первого и второго рода α=5% и β=20% соответственно. Анализ выполняли соответственно назначенному вмешательству (intention-to-treat analysis). Зависимость вмешательства и исхода определяли по методу Woolf путем расчета относительного риска (ОР) с 95% доверительным интервалом (ДИ).
Результаты
Социальная и клиническая характеристика пациенток представлена в таблице 1.
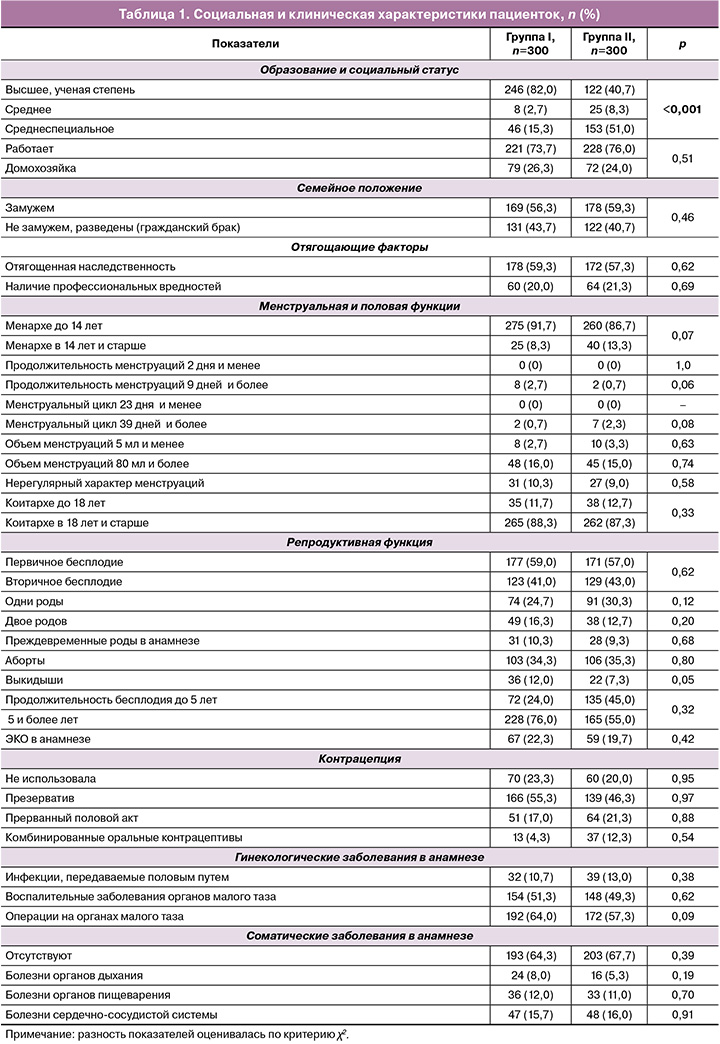
Возраст пациенток варьировал от 18 до 45 лет, Ме (Q1; Q3)=36 (33; 38) лет. Большинство из них находились в возрасте 35 лет и старше – 67,3% (202/300) и 63,0% (189/300) в I и II группах соответственно, р=0,27. Анализ таблицы 1 показал отличие пациенток между группами I и II только по уровню образования, по остальным параметрам статистически значимые различия отсутствовали. Привычное невынашивание беременности (2 и более выкидыша в анамнезе) не встречалось. Данные общего осмотра и соматического статуса в обеих группах были сопоставимы.
Продолжительность бесплодия в среднем составила 6,0 (4,5; 7,0) и 5,5 (4,0; 6,5) лет соответственно, р=0,06. Количество пациенток с бесплодием 5 лет и более составило 76,0% (228/300) и 55,0% (165/300) соответственно, р<0,001.
Среди пациенток I группы 1 курс лечения с использованием препарата «Суперлимф» прошли 21 человек (7,0%), 2 курса – 142 (47,3%), 3 – 100 (33,3%) и 4 курса – 37 (12,3%) пациенток.
Оценка эффективности лечения
Первичные исходы представлены в таблице 2. Общая частота наступления беременности в результате ЭКО у пациенток, прошедших прегравидарную подготовку, составила 57,0% (171/300) против 38,7% (116/300) в I и II группах соответственно, р<0,001. Комплексная терапия ХЭ с использованием препарата «Суперлимф» на прегравидарном этапе способствовала увеличению шансов наступления беременности в программах ЭКО в 1,5 раза (ОР=1,47; 95% ДИ: 1,24–1,75) по сравнению с терапией без него вне зависимости от возраста и продолжительности бесплодия.
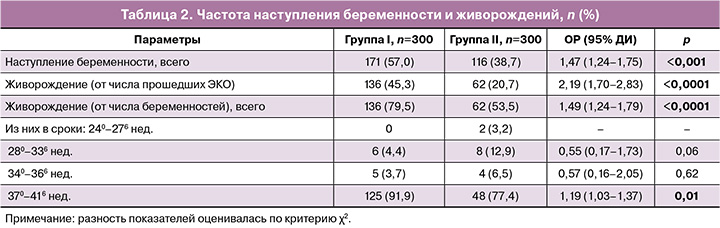
Показатель живорождения от числа всех пациенток, прошедших ЭКО, составил в I и II группах 45,3% (136/300) и 20,7% (62/300) соответственно, р<0,0001, с увеличением шансов на рождение живого ребенка более чем в 2 раза у пациенток, получавших препарат «Суперлимф» (ОР=2,19; 95% ДИ: 1,70–2,83).
Среди пациенток в возрасте 35 лет и более наступление беременности наблюдалось чаще в I группе – 65,4% (132/202) против 40,7% (77/189) во II, р<0,001 (ОР=1,60, 95% ДИ: 1,31–1,96), и значительно лучше был показатель живорождений – 48,5% (98/202) против 18,5 (35/189) соответственно, р<0,001 (ОР=2,62, 95% ДИ: 1,887–3,65). Статистически значимой разницы между группами в частоте этих показателей у пациенток в возрасте менее 35 лет не было (р=0,41).
Среди пациенток с продолжительностью бесплодия 5 лет и более показатель наступления беременности был выше в I группе – 65,8% (150/228) против 46,1% (76/165) во II, р<0,001, равно как и частота живорождений – 50,9% (116/228) против 18,8% (31/165), р<0,001. Включение препарата «Суперлимф» в комплексную терапию у этой категории пациенток способствовало увеличению в 1,4 раза шансов наступления беременности в программах ЭКО (ОР=1,43, 95% ДИ: 1,18–1,73) по сравнению с получавшими только АБ/прогестерон, и в 2,8 раза выше были шансы на живорождение (ОР=2,76, 95% ДИ: 1,96–3,88). Статистически значимой разницы между группами в частоте этих показателей у пациенток с продолжительностью бесплодия менее 5 лет не было (р=0,94).
Рождение живого ребенка в доношенных сроках (370–416 недель) положительно зависело от приема препарата «Суперлимф» (ОР=1,19; 95% ДИ: 1,03–1,37, р=0,01), но не оказывало значимого влияния на живорождение при сроках родов менее 37 недель.
Таким образом, включение препарата «Суперлимф» в комплексную терапию ХЭ в период прегравидарной подготовки повышало вероятность наступления беременности в программах ЭКО с криопереносом (в 1,5 раза), в том числе у пациенток с продолжительностью бесплодия 5 лет и более. Вероятность рождения живого ребенка при приеме препарата «Суперлимф» у пациенток с доношенной беременностью была выше в 2 раза, а в когорте с бесплодием 5 лет и более – в 2,8 раза.
Вторичные исходы представлены в таблице 3 (расчет проведен от числа наступивших беременностей и от числа родившихся). Общая частота самопроизвольных выкидышей (СПВ) у пациенток, получавших комплексное лечение с препаратом «Суперлимф», была ниже в 2 раза и составила 19,9% (34/171) против 38,8% (45/116) во II группе, р<0,001 (ОР=0,55, 95% ДИ: 0,35–0,75).
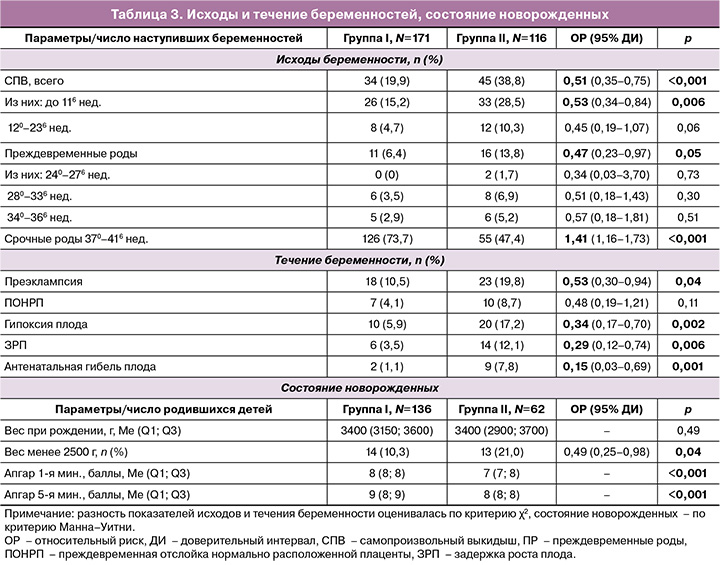
Комплексная терапия препаратом «Суперлимф» в группе I способствовала снижению риска СПВ в ранние сроки в 2 раза по сравнению со II (ОР=0,53, 95% ДИ: 0,34–0,84, р=0,006), но не оказывала статистически значимого влияния на частоту СПВ в поздние сроки (р=0,06). Общая частота преждевременных родов (ПР) (менее 370 недель) в I и II группах составила 6,4% (11/171) против 13,8% (16/116) соответственно, р=0,05, с уменьшением риска рождения недоношенного ребенка в I группе по сравнению со II в 2 раза (ОР=0,47; 95% ДИ: 0,23–0,97).
Таким образом, лечение пациенток с ХЭ в прегравидарном периоде с использованием комплекса «Суперлимф»/АБ/прогестерон способствовало снижению риска СПВ в ранние сроки и ПР ранее 370 недель в 2 раза у пациенток, забеременевших в результате ЭКО, но статистически значимого влияния на риск СПВ в поздние сроки не оказывало.
Использование препарата «Суперлимф» в комплексном лечении ХЭ перед криопереносом способствовало снижению риска осложнений беременности (табл. 3): преэклампсии – в 2 раза (ОР=0,53, 95% ДИ: 0,30–0,94, р=0,04), гипоксии и задержки роста плода – в 3 раза (ОР=0,34, 95% ДИ: 0,17–0,70, р=0,002 и ОР=0,29, 95% ДИ: 0,12–0,74, р=0,006 соответственно), а также антенатальной гибели плода – в 6,7 раза (ОР=0,15, 95% ДИ: 0,03–0,69, р=0,001).
Вес детей при рождении колебался от 2700 до 3700 г и в среднем статистически значимо не отличался между группой I по сравнению со II (р=0,49). Частота рождения детей весом менее 2500 г в группах I и II составила 10,3% (14/136) и 21,0% (13/62) соответственно, р=0,04 (ОР=0,49; 95% ДИ 0,25–0,98), что свидетельствует о снижении риска рождения маловесных детей в 2 раза при использовании комплекса с препаратом «Суперлимф». Оценка состояния новорожденных по шкале Апгар на 1-й и 5-й минутах составила в среднем 8–9 и 7–8 баллов соответственно и была статистически значимо ниже у пациенток, получавших терапию без препарата «Суперлимф» (р<0,001). Отклонений в неврологическом статусе у новорожденных не наблюдалось в обеих группах.
После проведенного лечения наблюдалось разрешение ХЭ по данным ИГХ с отсутствием плазматических клеток в микропрепарате эндометрия в группах I и II у 79,3% (238/300) и 50,7% (152/300) пациенток соответственно (ОР=1,57; 95% ДИ 1,38–1,77, р<0,001). По данным гистологического исследования отмечено уменьшение лимфоидных инфильтратов в равной степени в обеих группах и снижение выраженности фиброза в группе I.
В двух наблюдениях (по одному в каждой из групп) потребовалось прекращение лечения вследствие возникновения нежелательных явлений – оба характеризовались диспепсией, тошнотой, рвотой, что было обусловлено реакцией желудочно-кишечного тракта на прием антибиотика. У 5 и 4 пациенток соответственно наблюдались дискомфорт или жжение во влагалище после введения антимикробного ЛС, что не требовало отмены препарата.
Таким образом, течение и исходы беременностей, наступивших в результате ЭКО с криопереносом, значительно отличались в лучшую сторону у пациенток с ХЭ, получавших на прегравидарном этапе комплексное лечение, в состав которого был включен препарат иммуномодулирующего действия «Суперлимф».
Обсуждение
Преодоление маточной формы бесплодия, связанного с ХЭ, представляет определенные трудности, что обусловлено сложностью патогенеза этого состояния. Среди причин неудачных попыток ЭКО выделяют два фактора – неспособность к внутриматочной нидации полученных in vitro эмбрионов (эмбриональный фактор) либо снижение рецептивности эндометрия (эндометриальный фактор); при этом последний, при условии получения эмбрионов хорошего качества, приобретает ведущую роль, обусловливая до 70% неудач ЭКО, что мотивирует ученых к поиску новых методов воздействия на эндометрий.
Большинство авторов поддерживают применение АБ в терапии ХЭ как формы воспалительного заболевания органов малого таза. Однако формирование хронического воспаления в эндометрии связано не столько с вирулентностью микроорганизмов, сколько с особенностями иммунной реакции макроорганизма на локальном уровне. Именно от реакции иммунной системы зависит формирование постинфекционного воспалительного синдрома, гистохимически ассоциированного с образованием в макрофагах и нейтрофилах эндометрия особых белковых комплексов (инфламмасом) и сопровождающегося гиперпродукцией провоспалительных цитокинов, которые поддерживают воспалительный процесс после элиминации возбудителя [22]. Это обосновывает использование в комплексной терапии ХЭ иммуномодулирующих средств, обладающих нормализующим действием.
В публикуемых исследованиях частота наступления беременности и живорождения в программах ЭКО после АБ-терапии ХЭ отличается большой вариабельностью. Так, в метаанализе 12 РКИ разница между указанными показателями, по сравнению с плацебо или отсутствием лечения, не обнаружена [10], тогда как у пациенток с подтвержденным излечением ХЭ была выше и в отдельных исследованиях достигала 43,2 и 32,8% соответственно [23, 24] с максимальными показателями 65,2 и 60,8% соответственно в одном исследовании [25] у пациенток с разрешением ХЭ (при средней продолжительности бесплодия 2–3 года). Дополнение к АБ внутриматочного введения МКПК увеличивало шансы на беременность в 2 раза, составив 46,2 против 20,9% у получавших только АБ; этот результат, по мнению авторов, указывает на четкую роль иммуномодуляции эндометрия и воспалительного процесса в успехе ЭКО [26]. В другом исследовании у пациенток, получавших МКПК, беременность и живорождение были достигнуты у 41,2 и 35,3% против 11,1 и 5,5% соответственно без лечения [27]. Отечественные авторы использовали МКПК, активированные хорионическим гонадотропином человека в стимулированных циклах и с криопереносом у пациенток с неудачами ЭКО в анамнезе; при этом частота наступления клинической беременности составила 29,4 и 36% соответственно против 4,5 и 20,8% соответственно с использованием плацебо (р=0,03) (при продолжительности бесплодия в среднем 5–6 лет); данные о живорождении не приводятся [28]. В настоящем исследовании общая частота наступления беременности и живорождения в результате ЭКО после лечения АБ/прогестероном в прегравидарном периоде составила 38,7 и 20,7% соответственно, тогда как в комплексе с препаратом «Суперлимф» эти показатели достигли 57,0% (р<0,001) и 45,3% (р<0,001) соответственно, с увеличением шансов на наступление беременности и рождение живого ребенка в 1,5 и 2 раза соответственно (при продолжительности бесплодия от 4,5 до 7 лет).
То есть показатели эффективности ЭКО после АБ-терапии, полученные во II группе, можно считать сопоставимыми с результатами других исследований [23, 24], а в группе получавших препарат «Суперлимф» они были выше даже по сравнению с результатами у пациенток, применявших аутологичные МКПК [26–28].
Известно, что успешность циклов ЭКО снижается с увеличением возраста матери [29, 30]. Так, по последним данным, частота наступления беременности в результате ЭКО у пациенток в возрасте 30–34, 35–39 и 40–43 лет составила 52,6, 24,7 и 9,4% соответственно (р<0,0001) [31]. В настоящем исследовании среди пациенток в возрасте 35 лет и более при использовании препарата «Суперлимф» в прегравидарной подготовке к ЭКО наступление беременности наблюдалось чаще – у 65,8 против 46,1% пациенток, не применявших его (ОР=1,60), и значительно лучше был показатель живорождений: 50,9 против 18,8% соответственно (ОР=2,62), что превышает аналогичные результаты, полученные в других исследованиях, прегравидарная подготовка в которых не проводилась.
В литературе отмечается, что при длительном течении бесплодия (более 5 лет) вероятность наступления спонтанной беременности практически отсутствует; при необъяснимом бесплодии у таких пациенток шансов на зачатие не больше даже при лечении [1], а показатели живорождения после ЭКО – ниже [32, 33]. В нашем исследовании выявлена связь между приемом препарата «Суперлимф» с увеличением в 1,4 раза шансов наступления беременности в программах ЭКО у пациенток с продолжительностью бесплодия 5 лет и более (ОР=1,43), и в 2,8 раза выше были шансы на живорождение (ОР=2,76) по сравнению с теми, кто получал только АБ/прогестерон.
Согласно мировой статистике, частота СПВ после ЭКО может достигать 20–40% [34]. Однако авторы отмечают, что частота выкидышей не связана непосредственно с процедурой ЭКО, а может быть вызвана другими факторами, такими как инфекции, нарушения в иммунной системе и другими заболеваниями. Утверждается, что даже при разрешении ХЭ под влиянием АБ повышенный риск СПВ среди женщин, проходящих лечение ЭКО, сохраняется (ОШ=1,49) по сравнению с пациентками без ХЭ [35]. В систематическом обзоре и метаанализе 17 РКИ показано, что при ЭКО повышен риск ПР (ОР=1,84) и рождения детей с низкой массой тела <2500 г (ОР=1,60) по сравнению со спонтанными беременностями [36]. Комплексная терапия ХЭ в прегравидарном периоде с использованием препарата «Суперлимф» в комбинации с АБ/прогестероном способствовала уменьшению риска СПВ в ранние сроки и ПР в 2 раза и низкой массы тела новорожденного в 3 раза по сравнению с лечением АБ/прогестерон, составив соответственно 19,9; 6,4 и 10,3%, что было ниже по сравнению с исходами, которые приводятся в работах других авторов [34–36]. Более низкая частота этих осложнений может быть связана с тем, что экспрессия рецепторов к прогестерону в эпителии и строме эндометрия увеличивается в 3 и 2,7 раза соответственно и улучшаются показатели ангиогенеза и васкуляризации эндометрия под влиянием препарата «Суперлимф», что было показано в исследованиях Доброхотовой Ю.Э. и соавт. [37]. Авторами также установлены восстановление экспрессии факторов врожденного иммунитета, купирование хронического воспаления и нормализация рецептивности ткани [38].
Течение беременности после ЭКО сопровождается повышенным риском преэклампсии (ОШ=2,97) [39] и низкого веса плода для гестационного возраста (ОР=1,50) [40] по сравнению со спонтанной беременностью. Данных о частоте гипоксии и антенатальной гибели плода в доступной литературе не найдено. При дополнении комплексного лечения препаратом «Суперлимф» улучшается не только состояние эндометрия, но и процесс инвазии трофобласта после имплантации, что является критическим для нормального функционирования плаценты в дальнейшем и влияет на течение беременности. Это подтверждается снижением риска преэклампсии в 2 раза, гипоксии и задержки роста плода в 3 раза, а также антенатальной гибели плода в 6,7 раза.
Препарат «Суперлимф» представляет собой комплекс, в состав которого входят противомикробные белковые молекулы, цитокины, такие как интерлейкины-1 и -6, фактор торможения миграции макрофагов, фактор некроза опухоли α, трансформирующий ростовой фактор β, а также ряд минорных примесей хемокинов (семейство структурно-гомологичных цитокинов) в необходимой концентрации. Регуляция иммунного ответа осуществляется именно цитокинами, которые являются естественными передатчиками сигналов между иммунными клетками [16]. Если активация клеток недостаточна, дополнительная экзогенная доза цитокинов приводит к усилению их функциональной активности, и, напротив, при избыточной активности подавляет ее и вызывает нормализацию их деятельности. Это положение подтверждается Тапильской Н.И. и соавт., в исследовании которых установлено снижение количества цитотоксических Т-лимфоцитов (CD8+), В-лимфоцитов (CD20+) в стромальном компоненте эндометрия и, наоборот, увеличение Т-хелперов (СD4+), что сопровождалось существенным снижением признаков ХЭ и наблюдалось у значительно большего числа пациенток, получавших АБ-терапию плюс препарат «Суперлимф», по сравнению с получавшими АБ-терапию [19].
Хотя научного консенсуса относительно наилучшего иммунологического лечения пациентов с ХЭ с несбалансированным соотношением Th1/Th2 или иммунной дисрегуляцией не достигнуто, тем не менее, недавние исследования показали потенциал использования МКПК как хорошего способа модулирования рецептивности эндометрия [41], вариантом которого является введение комплекса экзогенных природных противомикробных пептидов и цитокинов, продемонстрировавший лучшие результаты.
Заключение
Использование препарата «Суперлимф» в комплексе с АБ/прогестероном для лечения маточной формы бесплодия, обусловленной ХЭ, в период прегравидарной подготовки позволяет улучшить результаты ЭКО.
Лечение ХЭ на прегравидарном этапе перед выполнением ЭКО с криопереносом, включающее препарат «Суперлимф» в дозе 25 ЕД 1 раз в день вагинально по 20 дней 2–3 курсами с перерывом 2–3 месяца, АБ в первом курсе и прогестерон во вторую фазу цикла в течение 6 месяцев способствует повышению частоты наступления беременности до 57%, увеличивает шансы на рождение живого ребенка в 2 раза, а у пациенток с продолжительностью бесплодия 5 лет и более – в 2,8 раза, и способствует снижению частоты осложнений во время гестации – СПВ в ранние сроки, преэклампсии и ПР – в 2 раза, гипоксии и задержки роста плода – в 3 раза, антенатальной гибели плода – в 6,7 раза по сравнению с пациентками, получавшими только АБ/прогестерон.



