Отсутствие четкой концепции патофизиологии синдрома гиперстимуляции яичников (СГЯ) делает невозможным проведение эффективного, патогенетически обоснованного лечения, позволяющего действенно и в короткие сроки купировать развитие синдрома и полиорганные нарушения, сопровождающие тяжелые формы СГЯ.
Цель лечения: профилактика развития полиорганной дисфункции посредством восстановления объема циркулирующей плазмы (ОЦП), устранения гемоконцентрации, электролитного дисбаланса, профилактики острой почечной недостаточности (ОПН), респираторного дистресс-синдрома взрослых (РДСВ) и тромбоэмболических осложнений. Лечение проводят до момента самопроизвольной регрессии синдрома [1–4].
Амбулаторное лечение при СГЯ легкой степени
Ежедневная оценка веса и диуреза, ограничение избыточной физической активности и половой жизни, питье по потребности.
Показания к госпитализации: СГЯ средней и тяжелой степени.
Организация медицинской помощи на стационарном этапе
Принимая во внимание выраженный полиморфизм клинической симптоматики СГЯ, вероятность быстрого ухудшения состояния пациентки, вплоть до развития полиорганной недостаточности, госпитализацию этих больных целесообразно осуществлять в профильные отделения, имеющие опыт ведения таких женщин и обладающие необходимым перечнем медикаментозных препаратов. Тяжесть состояния пациентки должна быть полностью и своевременно оценена и занесена в историю болезни как обоснование тактики ведения. В клинических рекомендациях европейских клиник ВРТ особо подчеркивается, что лечение этих больных должны проводить врачи, обладающие клиническим опытом ведения СГЯ, так как тактику лечения необходимо определять быстро с минимальной вероятностью ошибок. Хирургическое пособие при показаниях должна осуществлять постоянная хирургическая бригада высококвалифицированных специалистов, имеющих соответствующий опыт. Необходимо взаимодействие врача клиники ЭКО с клиницистом в стационаре, так как именно врачи репродуктологи обладают наиболее полной информацией о тактике ведения больных с СГЯ [1].
Тактика ведения при поступлении в стационар
Первый этап: правильный сбор анамнеза, позволяющий предположить развитие СГЯ, клинико-лабораторное и инструментальное обследование, на основании которого оценивают параметры гемодинамики, дыхания, мочеотделения, наличие и характер электролитных нарушений, функцию печени, концентрацию белка в плазме крови, коагуляционный потенциал крови, наличие полисерозитов, исключают внутрибрюшное кровотечение и перекрут придатков матки.
Второй этап: постановка периферического венозного катетера. Вопрос об использовании центрального венозного катетера решается индивидуально и определяется тяжестью состояния женщины. При необходимости наиболее целесообразна катетеризация подключичной вены, поскольку риск тромбоза в этом случае наименьший. Особенностью тромбозов у данного контингента больных является их преимущественная локализация в яремных сосудах. Одним из преимуществ постановки центрального катетера является возможность мониторинга центральной гемодинамики и коррекции объема инфузионной терапии [2, 3].
Для оценки диуреза возможна постановка катетера в мочевой пузырь, однако, принимая во внимание связанный с этим риск восходящей мочевой инфекции, оценка необходимости катетеризации мочевого пузыря должна производиться индивидуально и ежедневно.
Третий этап: медикаментозное лечение пациенток с СГЯ должно быть направлено на поддержание гемодинамики. Первостепенной задачей этого этапа является возмещение объема циркулирующей плазмы (ОЦП) для снижения гемоконцентрации и поддержания достаточной почечной фильтрации. При проведении инфузионной терапии целесообразно поддержание циркулирующего объема на минимальном уровне, достаточном для адекватной системной перфузии. Клинический ориентир – функция почек, лабораторный – уровень гематокрита.
Инфузионную терапию начинают с введения кристаллоидов с последовательным назначением коллоидов. Объем инфузионной терапии определяется показателями мочеотделения, артериальным давлением (АД), величиной гематокрита, при необходимости – величиной центрального венозного давления (ЦВД) и эхокардиографией. При нормализации указанных параметров (уровень гематокрита <40%, восстановление мочеотделения) инфузионная терапии прекращается. Несоблюдение этого подхода ведет к развитию гемодилюции, провоцирующей нарастание полисерозитов и ухудшение состояния пациентки.
Выбор раствора кристаллоидов определяется электролитным дисбалансом. Препаратом выбора является раствор Рингера, 0,9% раствор хлорида натрия. Следует относиться с осторожностью к применению растворов, содержащих калий, в связи с риском развития гиперкалиемии. Инфузионную терапию начинают с введения 500 мл кристаллоидного раствора при уровне гематокрита до 45% и 1000 мл – при уровне гематокрита 45% с последующим назначением коллоидов в дозе 1000 или 1500 мл соответственно [2–4].
При определении количества вводимых кристаллоидов необходимо учитывать, что в условиях генерализованного повреждения эндотелия объем этих растворов должен быть меньше объема коллоидных растворов в 2–3 раза, так как преобладание кристаллоидов усугубляет развитие полисерозитов, а в ряде случаев приводит к развитию анасарки.
При выборе раствора коллоидов необходимо руководствоваться представлениями о том, что СГЯ – ятрогенное состояние, характеризующееся генерализованным повреждением эндотелия на фоне системной воспалительной реакции. Поэтому основой базисной инфузионной терапии должен выступать раствор, способный наиболее эффективно работать в этих условия. Наиболее полно этим требованиям отвечает раствор гидроксиэтилированного крахмала (ГЭК) с низкой молекулярной массой 130 000 Да и степенью замещения 0,4 [5–8]. Раствор ГЭК 6% (130/0,4) используют в суточном объеме 15–30 мл/кг массы тела. При критическом СГЯ возможно увеличение дозы до 50 мл/кг массы тела.
Положительными свойствами ГЭК, обосновывающими его преимущественное использование у больных с СГЯ, является способность быстро восполнять и удерживать ОЦП в условиях генерализованного повреждения эндотелия, длительно находиться в кровеносном русле, эффективно повышать коллоидно-осмотическое давление, не оказывать отрицательного воздействия на эндотелий сосудов, ингибировать выброс фактора Виллебранда из эндотелиальных клеток, улучшать реологические свойства крови, микроциркуляцию, уменьшать отек тканей, легко метаболизироваться и выводиться почками, не вызывать аллергические реакции.
Раствор ГЭК 6–10% (200/0,5) в суточном объеме 20 мл на кг массы тела также может использоваться в базисной терапии СГЯ. Однако свойством, сдерживающим применение этого раствора при СГЯ по сравнению с ГЭК (130/04), является его способность накапливаться в организме при длительном применении (более 7 дней), вызывать дисфункцию печени и повышать уровень печеночных трансаминаз до 800 Ед/л [9].
Растворы ГЭК 6% (450/0,7) нецелесообразно применять у данного контингента больных в связи с негативным влиянием на функцию почек, печени и ухудшением параметров гемокоагуляции.
Показаниями к введению растворов альбумина в условиях генерализованного повреждения эндотелия при СГЯ является гипоальбуминемия (альбумин плазмы менее 25 г/л или белок менее 47 г/л). Используют 20% раствор в суточном объеме 3,5 мл/кг массы тела с последующим введением фуросемида, применение которого обосновано представлениями о том, что белок в условиях «эндотелиоза» легко проникает через поры эндотелия и способствует перемещению воды в интерстиций, увеличивая риск развития интерстициального отека легких [10, 11].
Свежезамороженная плазма используется в комплексной терапии СГЯ только при подтвержденном дефиците факторов свертывания крови.
Диуретики неэффективны для эвакуации жидкости из третьего пространства и противопоказаны при гиповолемии и гемоконцентрации из-за еще большего снижения объема внутрисосудистой жидкости. Их ограниченное назначение оправдано при достижении значений гематокрита 36–38% на фоне тщательного мониторинга гемодинамики, сохраняющейся олигурии и периферических отеках [2, 3].
Имеются данные об эффективности и безопасности применения низких доз допамина в лечении пациенток с СГЯ тяжелой степени для повышения почечного кровотока и клубочковой фильтрации [12, 13]. В то же время в мультицентровом плацебо-контролируемом исследовании 328 больных в критическом состоянии с клиническими признаками начальной почечной недостаточности не было выявлено протекторного эффекта постоянной внутривенной инфузии низких доз допамина [13].
Купирование болей: парацетамол, спазмолитики. Нестероидные противовоспалительные препараты не должны использоваться, ввиду возможного негативного влияния на функцию почек и плод в ранние сроки беременности [2, 3].
Основой профилактики тромботических осложнений при СГЯ является устранение гемоконцентрации. Антитромботическая терапия показана при появлении лабораторных признаков гиперкоагуляции [10, 14–16]. Используемые препараты: нефракционированный гепарин (НГ) и низкомолекулярные гепарины (НМГ). Необходимым условием для назначения НГ является нормальное значение антитромбина III (АТ-III). Суточная доза – 10–20 тыс. ЕД подкожно. Лабораторный контроль – активированное частичное тромбопластиновое время (АЧТВ), определение количества тромбоцитов на 7-е сутки лечения.
Показанием для назначения НМГ является повышение концентрации D-димера в плазме крови, которое обычно сопровождается повышением уровня фибриногена и снижением концентрации АТ-III.
Эффективную и безопасную лечебную дозу НМГ целесообразно подбирать индивидуально, в зависимости от массы тела пациентки и уровня анти-Ха-фактора активности плазмы крови, определенным через 3 часа после инъекции препарата и соответствующим моменту максимальной активности НМГ. Уровень анти-Ха-фактора активности плазмы – это концентрация НМГ в плазме крови. Для каждой разовой дозы любого из НМГ существует диапазон его эффективной и безопасной концентрации, при этом под безопасностью подразумевают минимальную вероятность кровотечения. Шкала для подбора терапевтической дозы НМГ представлена в табл. 1, при этом наиболее эффективной будет доза препарата, удерживаемая в верхнем диапазоне терапевтической концентрации.
Стартовая разовая доза для дальтепарина натрия составляет 100-анти-Xa МЕ/кг, для надропарина кальция – 100–150 анти-Xa МЕ/кг, для эноксапарина натрия – 1 мг/кг. Разовую дозу препарата вводят дважды в сутки подкожно с интервалом в 12 ч. Лечебную разовую дозу НМГ титруют на основании анти-Ха-активности плазмы крови. При манифестации СГЯ и подборе эффективной лечебной дозы гемостазиологический мониторинг осуществляют не менее двух раз в неделю, при регрессе симптомов – 1 раз в неделю или в 10 дней. Длительность терапии НМГ определяется нормализацией уровня D-димера и при беременности может превышать 30 дней. В циклах с несостоявшейся беременностью все показатели гемостазиограммы возвращаются к исходным значениям перед наступлением менструации, что не превышает 2 недель [2, 17, 18].
Все используемые НМГ обладают одинаковой эффективностью и переносимостью. Частота наступления беременности и репродуктивных плодовых потерь не зависит от вида используемого НМГ.
Назначение глюкокортикостероидов, антигистаминных препаратов, нестероидных противовоспалительных средств не эффективно.
Принимая во внимание положительный эффект от назначения препаратов иммуноглобулинов в профилактике вторичных инфекций при других заболеваниях, сопровождающихся потерей белка, например при нефротическом синдроме, можно рассчитывать на эффективность этой терапии и у пациенток с СГЯ. Однако для окончательного подтверждения или опровержения этой гипотезы с позиций доказательной медицины необходимо проведение исследований.
Показанием для проведения эмпирической антибактериальной терапии является риск возникновения вторичной инфекции у больных в критическом состоянии или при нестабильной гемодинамике. Смена подобранного эмпирически препарата производится по результатам бактериологического исследования. При назначении эмпирической антибактериальной терапии необходимо руководствоваться информацией о тяжести заболевания, факторах риска возникновения инфекции, особенностях антибиотикорезистентности в данном отделении. Для снижения риска инфекционных осложнений у этих пациенток проведение инвазивных манипуляций, в частности абдоминального парацентеза, торакоцентеза, лапароскопии, лапаротомии должно выполняться только по строгим показаниям.
Нутритивная поддержка пероральными белковыми препаратами проводится всем пациенткам с СГЯ, находящимся в стационаре.
Показанием для эвакуации асцитической жидкости у женщин с СГЯ является прогрессирующий напряженный асцит. Снижение внутрибрюшного давления после удаления асцитической жидкости приводит к повышению кровотока в почечных венах, увеличению венозного возврата и сердечного выброса. Для лапароцентеза может быть выбран трансабдоминальный или трансвагинальный доступ. Техническую сложность создают увеличенные яичники, в связи с чем применение ультразвукового контроля обязательно.
При тяжелом течении СГЯ, особенно на фоне беременности, целесообразно пролонгированное порционное удаление перитонеального транссудата из брюшной полости длительностью от 7 до 30 дней апирогенным катетером. Это подход имеет ряд преимуществ, так как позволяет избежать одномоментной эвакуации большого объема жидкости и тем самым исключить резкие колебания внутрибрюшного давления, вызывающие нарушения гемодинамики, стабилизировать состояние больной, избежать повторных пункций брюшной полости.
Одномоментный объем эвакуированной жидкости может составлять около 3,5 л и для каждой пациентки определяется индивидуально. Суммарный объем эвакуируемой асцитической жидкости за период лечения СГЯ тяжелой степени иногда колеблется от 30 до 90 л [14, 15, 17].
Трансвагинальная пункция возможна только в условиях специализированных стационаров клиник ЭКО под ультразвуковым контролем врачом-специалистом, владеющим данной манипуляцией, по причине высокого риска ранения яичников и развития внутрибрюшного кровотечения.
В качестве клинических примеров необходимо отметить, что мы неоднократно наблюдали у пациенток напряженный асцит и при полном отсутствии возможности трансвагинального доступа. При ультразвуковом исследовании увеличенные яичники визуализировались один над другим и полностью закрывали доступ в малый таз для асцитической жидкости. Нетрудно представить, что трансвагинальная пункция в данных клинических ситуациях без ультразвукового контроля могла бы повлечь за собой осложнения, представляющие угрозу жизни женщины.
Показанием для эвакуации транссудата из плевральных полостей является дыхательная недостаточность, сохраняющаяся после удаления асцитической жидкости из брюшной полости при показателях гематокрита ≤40%. Виду невозможности полностью исключить вероятность осложнения (пневмоторакс) в ходе плевральной пункции целесообразно сначала пунктировать одну плевральную полость, а на следующий день – другую.
По биохимическому составу перитонеальная жидкость аналогична плазме крови конкретной пациентки и представляет собой транссудат с высоким содержанием белка. По цвету перитонеальная жидкость может быть от янтарно-желтой до геморрагической. Геморрагический характер обусловлен «пропотеванием» эритроцитов в третье пространство при тяжелой форме СГЯ или примесью крови. Для исключения внутрибрюшного кровотечения необходимо определение гематокрита и эритроцитов в перитонеальной жидкости [19].
Отказ от аутотрансфузии асцитической жидкости обусловлен высоким содержанием в ней провоспалительных цитокинов, повторное введение которых в кровеносное русло из брюшной полости усугубляет течение СГЯ, усиливая синдром системного воспалительного ответа.
При отсутствии показаний для лапароцентеза асцит постепенно самопроизвольно регрессирует.
Динамическое наблюдение пациенток с СГЯ. На момент манифестации синдрома при развернутой клинико-лабораторной симптоматике необходимы ежедневная оценка баланса жидкости в организме и ежедневное исследование показателей клинического анализа крови. При нормализации гемодинамических показателей и уровня гематокрита оптимальным считается исследование лабораторных показателей каждые 2–3 дня [1–3, 20, 21].
Однако при увеличении тяжести болевого синдрома, напряженности живота, затруднении дыхания и уменьшении диуреза необходимо экстренная полная оценка состояния женщины.
Динамика определения электролитов плазмы крови, уровня креатинина, белка, альбумина, активности ферментов печени, показателей коагулограммы определяется индивидуально. Исследование протромбинового индекса, международного нормализованного отношения (МНО) и АЧТВ не дает информации для оценки риска тромботических осложнений [20].
Ультразвуковое исследование брюшной полости и малого таза проводят для определения степени увеличения размеров яичников и наличия асцита. Использование компьютерной томографии не всегда целесообразно, поскольку требует дополнительной транспортировки пациентки и повышает риск неблагоприятных исходов. При проведении рентгенографии органов грудной клетки или компьютерной томографии у пациенток с СГЯ необходимо помнить о возможности наступления у них беременности и проводить эти исследования по строгим показаниям (подозрение на респираторный дистресс-синдром взрослых, тромбоэмболию).
Типичная ошибка при лечении женщин с СГЯ заключается в необоснованном пролонгировании инфузионной терапии на фоне отсутствия гемодинамических нарушений и попытке полностью купировать развитие СГЯ как ятрогенное состояние, а также в отказе от своевременной эвакуации асцитической жидкости при напряженном асците и сохраняющейся олигурии. Указанные подходы в первом случае провоцируют нарастание полисерозитов, в связи с чем приходится постоянно эвакуировать транссудат из брюшной и плевральной полостей, а во втором случае напрямую ведут к развитию полиорганной недостаточности, хотя важнейшей целью лечения СГЯ является именно профилактика этого осложнения.
Показание к переводу больной в отделение реанимации и интенсивной терапии является критическая степень СГЯ, а также развитие осложнений, сопровождающихся риском для жизни пациентки. Показанием к прерыванию беременности является критическая стадия СГЯ.
Хирургическое лечение при СГЯ оправдано лишь при наличии острых гинекологических заболеваний: перекрута придатка, разрыва кисты яичника, кровотечения из кисты яичника. Признаком кровотечения у больных с СГЯ является резкое падение гематокрита без улучшения мочеотделения, отражающее степень кровопотери [2, 3].
Перекрут придатка манифестирует острыми болями в нижних отделах живота и рвотой. Наиболее эффективной операцией в данном случае является лапароскопическое раскручивание яичника, а ранняя диагностика и адекватное хирургическое лечение определяет благоприятный прогноз. Поздняя диагностика влечет за собой необходимость удаления некротизированного яичника при лапаротомном доступе.
Необходимо отметить необоснованность и недопустимость стратегии лечения больных с неосложненным СГЯ, заключающейся в экстренном оперативном вмешательстве и резекции около 30–50% яичниковой ткани либо двусторонней овариоэктомии в связи с предположительным диагнозом «рак яичников» и/или пельвиоперитонитом. Подобная тактика в мире расценивается как врачебная ошибка с соответствующими юридическими последствиями.
Прогноз
При наступлении беременности – ее осложненное течение за счет угрозы прерывания в I и II триместрах и развития фетоплацентарной недостаточности и риска преждевременных родов в III триместре. Отдаленных результатов о качестве жизни женщин, перенесших тяжелый СГЯ, и риске развития у них онкологических заболеваний в доступной литературе нет.
Профилактика
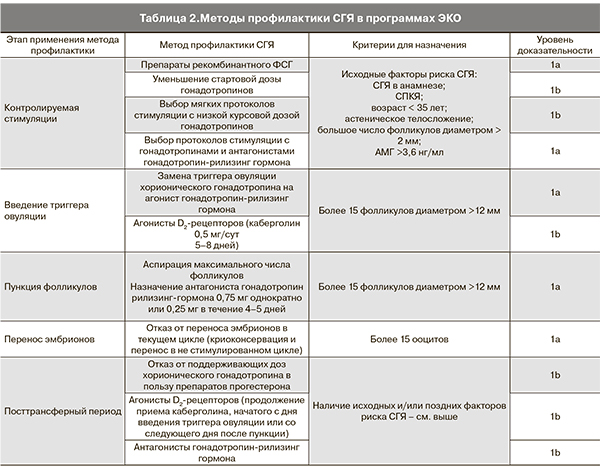
На современном этапе развития ВРТ основная задача клинициста-репродуктолога заключается в профилактике развития ятрогенного синдрома. Все пациентки, проходящие лечение в программах ВРТ, должны быть отнесены в группу риска развития СГЯ. В табл. 2 представлены существующие методы профилактики СГЯ с позиций доказательной медицины [22–35].
Анализируя меры профилактики, СГЯ следует отметить, что ключевыми моментами предотвращения раннего СГЯ являются: оценка факторов риска, при наличии которых выбирают протокол стимуляции с антагонистами, минимальную стартовую дозу гонадотропина, заменяют триггер овуляции и отказываются от переноса эмбрионов в данном лечебном цикле. Если перенос эмбрионов произведен, вероятность развития позднего СГЯ в ответ на имплантацию остается высокой. В то же время замена триггера овуляции и модифицированные протоколы поддержки посттрансферного периода позволяют в большинстве случаев избежать развития тяжелого СГЯ, требующего стационарного лечения, и ограничится амбулаторным наблюдением. Если же, несмотря на принятые профилактические мероприятия, поздний СГЯ развился, эффективной является лишь симптоматическая терапия, направленная на коррекцию симптомов СГЯ и профилактику полиорганных нарушений.
Уровень доказательности:
- 1a – метаанализ рандомизированных контролируемых исследований (РКИ),
- 1b – хотя бы одно РКИ,
- 2 – хотя бы одно контролируемое испытание или квазиэкспериментальное исследование,
- 3 – неэкспериментальные описательные исследования,
- 4 – экспертные мнения либо клинический опыт признанного авторитета.
Улучшение организации медицинской помощи женщинам с СГЯ невозможно без четкого статистического анализа, отражающего истинную частоту развития этого ятрогенного синдрома в расчете на цикл стимуляции, определения числа женщин, госпитализированных в стационар, продолжительности их госпитализации, частоты развития осложнений СГЯ, а также исходов беременностей, осложнившихся ятрогенным синдромом, включая угрозу прерывания беременности по триместрам, развитие гестоза, фетоплацентарной недостаточности, отслойки плаценты, преждевременных родов, рождения детей с низкой массой тела.