Вирус папилломы человека (ВПЧ) представляет собой обширную группу вирусов (более 100 типов), часть которых обладает доказанной канцерогенной активностью. При персистенции в организме онкогенных типов ВПЧ они способны вызывать различные заболевания, самыми опасными из которых являются злокачественные заболевания аногенитальной области. Одной из особенностей ВПЧ является эпителиотропность, в связи с чем вирус не определяется в крови. ВПЧ поражает эпителий слизистой генитального тракта, анального канала, верхних дыхательных путей и полости рта. После прикрепления к клетке, проникновения в ядро, репликации и встраивания вирусной ДНК в ДНК клетки происходит нарушение митохондриального пути апоптоза и процесса дифференцировки и адгезии клеток. При персистенции в организме определенные типы ВПЧ способны вызывать целый спектр заболеваний, включая предраковые заболевания аногенитальной области и рак шейки матки (РШМ), вульвы, влагалища, ануса [1]. По данным Международного агентства по изучению рака (International Agency for Research on Cancer, IARC), ежегодно в мире регистрируется более 500 тыс. новых случаев ВПЧ-ассоциированного РШМ, инцидентность составляет 13,1 на 100 тыс. населения, смертность – 6,9 на 100 тыс. населения [2, 3]. В соответствии с данными Московского научно-исследовательского онкологического института имени П.А. Герцена (2019 г.) [4] в структуре общей онкологической заболеваемости (оба пола) РШМ занимает 2,8%, а в структуре онкологических патологий среди женщин – 5-е место (5,2%) после новообразований молочной железы, кожи, тела матки и ободочной кишки; при этом злокачественные новообразования органов репродуктивной системы имеют наибольший удельный вес (39,1%). Средний возраст пациенток с впервые установленным диагнозом РШМ в России (2018 г.) составляет 52,2 года. Прирост заболеваемости РШМ с 2008 по 2018 гг. составил 24,93%, 22,57 на 100 тыс. человек в 2018 г. против 18,1 на 100 тыс. человек в 2008 г. При отсутствии специфического лечения ВПЧ единственным эффективным методом предотвращения РШМ и других опасных ВПЧ-ассоциированных заболеваний является профилактика инфицирования ВПЧ. В настоящее время в мире для этой цели зарегистрированы и активно применяются три вакцины от ВПЧ: двухвалентная, четырехвалентная и девятивалентная. Максимальная эффективность вакцинации от ВПЧ достигается при вовлечении в программу детей и подростков до полового дебюта. Как правило, первичной целевой группой являются дети и подростки в возрасте 9–14 лет [5, 6].
 Однако в настоящее время изучение распределения типов ВПЧ, участвующих в формировании неопластической трансформации у вакцинированных ранее против ВПЧ женщин, не проводилось.
Однако в настоящее время изучение распределения типов ВПЧ, участвующих в формировании неопластической трансформации у вакцинированных ранее против ВПЧ женщин, не проводилось.
В данной работе мы применяли классификацию IARC, в которой выделены следующие группы ВПЧ: «канцерогенные» (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59), «вероятно, канцерогенные» (68) и «возможно, канцерогенные» (26, 30, 34, 53, 66, 67, 69, 70, 73, 82, 85, 97) (табл. 1) [7–9].
Цель исследования – определить наиболее часто встречаемые типы ВПЧ, участвующие в формировании неопластической трансформации эпителия шейки матки, у вакцинированных от ВПЧ женщин репродуктивного возраста.
Материалы и методы
Был проведен анализ результатов обследования пациентов, обратившихся в Научно-поликлиническое отделение НМИЦ АГП им. академика В.И. Кулакова в 2017–2020 гг. В исследовании приняла участие 141 пациентка, которые были разделены на 3 основные группы: группа 1 – вакцинированные пациентки, получившие все 3 дозы четырехвалентной вакцины (n=62), в возрасте от 19 до 45 лет, средний возраст составлял 31 год, разделенная на 2 подгруппы: 1а – вакцинированные до начала половой жизни (n=26, 41,9%) и 1b – вакцинированные после начала половой жизни (n=36, 58,06%); группа 2 – с плоскоклеточным интраэпителиальным поражением высокой степени (HSIL) (n=42), включающая пациенток с цитологическим диагнозом HSIL, и группа 3 (контрольная группа, n=37 в возрасте от 18 до 45 лет, средний возраст – 31 год), в которую были включены пациентки с цитологическим диагнозом NILM (негативный в отношении дисплазии или рака результат).
Для включения в группу 1а применялись следующие критерии: репродуктивный возраст (18–45 лет), регулярный менструальный цикл, вакцинация от ВПЧ четырехвалентной вакциной (Гардасил) до начала половой жизни – 3 дозы в течение 1 года, время от последней дозы вакцины – минимум 3 года. Для группы 1b: репродуктивный возраст (18–45 лет), регулярный менструальный цикл, вакцинация от ВПЧ четырехвалентной вакциной (Гардасил) после начала половой жизни – 3 дозы в течение 1 года, время от последней дозы вакцины – минимум 3 года.
Критерии включения для группы 2: репродуктивный возраст (18–45 лет), регулярный менструальный цикл, цитологический диагноз HSIL. Для группы 3: репродуктивный возраст (18–45 лет), регулярный менструальный цикл, цитологический диагноз NILM. Критериями исключения для всех групп были: беременность, период лактации, воспалительные заболеваниями специфической и неспецифической этиологии в стадии обострения, нарушение функции почек, печени, легких в стадии декомпенсации и психоневрологические заболевания. Всем пациенткам проводились ВПЧ-типирование (21 тип) и жидкостная цитология.
Молекулярно-генетический метод (генотипирование ВПЧ 21 типа) методом полимеразной цепной реакции в режиме реального времени с оценкой вирусной нагрузки в логарифмах. Классификация выявленных типов ВПЧ проводилась в соответствии с классификацией IARC. Метод забора материала: материал собирался из зоны трансформации с переходной зоной вращательными движениями (5 оборотов) щетки. После сбора материала он помещался в контейнер с консервантом и доставлялся в лабораторию по сбору и хранению биоматериалов ФГБУ «НМИЦ АГП им. академика В.И. Кулакова».
Материал для цитологического исследования (жидкостная цитология) собирался с помощью специальной цервикальной щетки с экто- и эндоцервикальным компонентом Cervex-Brush. Центральная часть щетки вводилась в цервикальный канал, боковые щетинки распределялись на влагалищной части шейки матки. Для сбора материала производились 5 оборотов щетки по часовой стрелке. После сбора материала съемная часть щетки помещалась в стабилизирующий раствор. Результаты цитологического исследования оценивались в соответствии с классификацией Бетесда [10].
Статистический анализ
Первичная обработка данных выполнялась с использованием пакета OpenOffice®, STATISTICA. Категориальные данные описывались с использованием абсолютного числа (N) и процентных долей от общего числа пациентов в группе (P) в виде N (P%). Для сопоставления двух групп по категориальным признакам использовался критерий согласия χ2 Пирсона с принятым критическим значением p<0,05.
Результаты и обсуждение
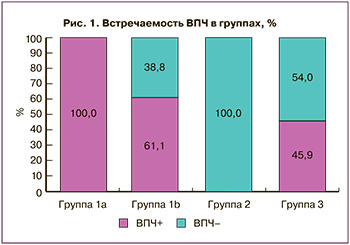 Все пациентки подгруппы 1a были ВПЧ-отрицательными (рис. 1). По данным цитологического исследования в группе вакцинированных ни в одном случае не было выявлено патологии шейки матки. В подгруппе 1b ВПЧ определялся у 14 пациенток (38,8%). У 8 (22,2%) пациенток были выявлены ВПЧ группы 1 («канцерогенные»): у 2 пациенток – ВПЧ А9 (ВПЧ 16), у 6 – ВПЧ А6 (ВПЧ 56), у 2 – ВПЧ А5 (ВПЧ 51). У 4 (11,1%) пациенток были выявлены ВПЧ группы 2В («возможно, канцерогенные»): у 2 (5,5%%) – ВПЧ А6 (ВПЧ 53), у 2 – ВПЧ А11 (ВПЧ 73). Следует отметить, что у 2 пациенток был выявлен ВПЧ 16 – вакцинальный тип.
Все пациентки подгруппы 1a были ВПЧ-отрицательными (рис. 1). По данным цитологического исследования в группе вакцинированных ни в одном случае не было выявлено патологии шейки матки. В подгруппе 1b ВПЧ определялся у 14 пациенток (38,8%). У 8 (22,2%) пациенток были выявлены ВПЧ группы 1 («канцерогенные»): у 2 пациенток – ВПЧ А9 (ВПЧ 16), у 6 – ВПЧ А6 (ВПЧ 56), у 2 – ВПЧ А5 (ВПЧ 51). У 4 (11,1%) пациенток были выявлены ВПЧ группы 2В («возможно, канцерогенные»): у 2 (5,5%%) – ВПЧ А6 (ВПЧ 53), у 2 – ВПЧ А11 (ВПЧ 73). Следует отметить, что у 2 пациенток был выявлен ВПЧ 16 – вакцинальный тип.
Все пациентки группы 2 (HSIL) были ВПЧ-положительными, при этом ВПЧ группы 1 встречался у 42 (100%) пациенток: у 31 (73,8%) были выявлены ВПЧ А9, в 6 (14,2%) случаях выявлялся ВПЧ А7, в 2 (4,7%) – А6, в 3 (7,1%) – А5. ВПЧ группы 2А («вероятно, канцерогенные») был выявлен у 3 (7,1%) пациенток; в 1 (2,4%) случае – ВПЧ группы 2В.
В группе NILM 20 пациенток (54%) были ВПЧ-положительными. ВПЧ группы 1 определялся у 18 (48,6%) пациенток: у 16 (43,2%) – ВПЧ А9 (у 7 (18,9%) – ВПЧ 16, у 5 (13,5%) – ВПЧ 31, у 3 (8,1%) – ВПЧ 35, у 1 (2,7%) – ВПЧ 52), в 8 (21,6%) случаях был выявлен ВПЧ А7 (у 2 (5,4%) – ВПЧ 18, у 4 (10,8%) – ВПЧ 39, у 2 (5,4%) – ВПЧ 45), в 4 (10,8%) случаях определялся ВПЧ А6 (ВПЧ 56), ВПЧ А5 (ВПЧ 51) также встречался в 4 случаях (10,8%).
ВПЧ-положительными были 76 из 141 (53,9%) пациентки. ВПЧ-положительными были 100% пациенток в группе HSIL, 54% – в группе NILM и 22,5% – в группе вакцинированных (38,8% – в подгруппе вакцинированных после начала половой жизни и 0% – в подгруппе вакцинированных до начала половой жизни).
В исследовании M. Paz-Zulueta et al. [11] показано, что в общей популяции встречаемость ВПЧ высокого риска (у невакцинированных) составляет 38,49%. Результаты исследования демонстрируют отсутствие перекрестной защиты.
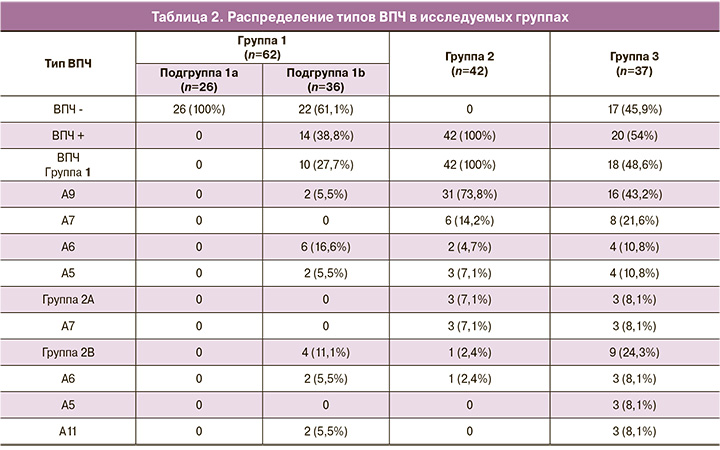
ВПЧ группы 1 («канцерогенные») были выявлены в 10 случаях в группе вакцинированных (все – в подгруппе вакцинированных после начала половой жизни), в 42 случаях – в группе HSIL и в 18 случаях – в группе NILM. ВПЧ группы 1 статистически значимо ниже встречались в группе 1b (22,2%), чем в группе 2 (100%; р<0,001) и группе 3 (48,6%; p=0,027; p<0,05).
В исследовании E. Jeannot et al. [12] приняли участие 409 женщин в возрасте 18–31 года, 69% из которых были вакцинированы четырехвалентной вакциной. ВПЧ 16 или 18 типов был выявлен у 7,2% невакцинированных пациенток, в группе вакцинированных – у 1,1%. При этом исследователи не обнаружили статистически значимых данных относительно перекрестной защиты от других типов ВПЧ. 28% вакцинированных пациенток получили не все 3 дозы вакцины. В исследовании не проводилось разделение на вакцинированных до и после начала половой жизни. Полученные нами результаты свидетельствуют об индукции вакцины нейтрализующих антител в отношении типов ВПЧ филогенетической принадлежности групп А9 и А7 у вакцинированных женщин.
ВПЧ группы 2А («вероятно, канцерогенные») в обеих подгруппах вакцинированных пациенток не были выявлены, в группе HSIL данные типы встречались в 3 случаях (7,1%), в группе NILM – в 3 случаях (8,1%).
ВПЧ группы 2В («возможно, канцерогенные») были выявлены в 4 случаях в группе вакцинированных пациенток (все – в подгруппе вакцинированных после начала половой жизни); в группе HSIL – в 1 случае (статистически значимых отличий от группы вакцинированных не выявлено: p=0,17; p>0,05), в группе NILM – в 9 случаях (статистическая связь не выявлена: p= 0,22; p>0,05).
ВПЧ группы А9 статистически значимо реже встречался в подгруппе 1b (5,5%), чем в группе 2 (HSIL) (73,8%) (p<0,001), А7 – не встречался в группе вакцинированных.
ВПЧ вакцинальных типов встречались статистически значимо реже (6,4%) в группе 1, чем в группе 3 (29,7%) (p=0,003; p<0,05).
В исследовании H. Shilling et al. [13] приняли участие 362 пациентки, из которых 65,6% получили все три дозы вакцины, 9,8% – менее трех, 24,7% – не были вакцинированы. Распространенность четырех вакцинальных типов (6, 11, 16, 18) составила 6,4%, вне зависимости от статуса вакцинации. Распространенность вакцинальных типов в подгруппе вакцинированных после начала половой жизни в нашей работе составила 11,1%.
В группе 1 (вакцинированные) самым часто встречаемым типом ВПЧ являлся ВПЧ 56 (9,6%), в группах 2 и 3 – ВПЧ 16 (69% в группе 2 и 18,9% в группе 3).
ВПЧ высокого риска по классификации IARC (филогенетических групп А9: 16, 18, 31, 33, 35, 52, 58; А7: 39, 45; А5: 51, А6: 56) были выявлены в 10 случаях (27,7%) в группе вакцинированных пациенток, в то время как в группе HSIL ВПЧ высокого онкогенного риска определялись в 42 случаях (100%) (табл. 2). Частота встречаемости ВПЧ высокого онкогенного риска была статистически значимо ниже в группе вакцинированных пациенток (p<0,001).
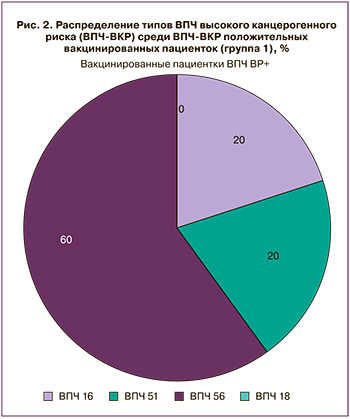
ВПЧ высокого канцерогенного риска невакцинальных типов (не-ВПЧ 16/18) в группе вакцинированных пациенток были выявлены в 8 случаях (12,9%). В группе HSIL ВПЧ высокого риска невакцинальных типов были выявлены в 22 случаях (52,4%). Частота встречаемости ВПЧ высокого канцерогенного риска невакцинальных типов была статистически значимо реже в группе вакцинированных, чем в группе HSIL (p<0,001). Среди вакцинированных пациенток с ВПЧ высокого канцерогенного риска встречаемость невакцинальных типов составила 80% (8 из 10 пациенток): 60% – ВПЧ 51, 20% – ВПЧ 56 (рис. 2).
 ВПЧ высокого канцерогенного риска среди вакцинированных пациенток встречался статистически значимо реже, чем в группе NILM (p<0,001).
ВПЧ высокого канцерогенного риска среди вакцинированных пациенток встречался статистически значимо реже, чем в группе NILM (p<0,001).
Полученные нами данные позволяют предположить, что среди вакцинированных пациенток другие типы ВПЧ высокого канцерогенного риска (А6 ВПЧ 56 тип (9,6%), А5 ВПЧ 51 тип (3,2%)) замещают преобладающий в общей популяции ВПЧ 16 типа.
До настоящего времени ВПЧ генотипирование (21 тип) у вакцинированных женщин не проводилось. Как правило, проводится оценка вакцинальных типов [11, 12]. Помимо этого, низкие показатели эффективности вакцин от ВПЧ в предотвращении цервикальной интраэпителиальной неоплазии (CIN) 3+ в некоторых исследованиях связаны с отсутствием разделения на группы вакцинированных до и после начала половой жизни [14]. Несмотря на то что двухдозовая схема вакцинации была утверждена для некоторых стран в 2014 г. стратегической консультативной группой экспертов ВОЗ по вакцинации для девочек в возрасте до 15 лет [15], данные о концентрации антител против ВПЧ 16 и 18 после двух доз вакцины получены только за период 2 года после момента вакцинации [16]. В нашем исследовании все пациентки из группы вакцинированных пациенток получили все три дозы четырехвалентной вакцины.
Таким образом, полученные нами результаты демонстрируют эффективную защиту вакцинации против инфицирования и возникновения предраковых заболеваний шейки матки, обусловленных генотипами ВПЧ, входящими в состав вакцины и не входящими в ее состав в виде перекрестной защиты (филогенетическая группа А9 и А7). Следует также отметить, что ВПЧ группы 2В («возможно, канцерогенные») определялись в основном в группе вакцинированных пациенток, и не исключено их участие в формировании неопластического процесса шейки матки.
Заключение
ВПЧ-положительными в группе HSIL были 100%, в группе NILM – 54%, в группе вакцинированных – 22,5% (38,8% – в подгруппе вакцинированных после начала половой жизни и 0% – в подгруппе вакцинированных до начала половой жизни). Вакцинальные типы ВПЧ определялись статистически значимо реже в группе вакцинированных пациенток – у 6,4% по сравнению с группой NILM (29,7%) (p=0,003; p<0,05). ВПЧ 1-й группы (канцерогенные) филогенетической принадлежности групп А9 и А7 статистически значимо реже встречались в 1-й группе (вакцинированные) женщин по сравнению с невакцинированными пациентками 2-й и 3-й групп. В группе вакцинированных пациенток самым часто встречаемым типом ВПЧ являлся ВПЧ 56 (9,6%), в группах 2 и 3 – ВПЧ 16 (69% и 18,9% соответственно).



