1) ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России, Москва, Россия;
2) НИИ КО ФГБУ «Национальный медицинский исследовательский центр онкологии имени Н.Н. Блохина» Минздрава России, отделение химиотерапии гемобластозов, Москва, Россия
Цель: Оценить состояние овариального резерва у пациенток с лимфомой Ходжкина и неходжкинскими лимфомами после завершения полихимиотерапии (ПХТ), установить факторы, влияющие на восстановление/потерю репродуктивной функции, и определить долгосрочные перспективы функционирования репродуктивной системы.
Материалы и методы: Проконсультированы и пролечены 247 пациенток с лимфопролиферативными заболеваниями, включавшими лимфому Ходжкина и неходжкинские лимфомы. Среди пациенток с лимфопролиферативными заболеваниями были отслежены исходы лечения и проведено разделение на группы: I (n=194) – восстановившие менструальный цикл после завершения лечения, II (n=53) – с диагностированной преждевременной недостаточностью яичников.
Была проведена оценка анамнестических, клинических и репродуктивных характеристик пациенток. Сравнивали состояние овариального резерва по концентрациям антимюллерова и фолликулостимулирующего гормонов, числу антральных фолликулов в яичниках до проведения ПХТ и после ее завершения. Проводили сравнительную оценку указанных параметров между группами пациенток, восстановивших и не восстановивших менструальный цикл после завершения лечения.
Результаты: Частота восстановления менструального цикла среди пациенток с лимфомой Ходжкина составила 79,68%, потеря функции яичников – 20,32%; среди больных с неходжкинскими лимфомами – 75 и 25% соответственно. Восстановление менструального цикла происходит в среднем через 3 месяца после завершения химиотерапии при обоих типах лимфопролиферативных заболеваний. 149 (60,32%) женщин, планирующих беременность, забеременели и 46,56% (115) родили здоровых детей. Прогностическими факторами восстановления менструального цикла после завершения лечения явились возраст женщины моложе 28,5 года и уровень антимюллерова гормона выше 2,45 нг/мл. ПХТ оказывает негативное влияние на функцию яичников; в 2 раза, по сравнению с исходными значениями, снижаются показатели овариального резерва, что прогнозирует преждевременное истощение функции яичников в течение 2,5–10 лет в зависимости от исходных параметров овариального резерва.
Заключение: Необходимо определять исходное состояние овариального резерва у молодых женщин с диагностированной лимфомой при планировании ПХТ с целью прогноза восстановления или потери репродуктивной функции после завершения лечения. Пациенткам с исходно сниженными показателями овариального резерва и женщинам, которым назначается высокодозная ПХТ, целесообразно провести предварительный забор и криоконсервацию ооцитов/эмбрионов вследствие высокого риска резкого снижения и потери функции яичников.
Вклад авторов: Бирюкова А.М. – сбор и обработка материала, проверка критически важного содержания; Антух И.Е. – обзор литературы по теме статьи, концепция и дизайн исследования, сбор и обработка материала, написание текста, редактирование статьи; Назаренко Т.А. – концепция и дизайн исследования, редактирование статьи, проверка критически важного содержания, одобрение окончательной версии статьи; Хохлова С.В. – сбор и обработка материала, проверка критически важного содержания, одобрение окончательной версии статьи; Мартиросян Я.О. – обзор литературы по теме статьи, написание текста, редактирование статьи, проверка критически важного содержания; Тумян Г.С. – концепция и дизайн исследования, одобрение окончательной версии статьи; Шпирко В.О. – обзор литературы по теме статьи, сбор и обработка материала.
Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов.
Финансирование: Работа выполнена без спонсорской поддержки.
Одобрение Этического комитета: Исследование было одобрено локальным Этическим комитетом ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Согласие пациентов на публикацию: Пациенты подписали информированное согласие на публикацию своих данных.
Обмен исследовательскими данными: Данные, подтверждающие выводы этого исследования, доступны по запросу у автора, ответственного за переписку, после одобрения ведущим исследователем.
Для цитирования: Бирюкова А.М., Антух И.Е., Назаренко Т.А., Хохлова С.В., Мартиросян Я.О., Тумян Г.С., Шпирко В.О.
Репродуктивная функция пациенток с лимфопролиферативными заболеваниями
после завершения химиотерапевтического лечения.
Акушерство и гинекология. 2023; 7: 66-73
https://dx.doi.org/10.18565/aig.2023.79
лимфома Ходжкина
неходжкинские лимфомы
сохранение репродуктивной функции
Новое мультидисциплинарное направление в медицине – онкофертильность – обеспечивает сохранение и возможность реализации репродуктивной функции онкологическими больными. На сегодняшний день этот вопрос находится в фокусе пристального внимания и изучения врачей и исследователей и становится все более востребованным для молодых пациентов, заболевших раком [1–4]. Среди обращающихся больных лимфопролиферативные заболевания – лимфома Ходжкина и неходжкинские лимфомы – занимают ведущее место, уступая по частоте встречаемости раку молочной железы [5, 6]. Полихимиотерапия (ПХТ) является основным методом лечения у этой категории больных, что обеспечивает, с одной стороны, высокую вероятность излечения заболевания, с другой – значительный риск резкого снижения и потери репродуктивной функции [7–10]. Большинство специалистов считают, что восстановление/потеря репродуктивной функции зависят от возраста пациентки, состояния овариального резерва на момент заболевания, стадии заболевания, степени гонадотоксичности лечения, репродуктивных планов пациентки после завершения лечения. Учеными отмечено, что у пациенток с лимфомой Ходжкина старше 35 лет уровень антимюллерова гормона (АМГ) через год после ПХТ восстанавливался не более чем на 37% первоначальных значений [11]. У пациенток, перенесших высокогонадотоксичные схемы лечения, в 70% случаев уровень АМГ становится ниже определяемой границы в течение 3 лет [12, 13]. Откладывание беременности, в свою очередь, снижает репродуктивные возможности женщины.
Несмотря на имеющиеся в литературе сведения, не созданы модели, использование которых позволило бы оценить и прогнозировать состояние овариального резерва после окончания лечения и выбрать оптимальную тактику для сохранения репродуктивной функции или репродуктивного материала у молодых женщин, заболевших лимфопролиферативными заболеваниями.
Цель исследования: оценить состояние овариального резерва у пациенток с лимфомой Ходжкина и неходжкинскими лимфомами после завершения ПХТ, установить факторы, влияющие на восстановление/потерю репродуктивной функции и определить долгосрочные перспективы функционирования репродуктивной системы.
Материалы и методы
Были обследованы 247 пациенток с гемобластозами; из них 187/247 (75,7%) женщин – с лимфомами Ходжкина и 60/247 (24,3%) – с неходжкинскими лимфомами. Средний возраст пациенток составил 23,69±6,6 года. Распределение больных с лимфомой Ходжкина по стадиям заболевания представлено на рисунке 1.
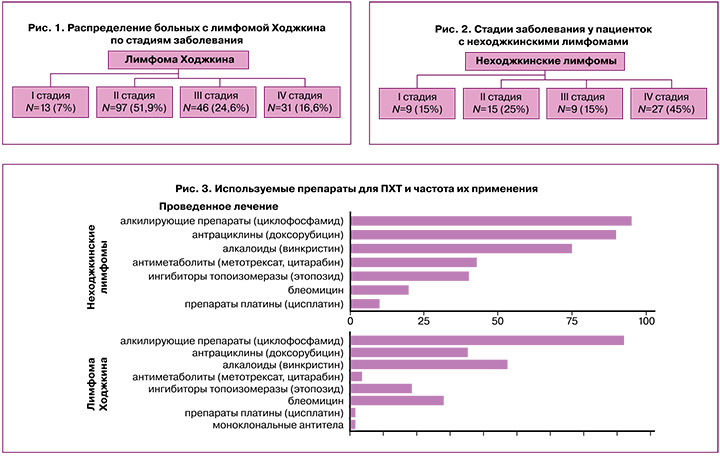
На рисунке 2 представлено распределение по стадиям заболевания пациенток с неходжкинскими лимфомами.
Все пациентки получали ПХТ, используемые препараты и частота их применения представлены на рисунке 3.
Высокодозная ПХТ с высокой степенью гонадотоксичности и последующей трансплантацией гемопоэтических стволовых клеток проведена 33 пациенткам. Ятрогенная потеря репродуктивной функции зафиксирована в 100% случаев.
Была проведена оценка анамнестических, клинических и репродуктивных характеристик пациенток. Сравнивали состояние овариального резерва по концентрациям АМГ, фолликулостимулирующего гормона (ФСГ), числу антральных фолликулов в яичниках до проведения ПХТ и после ее завершения. Проводили сравнительную оценку указанных параметров между группами пациенток, восстановивших и не восстановивших менструальный цикл после завершения лечения. Оценивали наличие овуляции при восстановлении менструального цикла и частоту беременностей среди тех пациенток, которые были заинтересованы в беременности.
Статистический анализ
Для статистического анализа и построения графиков использовали пакет статистических программ GraphPad Prism (GraphPad Software, США). Для определения нормальности распределения использовали обобщенный тест Д'Агостино–Пирсона. Параметрические данные представлены как среднее значение (стандартное отклонение), для их сравнения использовали t-test. Непараметрические данные представлены как медиана (интерквартильный размах), для их сравнения использовали критерий Манна–Уитни. Качественные данные представлены как абсолютное значение (n) и %, для их сравнения использовали точный тест Фишера. Различия считали статистически значимыми при p<0,05.
Результаты
ПХТ пациенткам проведена онкогематологами согласно имеющимся стандартам; но среди стандартных схем существует вариабельность использования отдельных препаратов. Учитывая этот факт, с целью удобства расчета было принято решение присвоить условные баллы режимам химиотерапии на основании существующих литературных научных данных о степени гонадотоксичности каждого препарата [14–16]. Каждый препарат в используемом режиме химиотерапии соответствовал условному количеству баллов. Таким образом, различным режимам химиотерапии было присвоено от 0 до 5 баллов, что позволило выделить 3 степени гонадотоксичности используемых препаратов: 0–1 – низкая, 2–3 – умеренная, 4–5 – высокая. Пациентки получали от 3 до 20 курсов ПХТ с суммарной условной токсичностью до 45 баллов за весь период лечения (в среднем 14,68 балла для неходжкинских лимфом и 23,65 балла для лимфомы Ходжкина). У 194/247 (78,5%) женщин после окончания лечения восстановился менструальный цикл, у 53/247 (21,5%) пациенток диагностирована аменорея. Средний период восстановления менструального цикла составил 3 месяца. Из 247 женщин, планирующих беременность, 149 (60,32%) забеременели и 115 (46,56%) родили здоровых детей.
Был проведен сравнительный анализ исходных характеристик пациенток, восстановивших и не восстановивших менструальный цикл после завершения лечения. Эти данные представлены в таблице 1.
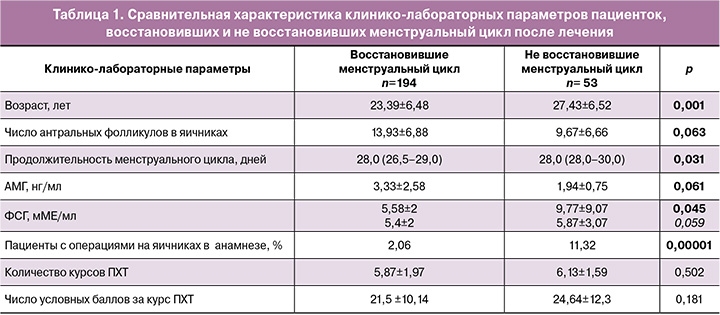
Полученные данные показывают, что достоверная разница обнаружена в исходных показателях овариального резерва, уровнях АМГ и числе антральных фолликулов. Пациентки, не восстановившие менструальный цикл, были старше, хотя и относились к группе женщин активного репродуктивного возраста; также у них был выше исходный уровень ФСГ, ниже значения АМГ и меньшее число антральных фолликулов. Тогда как по степени гонадотоксичности проведенной ПХТ группы не различались.
Было показано, что основными прогностическими факторами восстановления или потери репродуктивной функции после завершения лечения являются возраст пациентки (рис. 4) и уровень АМГ (рис. 5).
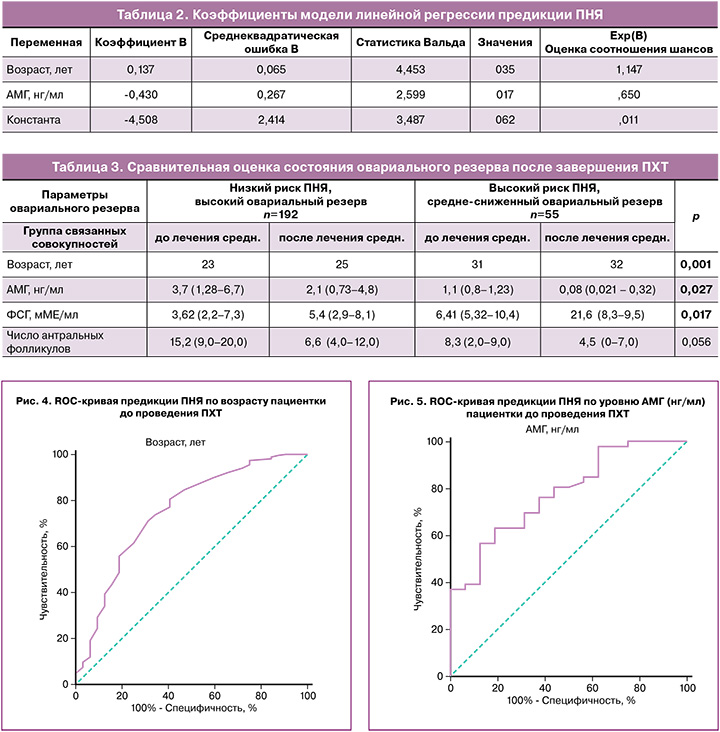
Путем проведения линейной логистической регрессии была разработана модель предикции развития преждевременной недостаточности яичников (ПНЯ) на основании возраста пациентки и уровня АМГ. Переменные в уравнении представлены в таблице 2. Площадь под кривой для данной модели составила 0,833 (95% ДИ 0,720–0,946). При пороге отсечки значения модели менее -1,480 чувствительность составила 65,2%, специфичность – 93,3% (рис. 6).
Полученные данные позволили прогнозировать высокую вероятность потери репродуктивной функции у женщин после проведения ПХТ при исходном возрасте старше 28,5 года и уровне АМГ ниже 2,45 нг/л при умеренной степени гонадотоксичности проводимой терапии.
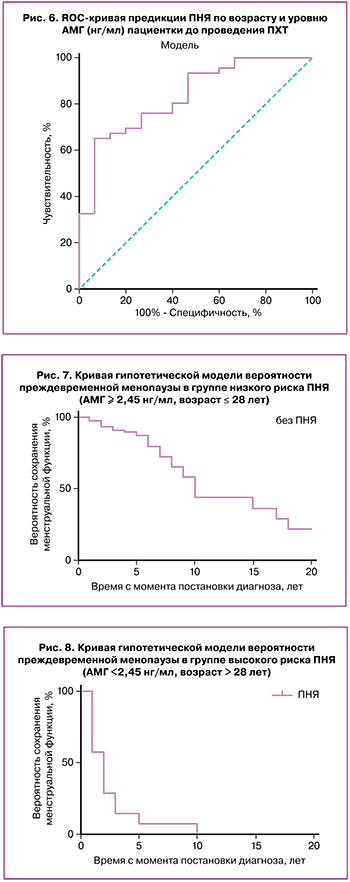
Оценивая влияние проведенной ПХТ на состояние овариального резерва пациенток с восстановившимся менструальным циклом, мы сравнили основные характеристики до и после проведенной терапии. Эти данные представлены в таблице 3.
Представленные данные показали снижение овариального резерва у пациенток как с низким, так и с высоким исходным состоянием резерва. Значения АМГ снизились практически в 2 раза, повысились уровни ФСГ, более чем в 2 раза уменьшилось число антральных фолликулов в яичниках, хотя возраст пациенток относился к активному репродуктивному.
Полученные данные позволили прогнозировать потерю или резкое снижение репродуктивной функции у пациенток, перенесших химиотерапевтическое лечение в течение 2,5–10 лет. При этом при исходно сниженных показателях овариального резерва этот период может соответствовать 2,5–5 годам, а при исходно высоком овариальном резерве – 7–10 годам (рис. 7, 8).
Обсуждение
Несомненен интерес специалистов к вопросам сохранения и реализации репродуктивной функции молодых женщин, заболевших раком. В структуре онкологических заболеваний лимфопролиферативные заболевания, в частности лимфома Ходжкина и неходжкинские лимфомы, занимают ведущее место. Характерными особенностями этих заболеваний являются манифестация в молодом и детском возрасте, обязательное химиотерапевтическое лечение, хороший прогноз излечения [6, 17–19]. В этой связи вопросы сохранения репродуктивной функции и деторождения у этого контингента больных являются наиболее актуальными [15, 20]. В настоящем исследовании группа больных с лимфомой Ходжкина и неходжкинскими лимфомами заняла второе место по обращаемости после рака молочной железы, составив 247 пациенток. Все пациентки были молодого возраста – 23,69±6,6 года, у 78,5% из них восстановился менструальный цикл, беременность наступила у 149 из женщин, желающих забеременеть, у 21,5% диагностированы стойкая аменорея и преждевременная недостаточность яичников. Основным вопросом проведенного исследования явилось определение прогностических критериев восстановления/потери репродуктивной функции и влияния ПХТ на состояние овариального резерва пациенток, что позволило бы осуществлять эффективные и научно обоснованные мероприятия, обеспечивающие деторождение у этой группы больных.
В литературе существуют данные, указывающие на значение возраста и исходного состояния овариального резерва на прогноз восстановления репродуктивной функции у пациенток, перенесших ПХТ [21, 22]. Тем не менее не существует убедительных и обоснованных рекомендаций на этот счет. Мы попытались оценить влияние ПХТ на функцию яичников; для унификации результатов ввели балльную оценку степени гонадотоксичности проведенного лечения. По нашим данным, все пациентки получили химиотерапию умеренной степени гонадотоксичности, и восстановление/потеря репродуктивной функции не зависела от вида и длительности лечения у восстановивших и не восстановивших менструальный цикл. В то же время использование высокодозной ПХТ, проведенной у 33 пациенток перед трансплантацией гемопоэтических стволовых клеток, привело к формированию ПНЯ у всех больных. По нашим данным, решающими прогностическими факторами явились возраст больных 28,5 года и уровень АМГ ≥2,45 нг/мл до начала лечения. Мы попытались оценить состояние овариального резерва у пациенток, восстановивших менструальный цикл, до и после терапии. Значения АМГ снизились практически в 2 раза, повысились уровни ФСГ, более чем в 2 раза уменьшилось количество антральных фолликулов в яичниках, хотя возраст пациенток относился к активному репродуктивному. Полученные данные продемонстрировали негативное влияние ПХТ на овариальный резерв пациенток, а математическая модель прогноза функции репродуктивной системы достоверно показала, что у пациенток, имеющих исходно средние/сниженные показатели овариального резерва, потеря или резкое снижение репродуктивной функции может произойти уже через 2,5–5 лет; при изначально высоких показателях овариального резерва этот период может составить 7–10 лет. В литературе есть указания на раннее наступление менопаузы у женщин, перенесших ПХТ [9]. Полученные данные позволяют разработать тактику ведения молодых женщин, заболевших лимфомами и желающих в дальнейшем иметь детей.
Заключение
Необходимо определять исходное состояние овариального резерва у молодых женщин с диагностированной лимфомой при планировании ПХТ с целью прогноза восстановления или потери репродуктивной функции после завершения лечения. Пациенткам с исходно сниженными показателями овариального резерва и женщинам, которым назначается высокодозная ПХТ, целесообразно провести предварительный забор и криоконсервацию ооцитов/эмбрионов вследствие высокого риска резкого снижения и потери функции яичников. ПХТ приводит к снижению овариального резерва у всех пациенток, восстановивших менструальный цикл после завершения лечения; существует риск резкого снижения функции яичников и формирования ПНЯ в течение 2,5–10 лет в зависимости от исходного состояния овариального резерва, что делает целесообразной предварительную криоконсервацию репродуктивного материала тем пациенткам, которые на данный момент не планируют беременность.
- Каприн А.Д., Старинский В.В., Петрова Г.В., ред. Злокачественные новообразования в России в 2018 году (заболеваемость и смертность). М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России; 2019. 250с.
- Siegel R.L., Miller K.D., Jemal A. Cancer statistics, 2019. CA Cancer J. Clin. 2019; 69(1): 7‐34. https//dx.doi.org/10.3322/caac.21551.
- Ruggeri M., Pagan E., Bagnardi V., Bianco N., Gallerani E., Buser K. et al. Fertility concerns, preservation strategies and quality of life in young women with breast cancer: Baseline results from an ongoing prospective cohort study in selected European Centers. Breast. 2019; 47: 85‐92. https//dx.doi.org/10.1016/j.breast.2019.07.001.
- Kreuser E.D., Hetzel W.D., Billia D.O., Thiel E. Gonadal toxicity following cancer therapy in adults: significance, diagnosis, prevention and treatment. Cancer Treat. Rev. 1990; 17(2-3): 169‐75. https//dx.doi.org/10.1016/0305-7372(90)90043-f.
- Smith K.L., Gracia C., Sokalska A., Moore H. Advances in fertility preservation for young women with cancer. Am. Soc. Clin. Oncol. Educ. Book. 2018; 38: 27‐37. https//dx.doi.org/10.1200/EDBK_208301.
- Kim S.S., Donnez J., Barri P., Pellicer A., Patrizio P., Rosenwaks Z. et al.; ISFP Practice Committee. Recommendations for fertility preservation in patients with lymphoma, leukemia, and breast cancer. J. Assist. Reprod. Genet. 2012; 29(6): 465‐8. https//dx.doi.org/10.1007/s10815-012-9786-y.
- Bedaiwy M.A., Abou-Setta A.M., Desai N., Hurd W., Starks D., El-Nashar S.A. et al. Gonadotropin-releasing hormone analog cotreatment for preservation of ovarian function during gonadotoxic chemotherapy: a systematic review and meta-analysis. Fertil. Steril. 2011; 95(3): 906‐14.e144.https//dx.doi.org/10.1016/j.fertnstert.2010.11.017.
- Martinez F.; International Society for Fertility Preservation–ESHRE–ASRM Expert Working Group. Update on fertility preservation from the Barcelona International Society for Fertility Preservation-ESHRE-ASRM 2015 expert meeting: indications, results and future perspectives. Fertil. Steril. 2017; 108(3): 407‐15.e11. https//dx.doi.org/10.1016/j.fertnstert.2017.05.024.
- Sutcliffe S.B. Cytotoxic chemotherapy and gonadal function in patients with Hodgkin's disease. Facts and thoughts. JAMA. 1979; 242(17): 1898-9.
- Behringer K., Wildt L., Mueller H., Mattle V., Ganitis P., van den Hoonaard B. et al. No protection of the ovarian follicle pool with the use of GnRH-analogues or oral contraceptives in young women treated with escalated BEACOPP for advanced-stage Hodgkin lymphoma. Final results of a phase II trial from the German Hodgkin Study Group. Ann. Oncol. 2010; 21(10): 2052‐60.https//dx.doi.org/10.1093/annonc/mdq066.
- Fréour T., Barrière P., Masson D. Anti-müllerian hormone levels and evolution in women of reproductive age with breast cancer treated with chemotherapy. Eur. J. Cancer. 2017; 74: 1‐8. https//dx.doi.org/10.1016/j.ejca.2016.12.008.
- Behringer K., Thielen I., Mueller H., Goergen H., Eibl A.D., Rosenbrock J. et al. Fertility and gonadal function in female survivors after treatment of early unfavorable Hodgkin lymphoma (HL) within the German Hodgkin Study Group HD14 trial. Ann. Oncol. 2012; 23(7): 1818‐25.https//dx.doi.org/10.1093/annonc/mdr575.
- Tan S.J., Lee L.J., Tzeng C.R., Wang C.W., Hsu M.I., Chen C.H. Targeted anti-apoptosis activity for ovarian protection against chemotherapy-induced ovarian gonadotoxicity. Reprod. Biomed. Online. 2014; 29(5): 612‐20.https//dx.doi.org/10.1016/j.rbmo.2014.07.014.
- Paluch-Shimon S., Cardoso F., Partridge A.H., Abulkhair O., Azim H. Jr, Bianchi-Micheli G. et al. ESO-ESMO 4th International Consensus Guidelines for Breast Cancer in Young Women (BCY4). Ann. Oncol. 2020; 31(6): 674-96.https//dx.doi.org/10.1016/j.annonc.2020.03.284.
- Blumenfeld Z., Avivi I., Linn S., Epelbaum R., Ben-Shahar M., Haim N. Prevention of irreversible chemotherapy-induced ovarian damage in young women with lymphoma by a gonadotrophin-releasing hormone agonist in parallel to chemotherapy. Hum. Reprod. 1996; 11(8): 1620‐6.https//dx.doi.org/10.1093/oxfordjournals.humrep.a019457.
- Ассоциация онкологов России. Клинические рекомендации. Рак молочной железы. 2017.
- Peccatori F.A., Azim H.A. Jr, Orecchia R., Hoekstra H.J., Pavlidis N., Kesic V. et al. Cancer, pregnancy and fertility: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol. 2013; 24(Suppl. 6): vi160‐70. https//dx.doi.org/10.1093/annonc/mdt199.
- Blumenfeld Z., Dann E. GnRH agonist for the prevention of chemotherapy-induced ovarian failure in lymphoma. J. Clin. Oncol. 2013; 31(29): 3721.https//dx.doi.org/10.1200/JCO.2012.47.8222.
- Demeestere I., Brice P., Peccatori F.A., Kentos A., Dupuis J., Zachee P. et al. No evidence for the benefit of gonadotropin-releasing hormone agonist in preserving ovarian function and fertility in lymphoma survivors treated with ghemotherapy: final long-term report of a prospective randomized trial. J. Clin. Oncol. 2016; 34(22): 2568‐74. https//dx.doi.org/10.1200/JCO.2015.65.8864.
- von Wolff M., Germeyer A., Liebenthron J., Korell M., Nawroth F. Practical recommendations for fertility preservation in women by the FertiPROTEKT network. Part II: fertility preservation techniques. Arch. Gynecol. Obstet. 2018; 297(1): 257‐67. https//dx.doi.org/10.1007/s00404-017-4595-2.
- Behringer K., Breuer K., Reineke T., May M., Nogova L., Klimm B. et al. Secondary amenorrhea after Hodgkin's lymphoma is influenced by age at treatment, stage of disease, chemotherapy regimen, and the use of oral contraceptives during therapy: a report from the German Hodgkin's Lymphoma Study Group. J. Clin. Oncol. 2005; 23(30): 7555‐64. https//dx.doi.org/10.1200/JCO.2005.08.138.
- Bildik G., Akin N., Senbabaoglu F., Sahin G.N., Karahuseyinoglu S., Ince U. et al. GnRH agonist leuprolide acetate does not confer any protection against ovarian damage induced by chemotherapy and radiation in vitro. Hum. Reprod. 2015; 30(12): 2912‐25. https//dx.doi.org/10.1093/humrep/dev257.
Поступила 28.03.2023
Принята в печать 04.05.2023
Бирюкова Альмина Михайловна, к.м.н., заведующая по клинической работе НОЦ ВРТ с клиническим отделением им. Фредерика Паулсена, НМИЦ АГП им.
В.И. Кулакова» Минздрава России,
a_birukova@oparina4.ru, 117997, Россия, Москва, ул. Академика Опарина, д. 4.
Антух Ирина Евгеньевна, аспирантка НОЦ ВРТ с клиническим отделением им. Фредерика Паулсена, НМИЦ АГП им. В.И. Кулакова Минздрава России,
+7(916)089-08-09,
nika06@inbox.ru, 117997, Россия, Москва, ул. Академика Опарина, д. 4.
Назаренко Татьяна Алексеевна, д.м.н., профессор, заведующая отделением НОЦ ВРТ с клиническим отделением им. Фредерика Паулсена, директор Института репродуктивной медицины, НМИЦ АГП им. В.И. Кулакова Минздрава России,
t_nazarenko@oparina4.ru, 117997, Россия, Москва, ул. Академика Опарина, д. 4.
Хохлова Светлана Викторовна, д.м.н., заведующая отделением противоопухолевой лекарственной терапии, НМИЦ АГП им. В.И. Кулакова Минздрава России,
s_hohlova@oparina4.ru, 117997, Россия, Москва, ул. Академика Опарина, д. 4.
Мартиросян Яна Ованнесовна, к.м.н., н.с. НОЦ ВРТ с клиническим отделением им. Фредерика Паулсена, НМИЦ АГП им. В.И. Кулакова Минздрава России,
+7(925)124-99-99,
ya_martirosyan@oparina4.ru, 117997, Россия, Москва, ул. Академика Опарина, д. 4.
Тумян Гаяне Сепуговна, д.м.н., заведующая отделением химиотерапии гемобластозов, НИИ КО ФГБУ НМИЦ онкологии имени Н.Н. Блохина Минздрава России,
115522, Россия, Москва, Каширское шоссе, д. 24.
Шпирко Валерия Олеговна, врач-онколог отделения химиотерапии гемобластозов, НИИ КО ФГБУ НМИЦ онкологии имени Н.Н. Блохина Минздрава России,
115522, Россия, Москва, Каширское шоссе, д. 24.







