В структуре онкологических заболеваний у женщин 30–59 лет рак тела матки (РТМ) занимает 5,3%, что составляет значительную долю среди всех онкологических болезней; при этом существенная часть больных находится в репродуктивном возрасте [1]. Если ранее у пациенток с начальными формами РТМ не было альтернативы, кроме гистерэктомии, а в некоторых случаях – пангистерэктомии, то в последнее время, при отсутствии инвазии в миометрий по данным магнитно-резонансной томографии (МРТ), онкогинекологи успешно используют органосохраняющую [2] – так называемую «самостоятельную» (т.е. проводящуюся амбулаторно) гормонотерапию, что позволяет пациенткам реализовать репродуктивную функцию после достижения стойкой ремиссии [3]. Вместе с тем в практических рекомендациях Российского общества клинической онкологии сказано, что наиболее эффективным методом лечения РТМ, независимо от стадии, следует считать хирургический [4], а у молодых больных с начальным высокодифференцированным РТМ возможно органосохраняющее лечение, которое следует проводить в учреждениях, имеющих такой опыт [5].
Клиническая практика показывает, что в последнее время молодым женщинам, больным РТМ I стадии без инвазии в миометрий, онкогинекологи назначают консервативное лечение, имеющее целью достижение атрофии эндометрия, ликвидацию очагов атипических клеток за счет локальной и общей гипоэстрогении. Срок лечения, как правило, составляет от 6 до 12 месяцев, в большинстве случаев лечение оказывается успешным, и онкологи разрешают женщине беременеть. Вместе с тем терапия онкологических заболеваний матки требует унификации и объективизации. Онкологи используют различные схемы лечения: монотерапия агонистами гонадотропин-рилизинг-гормона (ГнРГ) или медроксипрогестероном, левоноргестрел-содержащая внутриматочная спираль (ВМС) или сочетание этих препаратов. Также назначают антиэстрогены как в качестве монотерапии, так и в сочетании с вышеописанными препаратами [6]. Эффективность различных видов лечения и частота рецидивов в литературе освещены недостаточно.
Преследуя цель сохранить репродуктивную функцию, зачастую перед назначением консервативной терапии онкологи не учитывают репродуктивные возможности пациентки, ее способность к беременности как самостоятельно, так и при использовании методов вспомогательной репродукции. Более того, в доступной литературе отсутствуют обобщенные сведения о состоянии репродуктивной системы молодых женщин, заболевших раком, тактике ведения с целью сохранения их репродуктивной функции, времени восстановления имплантационных свойств эндометрия после проведенной терапии; а именно компетентность эндометрия является необходимым условием для успешной имплантации и развития беременности.
Отсутствие достаточной информации побудило нас поделиться первым опытом лечения пациенток, имеющих рак или атипическую гиперплазию эндометрия и желающих сохранить репродуктивный материал для отсроченного деторождения или реализовать репродуктивную функцию после завершения лечения.
Цель исследования: определить наиболее эффективный способ достижения беременности у пациенток, имеющих начальные формы рака эндометрия в анамнезе.
Материалы и методы
Пациентки с диагнозом «рак эндометрия» или «атипическая гиперплазия» были направлены онкогинекологом для решения вопроса либо о предварительной консервации репродуктивного материала перед лечением заболевания, либо о реализации репродуктивной функции при достижении ремиссии основного заболевания. Критериями включения были: репродуктивный возраст пациенток, сохраненный овариальный резерв, отсутствие инвазии в миометрий по результатам МРТ, подписанное информированное согласие, заключение онкогинеколога об отсутствии противопоказаний к программам вспомогательных репродуктивных технологий, желание пациенток реализовать репродуктивную функцию.
Особенностью явилось то, что решение следовало принять уже при первой консультации больных и времени на предварительное обследование пациенток не предоставлялось. Всего в период с октября 2018 г. по август 2019 г. на консультацию были направлены 77 пациенток в возрасте от 25 до 50 лет, средний возраст составил 36,6 (2,8) года. РТМ I стадии выявлен у 48 женщин, атипическая гиперплазия эндометрия – у 29 пациенток. После оценки состояния репродуктивной системы у 8 пациенток вследствие позднего возраста и резкого снижения показателей овариального резерва были признаны нецелесообразными предварительная консервация репродуктивного материала или проведение программ, направленных на реализацию репродуктивной функции после окончания лечения. 11 женщинам в возрасте от 24 до 36 лет были рекомендованы лечение основного заболевания, повторная консультация после его завершения и достижения стойкой ремиссии. Подобное решение обусловлено следующими аргументами: молодой возраст, поликистозные яичники по данным ультразвукового исследования и высокие показатели овариального резерва, выраженные эндокринно-метаболические нарушения, отсутствие полового партнера, ориентированность на отсроченное деторождение. Всего программы ЭКО проведены у 41 женщины; у 4 – стимуляция овуляции, забор и криоконсервация ооцитов/эмбрионов для отсроченной реализации репродуктивной функции, после чего начата терапия основного заболевания; у 4 женщин произведена стимуляция овуляции с последующим забором и криоконсервацией репродуктивного материала в процессе лечения. У 31 пациентки проведена программа ЭКО с переносом эмбриона в «свежем цикле» после завершения лечения онкологического заболевания, у 2 – перенос ранее консервированных эмбрионов.
Проведены стандартная стимуляция овуляции в протоколах с антагонистом ГнРГ, трансвагинальная пункция фолликулов, получение ооцитов, их криоконсервация или оплодотворение, культивирование эмбрионов, криоконсервация эмбрионов, перенос эмбриона в полость матки, криоконсервация оставшихся. В процессе стимуляции яичников осуществляли ультразвуковой и гормональный мониторинг индуцированного цикла.
Статистический анализ
Выполнен ретроспективный и проспективный анализ результатов клинического обследования 77 пациенток, направленных для консультации репродуктолога с диагнозом «рак эндометрия 1 стадии» или «атипическая гиперплазия эндометрия». Проведен статистический анализ полученных результатов. Результаты исследования обрабатывались с использованием пакета статистического анализа для Microsoft Office Excel 2013 и SPSSV22.0. Для определения вида распределения данных перед проведением сравнительного анализа количественных данных в исследуемых группах проводили теcт Колмогорова–Смирнова. Для количественных данных, имеющих нормальное распределение, определяли среднее значение и стандартное отклонение, использовали t-test. Для качественных показателей определяли абсолютные частоты и %, использовали точный тест Фишера. Различия считались статистически значимыми при значении p<0,05.
Результаты исследования и их обсуждение
Оценка данных анамнеза и клинико-лабораторных параметров исследуемых больных
Результаты клинико-лабораторного обследования и анамнестические данные пациенток представлены в таблице 1.
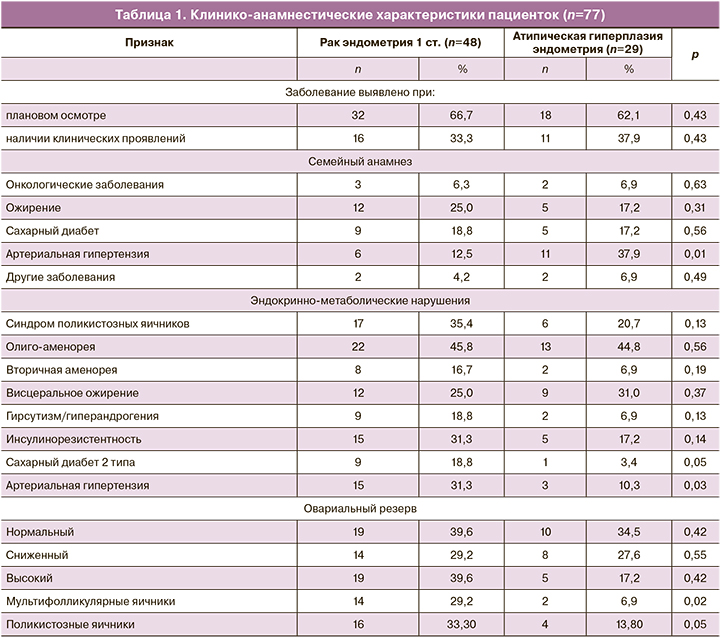
Средний возраст на момент обращения в группе пациенток, больных раком эндометрия 1 стадии, составил 37,2 (1,1) года, тогда как в группе женщин с атипической гиперплазией эндометрия – 36,6 (1,3) года. Сравнение пациенток двух групп показало, что они были абсолютно идентичны по возрасту, анамнестическим характеристикам, состоянию овариального резерва. У 35,4% пациенток, больных раком эндометрия, выявлен синдром поликистозных яичников (СПКЯ), среди женщин 2-й группы – у 20,6%. Более того, в первой группе эндокринно-метаболические нарушения, характерные для СПКЯ, встречались в три раза чаще и имели более тяжелое течение [7]. Известно, что женщины с СПКЯ имеют в 2,7 раза больший риск развития рака эндометрия [8]. Наши наблюдения полностью подтвердили это.
Онкологи расценивают I патогенетический тип рака эндометрия как имеющий благоприятный прогноз выживания при условии гистерэктомии и удаления маточных труб. При этом вопрос о яичниках решается индивидуально в каждом клиническом случае, а порой и интраоперационно [4]. В нашем случае больные лечатся консервативно с той целью, чтобы после успешного завершения лечения реализовать репродуктивную функцию. Вместе с тем, у этой группы больных, имеющих олиго-аменорею, самопроизвольная беременность невозможна ввиду отсутствия овуляции, что диктует необходимость использовать методы вспомогательной репродукции. Во-вторых, наличие СПКЯ, причем в его классическом проявлении, с выраженными эндокринными и метаболическими нарушениями, по всей видимости, будет обеспечивать высокий риск рецидивирования онкологического процесса [7]. Все сказанное требует разработки методов лечения эндокринно-метаболических нарушений у этих больных и профилактики рецидивирования заболевания матки.
Оценка методов лечения онкологического заболевания
Анализ проведенного лечения показывает отсутствие единого подхода к назначению терапии. Хотя все виды лечения привели к желаемому результату – достижению лечебного патоморфоза, обращает внимание высокая частота рецидива рака эндометрия – 33,3%, что, несомненно, подчеркивает необходимость создания единых протоколов лечения, обеспечивающих ремиссию заболевания, снижающих, по возможности, риск рецидивов и сохраняющих ключевые звенья репродуктивной системы.
Анализ лечения, направленного на получение и сохранение репродуктивного материала или реализацию репродуктивной функции исследуемых пациенток
До начала лечения программы ЭКО, направленные на предварительный забор и криоконсервацию репродуктивного материала, были проведены у 4 женщин; средний возраст составил 37,5 (1,2) года. Две из них имели нормальные показатели овариального резерва, у одной овариальный резерв был снижен ввиду позднего репродуктивного возраста, и у одной пациентки диагностирован СПКЯ. Всем пациенткам произведена стимуляция овуляции с последующим забором и криоконсервацией репродуктивного материала для отсроченного деторождения. Доза вводимых гонадотропинов в сутки варьировала от 150 до 300 МЕ, в зависимости от овариального резерва, курсовая доза составила 2154 (178,7) МЕ, преовуляторный уровень эстрадиола – 2950 (158,2) пмоль/л. Произведена криоконсервация: у двух пациенток – 16 и 17 ооцитов соответственно, у пациентки позднего репродуктивного возраста – 1 эмбрион и у пациентки с СПКЯ – 11 эмбрионов. Для снижения уровня эстрадиола после пункции фолликулов назначали антагонист ГнРГ в дозе 0,5 мг в течение 3–4 дней.
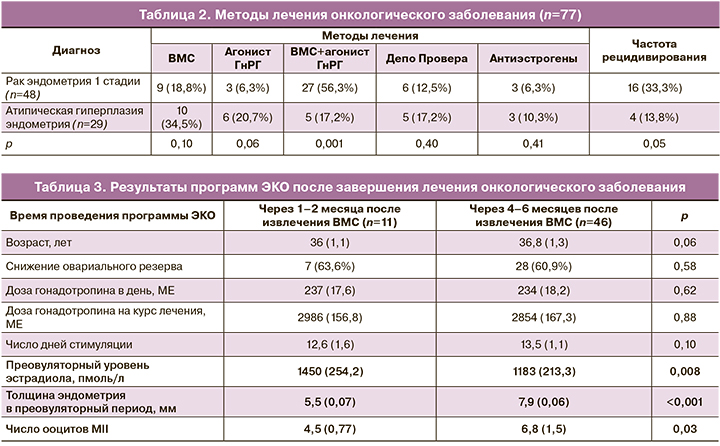
В настоящем исследовании перенос криоконсервированных ранее эмбрионов был произведен 2 пациенткам через 3–6 месяцев после окончания лечения. Наступила одна беременность, эктопическая.
После завершения лечения и достижения лечебного патоморфоза было проведено 57 программ ЭКО с переносом эмбрионов в «свежем» цикле у 31 женщины. Результаты проведенного лечения представлены в таблице 3.
Полученные данные демонстрируют значительно меньшее число полученных ооцитов по сравнению с группой больных, прошедших предварительную криоконсервацию: до лечения – 11,2, через 1–2 месяца – 4,5, через 4–6 месяцев – 6,8. Лучшие результаты было получены у женщин с нормальным овариальным резервом, когда стимуляцию яичников проводили до начала терапии основного заболевания.
Необходимость предварительного забора и криоконсервации ооцитов/эмбрионов у молодых женщин перед проведением гонадотоксичной терапии рака не вызывает сомнения и постулируется в клинических рекомендациях и документах, принятых во многих странах [8]. Гормональная терапия, назначаемая для лечения рака матки и атипической гиперплазии, по существу, не является гонадотоксичной. Тем не менее в настоящем исследовании, несмотря на небольшой клинический материал, представлена отчетливая тенденция к снижению числа зрелых ооцитов при проведении стимуляции в первых циклах после извлечения ВМС, что говорит о необходимом времени для восстановления репродуктивной системы после гормонального лечения. В этой связи мы считаем полезным произвести предварительную криоконсервацию ооцитов/эмбрионов перед лечением основного заболевания. Это особенно важно в случаях исходно невысоких показателей овариального резерва и при наличии рака эндометрия, когда лечение может занимать длительное время.
Также в первые месяцы после извлечения ВМС у значительной части женщин (67,0%) диагностированы «тонкий» эндометрий и его неадекватная трансформация в течении индуцированного цикла, что, в свою очередь, может являться причиной низкой частоты беременностей. Собственный, пока небольшой, опыт показал, что в течение первых 2 месяцев после завершения терапии отмечены недостаточная толщина и трансформация эндометрия. Ультразвуковое мониторирование было проведено 30 женщинам в течение 2–4 циклов. При констатации роста доминантного фолликула и овуляции, толщина эндометрия в преовуляторный период составила 5,5 (1,2) мм, при этом отсутствовала характерная трехслойность. Указанный факт свидетельствует о необходимости поиска маркеров имплантационной компетентности эндометрия.
Беременность при достижении ремиссии после консервативного лечения рака эндометрия – наиболее сложный, противоречивый и дискуссионный вопрос. В литературе встречаются работы, описывающие наступление самостоятельной беременности у больных раком матки после гормонального лечения [9]. Тем не менее достоверная статистика частоты беременностей, их течения и деторождения отсутствует. Неясно, в течение какого периода времени после завершения лечения наступает беременность. Важность этого вопроса состоит, с одной стороны, в понимании компетентности эндометрия для имплантации и развития беременности, с другой – риска рецидивирования заболевания. Еще более сложной является ситуация, когда есть необходимость в проведении программ ЭКО с переносом ранее консервированных эмбрионов или в так называемых «свежих» циклах лечения. Какой период после завершения лечения наиболее благоприятный, как оценить достаточность секреторного эндометрия, можно ли назначать гормональную терапию, прежде всего эстрогены, при проведении переноса размороженных эмбрионов? Доказательных ответов на эти вопросы нет.
Выводы
Существует и возрастает потребность в реабилитации репродуктивной функции больных атипической гиперплазией и раком эндометрия I стадии, что делает эту проблему актуальной.
Самостоятельная гормонотерапия эффективна в достижении лечебного патоморфоза и ремиссии заболевания, однако существует настоятельная потребность в унификации протоколов лечения.
Целесообразно провести предварительную криоконсервацию ооцитов/эмбрионов перед лечением основного заболевания в силу времени, потраченного на лечение, особенно при исходно сниженных показателях овариального резерва, меньшего количества и худшего качества ооцитов, полученных после завершения лечения.
Существует настоятельная необходимость в разработке комплексного лечения пациенток с СПКЯ и выраженными эндокринно-метаболическими нарушениями, имеющих рак эндометрия I патогенетического типа или атипическую гиперплазию эндометрия.
Необходимо определить сроки достижения беременности после завершения лечения, базирующиеся на установлении маркеров, оценивающих рецептивность имплантационного эндометрия.



