Наибольший удельный вес в структуре онкологической заболеваемости женщин в Российской Федерации (РФ) имеют злокачественные новообразования органов репродуктивной системы (39,2%), при этом опухоли половых органов составляют 18,2% всех злокачественных новообразований у женщин [1]. По данным 2017 г., рак тела матки (РТМ) – 7,8% находится на 3-м месте в структуре онкологической патологии у женщин в России после рака молочной железы (21,1%) и новообразований кожи (16,6%) [1]. В структуре онкогинекологических заболеваний РТМ лидирует. Распространенность РТМ в РФ в 2008 г. составляла 128,6 на 100 000, в 2017 г. – 175,5 на 100 000 женского населения, по данным Росстата. Зафиксирован также рост заболеваемости РТМ в РФ: в 2007 – 24,0 на 100 000, в 2017 г. – 33,1 на 100 000 женщин. Прирост заболеваемости РТМ за период 2007–2017 гг. достиг 39,6%. Средний возраст пациенток, заболевших РТМ в РФ в 2017 г., составил 62,9 года [1].
По данным ВОЗ, International Agency for Research on Cancer (IARC), в 2018 г. показатель заболеваемости РТМ в мире в целом составляет 10,1 на 100 000 женщин, показатель заболеваемости РТМ во Франции – 31,9, в Новой Зеландии – 27,9, в РФ – 33,6 на 100 000 женщин [2].
Известно, что развитие эндометриальной аденокарциномы ассоциировано с гиперплазией эндометрия (ГЭ); в свою очередь, данные о распространенности ГЭ крайне малочисленны, что можно объяснить отсутствием официальной регистрации заболеваемости ГЭ. При изучении частоты и структуры ГЭ в РФ установлены отсутствие снижения частоты встречаемости заболевания в последние годы, а также достаточно высокий процент возникновения атипической ГЭ и аденокарциномы эндометрия в репродуктивном возрасте. Это подтверждает необходимость проведения программы канцеропревенции, которая включает квалифицированную морфологическую оценку эндометрия, выделение групп высокого онкологического риска, совершенствование подходов к терапии ГЭ [3]. В свою очередь, вопросу профилактики рецидивирования ГЭ уделяется недостаточное внимание ввиду отсутствия регламентирующих документов.
Цель исследования – анализ динамики заболеваемости РТМ в Омской области (ОО) за 2002–2018 гг. для определения приоритетов онкопрофилактики у пациенток с ГЭ.
Материалы и методы
Проведено сплошное описательное наблюдательное ретроспективное эпидемиологическое исследование заболеваемости РТМ за 2002–2017 гг. с использованием официальных статистических данных МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии» Минздрава России, официальные отчетные формы БУЗОО «Клинический онкологический диспансер» (отчетные формы №7 «Сведения о заболеваниях злокачественными новообразованиями», №35 «Сведения о больных злокачественными новообразованиями»). Детальные данные о возрастной структуре заболевших проанализированы за период 2009–2018 гг.
Статистический анализ осуществляли с использованием возможностей Microsoft Excel. В соответствии с алгоритмом описательного наблюдательного эпидемиологического исследования рассчитаны интенсивные (инцидентность, в расчете на 100 000 женского населения) и экстенсивные показатели заболеваемости (характеризующие структуру явления, выраженные в процентах), их стандартные ошибки (Власов В.В. Эпидемиология, 2004). Для оценки погрешности относительных величин вычисляли стандартную ошибку показателя по формуле:
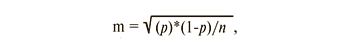
где n – число обследованных; p – частота признака у этих обследованных; m – стандартная ошибка.
Для обозначения пределов, в которых можно доверять полученной выборочной оценке, вычисляли доверительный интервал – ДИ (CI, confidence interval), в котором значение для генеральной совокупности находится с вероятностью 95%. Для получения 95% ДИ m умножалась на (t1-a/2), где a – принятый уровень альфа-риска. Альфа-риск соответствует 5% вероятности ошибки.
Анализ динамических рядов показателей проводили с выравниванием методом наименьших квадратов и расчетом показателей темпа прироста (снижения), выраженным в процентах.
Во всех процедурах статистического анализа критический уровень значимости р принимался равным 0,05.
Результаты и обсуждение
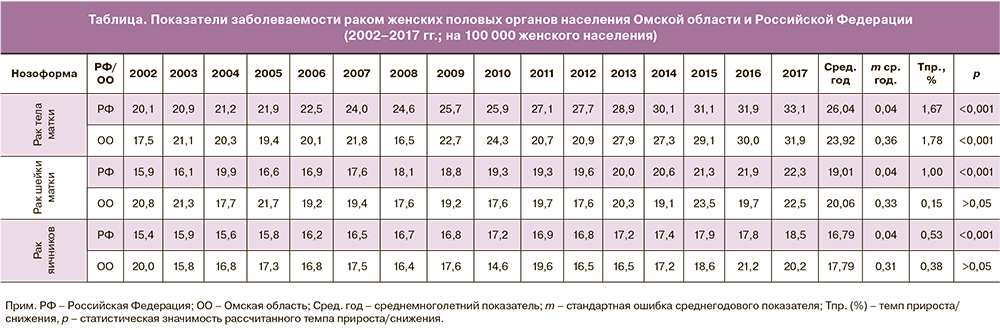
Анализ динамики заболеваемости РТМ в ОО проводили в сравнении с данными по РФ за период 2002–2017 гг. РТМ лидирует на протяжении всего периода наблюдения в сравнении с другими локализациями рака гениталий (таблица). Заболеваемость РТМ в РФ находилась в диапазоне от 20,9 в 2002 г. до 33,1 на 100 000 женщин в 2017 г. Заболеваемость РТМ в ОО в 2002 г. составила 17,5 на 100 000 женщин против 31,9 на 100 000 в 2017 г. (p<0,001; рис. 1). Отмечалась умеренная тенденция к росту заболеваемости РТМ (темп прироста Тпр.=+1,8%; p<0,001), как и по РФ (Тпр.=+1,7%; p<0,001) за период 2002–2017 гг. В целом за период наблюдения показатели заболеваемости в ОО были несколько ниже среднероссийских (соответственно 23,2±0,4 и 26,0±0,04‱; p<0,001), однако в последние годы фактически стали сопоставимыми. В 2018 г. показатель заболеваемости в ОО вырос до 35,1 на 100 000 женщин, достигнув максимума.

 Возрастная структура заболевших РТМ не имела существенных различий в ОО и РФ (p>0,05). Максимальную долю составили женщины 60–69 лет (32,3%), далее в порядке убывания – 50–59 лет (31,2%), 70 и более лет (23,4%), 40–49 лет (10,5%), 30–39 лет (2,3%), 20–29 лет (0,34%) (рис. 2).
Возрастная структура заболевших РТМ не имела существенных различий в ОО и РФ (p>0,05). Максимальную долю составили женщины 60–69 лет (32,3%), далее в порядке убывания – 50–59 лет (31,2%), 70 и более лет (23,4%), 40–49 лет (10,5%), 30–39 лет (2,3%), 20–29 лет (0,34%) (рис. 2).
Обращает на себя внимание умеренная тенденция к росту РТМ среди женщин 30–39 лет за период 2009–2018 гг., причем в группе женщин 35–39 лет отмечена выраженная тенденция к росту заболеваемости (Тпр.=+5,6%; p<0,05). Полученные результаты коррелируют с данными повозрастного распределения различных типов ГЭ (2008–2012 гг.) при изучении возрастных пиков заболеваемости. Так, пик атипической ГЭ – предрака эндометрия был зафиксирован в возрасте 35–40 лет, преимущественно у женщин с нереализованной репродуктивной функцией, в то время как пик простой и комплексной ГЭ был отмечен в возрасте менопаузального перехода [3]. В данном исследовании заболеваемость раком эндометрия в репродуктивном возрасте составила 13,5% всех случаев эндометриального рака (в мировой литературе – 5–9,6%).
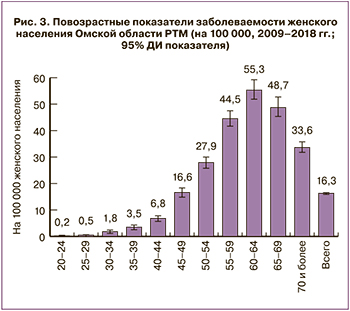 Повозрастные показатели заболеваемости РТМ женского населения ОО представлены на рис. 3. Определяются следующие возрастные группы риска: 35–39 лет (выраженный прирост показателей), 45–49 лет (существенный прирост, в сравнении с предыдущим возрастом) и 60–69 лет (максимальные показатели заболеваемости). При сравнении повозрастных показателей женского населения ОО со среднероссийскими существенных отличий не выявлено (p>0,05).
Повозрастные показатели заболеваемости РТМ женского населения ОО представлены на рис. 3. Определяются следующие возрастные группы риска: 35–39 лет (выраженный прирост показателей), 45–49 лет (существенный прирост, в сравнении с предыдущим возрастом) и 60–69 лет (максимальные показатели заболеваемости). При сравнении повозрастных показателей женского населения ОО со среднероссийскими существенных отличий не выявлено (p>0,05).
Важно отметить, что при стандартизации показателей заболеваемости (использован Мировой стандарт возрастной структуры женского населения) показатель заболеваемости ОО оказался несколько выше среднероссийского (но статистически незначимо, 22,17±0,35 и 21,8±0,04 соответственно; p>0,05).
Среди возможных причин, приводящих к злокачественной трансформации эндометрия, наряду с ожирением и инсулинорезистентностью, выделяют гиперпластические процессы эндометрия, включая атипическую форму (EIN в соответствии с бинарной классификацией ГЭ по ВОЗ, 2014). Немаловажным в данном вопросе является отсутствие мер, направленных на предупреждение рецидивирования ГЭ, а также организационные проблемы (неполное обследование пролеченных пациенток при отсутствии морфологического контроля эндометрия после завершения лечения ГЭ с атипией или без атипии, особенно среди нерожавших). Представляется дискуссионным вопрос о расширении показаний для проведения пайпель-биопсии эндометрия ввиду ее недостаточной информативности для диагностики очаговых процессов слизистой оболочки тела матки. Так, очаговая комплексная ГЭ была установлена в каждом втором случае на фоне простой ГЭ, в каждом четвертом – на фоне неизмененного эндометрия и в каждом десятом – на фоне полипа эндометрия [3].
При отсутствии показаний к хирургическому лечению пациенток с ГЭ в объеме гистерэктомии с учетом возраста женщин (EIN в пери-, постменопаузе, сочетанная гиперплазия матки, прогрессирование ГЭ и др.) выполняется консервативное лечение с применением гестагенов либо агонистов гонадотропин-рилизинг-фактора при сочетанной ГЭ [4–10]. Эффективность гестагенов различна и зависит от вида, режима и длительности терапии. Доказано, что левоноргестрел – внутриматочная система (ЛНГ–ВМС) имеет наиболее высокий показатель регрессии ГЭ, поэтому рассматривается как 1-я линия терапии. Ряд исследований свидетельствует, что непрерывный режим оральных и локальных гестагенов более эффективен, чем циклический режим. Так, эффективность лечения при неатипической форме ГЭ при использовании оральных прогестинов (медроксипрогестерон ацетат (МПА), дидрогестерон, норэтистерон) составляет 55,6–80%, ЛНГ-ВМС – 92–100% [4–11]. При этом частота гистерэктомии, которая выполняется у этих пациенток в последующем, в два раза выше при лечении оральными прогестинами, в сравнении с ЛНГ-ВМС (37,2–57,4% против 20–22,1%; p<0,001). Как известно, длительность терапии пациенток с ГЭ составляет 6 месяцев с последующим гистологическим контролем эндометрия. Отсутствие достижения регрессии комплексной ГЭ без атипии и ГЭ с атипией имеет высокий риск возникновения рака эндометрия [9].
Обсуждается возможность применения аблации эндометрия при ГЭ. Однозначно противопоказание для проведения аблации эндометрия при атипической ГЭ. В соответствии с международными рекомендациями NICE (2016), аблация эндометрия не показана и для лечения ГЭ без атипии, поскольку не обеспечивает полную и стойкую деструкцию ткани эндометрия, а формирование внутриматочных синехий затрудняет в последующем гистологический контроль эндометрия [12].
Заболевание в процессе лечения может протекать в варианте регресса ГЭ, персистенции ГЭ (отсутствие морфологического эффекта после основного курса), прогрессии ГЭ, отдаленного рецидива. Рецидивирование ГЭ – серьезная клиническая проблема. Показательны результаты многоцентрового РКИ с участием 153 женщин с ГЭ без атипии в возрасте от 30 до 70 лет, которые были рандомизированы на три группы, в зависимости от схемы лечения в течение 6 месяцев: 1) принимали оральные прогестины (МПА) в циклическом режиме, 2) принимали оральные прогестины (МПА) в непрерывном режиме и 3) введение ЛНГ-ВМС. Несмотря на более высокую эффективность ЛНГ-ВМС в сравнении с прогестинами по завершении лечения, при последующем наблюдении ситуация менялась. Частота рецидива гистологически верифицированной ГЭ составила 41% в течение 24 месяцев наблюдения после лечения, независимо от способа и режима лечения, максимально в первые 6 месяцев после завершения лечения (63,6%) [13].
Зачастую в клинической практике ведение пациенток с ГЭ без атипии ограничивается проведением первого этапа, несмотря на существующие возможности профилактических курсов гормонотерапии. Второй этап комплексного ведения пациенток с ГЭ (последовательно при гистологическом подтверждении регрессии) имеет ключевое значение в профилактике рецидива заболевания [5, 11, 13, 14].
В зависимости от возраста и репродуктивных планов пациентки возможны следующие варианты курации больных на втором этапе при достижении регрессии ГЭ:
- прогестагены в циклическом режиме в репродуктивном возрасте, в т.ч. при планировании беременности;
- ЛНГ-ВМС при выполненной репродуктивной функции и в перименопаузе (в т.ч. в варианте сочетания ЛНГ-ВМС с эстрогенами с целью менопаузальной гормональной терапии), а также при сопутствующем аденомиозе и для профилактики рецидива перитонеального эндометриоза;
- комбинированные оральные контрацептивы в репродуктивном возрасте и при необходимости контрацепции, а также в раннюю стадию менопаузального перехода.
В Федеральном руководстве указано, что целесообразна длительная профилактика ГЭ после завершения терапии при реализованной репродуктивной функции – в течение двух лет и более [15]. Вышесказанное можно рассматривать в качестве одной из мер профилактики рецидива ГЭ без атипии, прогрессирования в EIN и возможной трансформации в злокачественный процесс.
Заключение
РТМ занимает лидирующие позиции в структуре онкогинекологических заболеваний в РФ и регионе. В ОО за период 2002–2018 гг. установлен рост заболеваемости РТМ на 100 000 женщин (17,5 в 2002 г. и 35,1 в 2018 г.; Тпр.=+1,8%; p<0,001), тенденция к омоложению пациенток с РТМ (Тпр.=+5,6% в группе женщин 35–39 лет, p<0,05).
Высокая частота рецидивирования ГЭ без атипии диктует необходимость проведения длительного профилактического курса гормональной терапии с учетом репродуктивных планов пациентки после морфологического подтверждения эффективности лечения заболевания (не менее двух лет) с позиции онкологической профилактики эндометриального рака.



