Проблемы многоплодной беременности во многом определяют характер экстрагенитальной и генитальной патологии, влияющей на адаптацию материнского организма к беременности, гестационные осложнения и перинатальные потери [1].
Внедрение современных технологий в медицину значительно улучшило перинатальные исходы при многоплодной беременности. Однако показатели перинатальной заболеваемости и смертности по-прежнему в 4–8 раз выше, чем при одноплодной беременности [2].
Характер перинатальной патологии, ее тяжесть определяют и плацентарные нарушения на фоне нарушений процессов регуляции интерстициальной и эндоваскулярной инвазии цитотрофобласта в сроках 6–8 и 16–18 недель беременности. Неполноценное поверхностное внедрение трофобласта приводит к разрушению мышечной стенки спиральных артерий, гемодинамическим нарушениям и способствуют развитию тяжелых осложнений при беременности (плацентарной недостаточности и преэклампсии) [3].
Важную роль в регуляции роста и функционировании плаценты, в процессах пролиферации и дифференцировки ворсин трофобласта играет фактор роста плаценты (PIGF). Поэтому возможности прогнозирования гестационных осложнений при многоплодии в последнее время актуальны [4, 5].
Рассматривая многоплодную беременность как модель плацентарной недостаточности, мы разработали комплекс лечебно-диагностической мероприятий, основанный на прогнозировании тяжелых гестационных осложнений путем определения значений PIGF в сыворотке крови матери в сроках 6–8 недель беременности, Цель исследования: улучшение перинатальных исходов при многоплодной беременности на основании прогнозирования гестационных осложнений и создания комплекса лечебно-диагностических мероприятий в этой группе беременных.
Материал и методы исследования
Проведено проспективное исследование, где основную группу составили 124 беременных с многоплодием, которым применялась разработанная система лечебно-диагностических мероприятий. В группу сравнения вошли 126 беременных с многоплодием, которым проводилась стандартная методика обследования и лечения. Группу контроля составили 50 беременных с одноплодной беременностью.
Группы были сопоставимы по возрасту и клинико-лабораторным критериям. Клинико-лабораторное исследование проводилось за период с 2011 по 2013 г. на базе родильного дома БУЗОО ОКБ. Лабораторная диагностика и медикаментозная терапия осуществлялись после получения информированного согласия пациенток на лечение и с согласия этического комитета.
Проводились общеклинические анализы крови, мочи, уровень плацентарного фактора роста (P1GF) в сыворотке крови определяли твердофазным иммуноферментным анализом с использованием наборов моноклональных антител и реактивов фирмы «R&D systems» на фоне беременности в сроках 6–10 недель. Исследование системы гемостаза на селективном анализаторе – коагулометре «Ameting AMAXDestiny Plus», факторы, определяющие повреждение эндотелия: антифосфолипидные антитела классов IG M, IG G к В2 гликопротеину-1 и фосфотидилхолину определяли методом ИФА («Orgentec» и «Acskudiagnostics», Германия), выявление молекулярно-генетических маркеров тромбофилий (алельный полиморфизм генов протромбина, V фактора, метилентетрагидрофолатредуктазы, VII фактора, тромбоцитарного рецептора копротеина Gpilla, ингибитора активатора плазминогена) – методом ПЦР на наборах научно-производственной фирмы «Литех» (Россия). Оценка состояния фетоплацентарного комплекса включала ультразвуковую биометрию плодов, ультразвуковую оценку состояния плацент, ультразвуковую допплерометрию, КТГ-мониторирование с оценкой реактивности плодов по данным нестрессового теста и подробное изучение КТГ-кривой с применением оценочной шкалы.
С целью объективной диагностики хронической плацентарной недостаточности дана патоморфологическая характеристика последов и плацентарной области. Использованы только строго ориентированные срезы биоптатов плацентарной области, в которых был виден переход от краевой полосы фибриноида Рора или Нитабух к эндометрию и прилежащему миометрию. Всем новорожденным проводили клинические и лабораторные исследования по общепринятым методикам. Помимо изучения сонографически анатомических структур головного мозга новорожденных фиксировались патологические изменения: кровоизлияния, гипоксически-ишемические поражения головного мозга, вентрикуломегалия и другие отклонения.
Анализ данных осуществлялся с использованием лабораторной информационной системы «Алтай» (Москва), интегрированный в авторскую программу для ЭВМ «Статистический анализ клинико-лабораторных данных для прогнозирования развития риска патологии R_MED». (Свидетельство о государственной регистрации программы для ЭВМ № 2011614225 от 30 мая 2011 г.). Уровень значимости различий величин сравниваемых групп при условии нормального распределения определяли с использованием двухвыборочного теста для групп с разными дисперсиями, при ненормальности распределения использовался критерий Манна–Уитни, ранговый коэффициент корреляции Спирмэна. Различия считали статистически значимыми при р< 0,05.
Результаты исследования
Анализ течения беременности у беременных с многоплодием показал, что I триместре беременности у каждой второй пациентки по данным эхографии выявляли ретроплацентарные (31,6%) и субамниальные (24,2%) гематомы. В дальнейшем на этом фоне у 12,4% пациенток произошла редукция 2-го плода, у 32,6% в клинике наблюдались рецидивирующие кровянистые выделения, у 35,6% беременных отмечалась патология плацентации, у 59,6% пациенток имела место плацентарная недостаточность. Была выявлена корреляционная зависимость средней силы между наличием ретроплацентарных гематом и развитием плацентарной недостаточности у беременных с многоплодием (r=0,49, р<0,01).
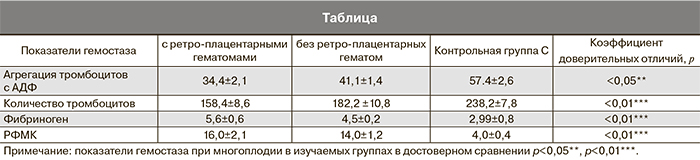
Ранними признаками, свидетельствующими о напряженности компенсаторных процессов адаптации, являются и коагуляционные нарушения, выявляемые в 42,6% случаев при оценке гемостезиологических параметров на фоне осложненного течения многоплодной беременности (таблица).
Повышенная активация свертывающей системы в 92,8% случаях имела место при осложненном течении многоплодной беременности в присутствие генов полиморфных аллелей и реактивации вирусной инфекции (r=0,89, р<0,01). Частота встречаемости полиморфных аллелей в группах беременных с многоплодием незначительно превышала таковую при одноплодной беременности (32,4 случаев и 21,1% соответственно), однако при многоплодии в 2 раза чаще выявлены мультигенные формы тромбофилии (преимущественно мутации фактора V-Leiden, фермента метилентетрагидрофолатредуктазы – MTHFR, протромбина – Pt G20210А). Существуют единичные исследования, посвященные изучению ассоциации полиморфизма генов, участвующих в развитии дисфункции эндотелия, и риском развития привычной потери плода. При повреждении эндотелиальные клетки начинают продуцировать прокоагулянты, вазоконстрикторы и факторы роста [6–8]. Эндотелиальная дисфункция и напряженность коагуляциолнных механизмов, по-видимому, ограничивает возможности адаптационных механизмов на всех уровнях и способствует развитию ранних нарушений в фето-плацентарной системе.
С целью прогнозирования ранних плацентарных нарушений в группах беременных с многоплодием в сыворотке крови матери исследовали показатели фактора роста плаценты (PIGF) в сроках 6–8 недель беременности. Была выявлена прямая корреляционная зависимость сильной силы, связанная с крайне низкими значениями (PIGF) менее 111,5±8,2 мкмоль/л и гибелью одного из плодов (r=0,89, р<0,01). Кроме того, досрочное прерывание беременности при многоплодии на фоне декомпенсации первичной плацентарной недостаточности произошло в 94,4% случаев, которая коррелировала с низкими значениями PIGF (менее 220±12,1 мкмоль/л) и в присутствии полиморфного гена метилентетрагидрофолатредуктазы – MTHFR и PAI I (r=0,89, р<0,01).
Ранние коагуляционные нарушения при многоплодной беременности способствовали развитию плацентарной недостаточности в 38,0% случаев. Субкомпенсированные и декомпенсированные формы плацентарной недостаточности в сочетании с задержкой развития одного из плодов и критическим снижением плацентарного кровотока диагностировались (42,4%) в исследуемых группах. О тяжести плацентарной недостаточности свидетельствовали прежде всего гемодинамические нарушения кровотока в маточных, пуповинных сосудах среднемозговых артерий Так, наличие реверсного кровотока в артериях пуповины в сроках 12–16 недель беременности находилось в прямой корреляционной зависимости средней силы с декомпенсированными формами плацентарной недостаточности (r=0,46, р<0,05).
Различные формы нарушений экстраэмбриональных структур при многоплодии встречались в 2 раза чаще, чем при одноплодной беременности. Так, патология плацентации в изучаемых группах имела место у 30,0% беременных, аномалии прикрепления плаценты наблюдали у 38,0% беременных с многоплодием. Оболочечное прикрепление пуповины одного из плодов выявлено в 42,0% случаев в 98,2% случаев сопровождалось, задержкой развития плода.
Внедрение в практику разработанного комплекса лечебно-диагностических мероприятий на основании полученных данных, основанных на прогнозе ранних нарушений процессов имплантации и плацентации, позволил обосновать необходимость проведения медикаментозной терапии до 12 недель беременности у пациенток с многоплодием в группе экстремально высокого риска. Медикаментозная коррекция направлена прежде всего на устранение патологической коагуляции и уменьшение воспалительной реакции, что в целом снижает риски развития антенатальных осложнений. Базовым препаратом для обеспечения имммуннологической толерантности матери и плода в этой группе беременных может быть дидрогестерон, назначаемый в дозировке 10 мг 2–3 раза в сутки до 16 недель, в дальнейшем продолжался прием препарата до 24–28 недель беременности в дозировке 10-20 мг. Для устранения повышенной коагуляционной активности крови, наблюдаемой в этой группе беременных в I и II триместрах беременности в сроках 10–12 недель и 26–28 недель беременности, применялись гепариноиды по 40–80 мг в течение 7–10 дней. Все это, по нашему мнению, способствует улучшению инвазии цитотрофобласта в спиральные артерии в сроках 6–8 и 16–18 недель беременности и правильному формированию экстраэмбриональных структур.
О положительном эффекте применяемого нами лечебно-диагностического комплекса свидетельствовало прежде всего уменьшение случаев угрозы прерывания с формированием ретроплацентарных гематом в 1,8 раза в основной группе беременных с многоплодием в сравнении с группой сравнения. Кроме того, при гистологическом исследовании в последах основной группы преобладали компенсированные формы плацентарной недостаточности – 48,4%, а в последах группы сравнения в 56,8% выявлены различные формы нарушения созревания ворсин, свидетельствующие о тяжелых плацентарных нарушениях. При изучении гемодинамических нарушений в основной группе на фоне проводимой терапии не зарегистрировано ни одного случая реверсного кровотока.
С целью объективной диагностики хронической плацентарной недостаточности в изучаемых группах дана патоморфологическая характеристика последов и плацентарной области.
При гистологическом исследовании в последах основной группы преобладали компенсаторно-приспособительные процессы, выявленные в 58,4% случаев. В то же время в последах группы сравнения доминировали процессы нарушения созревания, представленные в основном патологической незрелостью ворсинчатого дерева – 32,2% случаев и характеризующие неполноценность компенсаторно-приспособительные процессы. По данным морфологии плацент, признаки плацентарной недостаточности обнаружены в 24,6% последах основной группы и в 52,6% последах группы сравнения: выраженные компенсаторно-приспособительные процессы – в 58,4 и 14,3% соответственно; очаги кальциноза, склероз стромы ворсин – в 34,8 и в 20,5% случаев, задержка созревания плаценты – в 8,9 и 28,2%, диссоциированное развитие ворсин – в 8,9 и 24,6%. Выявляемый гистологически фоновый децидуит (преимущественно париетальный) преобладал в последах группы сравнения – 38,1%, в основной группе встречался в 12,4% случаях; мембранит диагностирован в 61,7% случаях в последах группы сравнения и в 14,0% случаях в основной группе. В ворсинах плацент основной группы при преэклампсии выявлен более высокий пролиферативный потенциал ворсинчатого цитотрофобласта и мощная пролиферация вневорсинчатого цитотрофобласта в составе клеточных островков. Сочетание пролиферативной активности всех разновидностей цитотрофобласта (ворсинчатого, вневорсинчатого, интерстициального и внутрисосудистого) с интенсивным ангиогенезом в ворсинах плаценты свидетельствует о гипоксическом генезе активации цитотрофобласта при плацентарной недостаточности.
Несомненно, выраженные компенсаторно-приспособительные процессы, присутствующие в последах беременных с многоплодием, не только обеспечивали биологическую сохранность тканей последа, но и способствовали нормальной жизнедеятельности системы «мать – плацента – плод».
У женщин основной группы с плацентарной недостаточностью при гистологическом исследовании в плацентарной области маток преобладали маточно-плацентарные артерии с частичной гестационной перестройкой и была отмечена более высокая пролиферативная активность интерстициального и внутрисосудистого цитотрофобласта в сопоставлении с группой сравнения.
При высоких значениях фактора роста плаценты в сыворотке крови матери более 344,1±8,2 мкмоль/л (r=0,46, p<0,05) отмечена высокая инвазивная активность интерстициального и ворсинчатого цитотрофобластов и гестационная перестройка спиральных артерий в базальной децидуальной оболочке и подлежащем миометрии, что свидетельствует о полноценности процессов внутрисосудистой инвазии трофобласта и в конечном итоге улучшает прогноз для плодов у пациенток основной группы.
Заключение
Таким образом, при многоплодной беременности группу экстремально высокого риска определяет выраженность нарушений в коагуляционном звене гемостаза, которые сопровождаются снижением факторов антикоагуляционной защиты в присутствии полиморфных аллелей (р<0,01).
Показатели PIGF (менее 220±12,1 мкмоль/л) и присутствие полиморфного гена метилентетрагидрофолатредуктазы – MTHFR и PAI I (r=0,89, p<0,01) являются при многоплодии прогностическими значимыми в плане профилактики тяжелых гестационных осложнений на фоне проведения лечебных мероприятий.
Очень низкие показатели PIGF в сыворотке крови матери (111,5±8,2 мкмоль/л) предрасполагают к развитию декомпенсированных форм плацентарной недостаточности и преждевременному прерыванию беременности (r=0,89, р<0,01).
Внедрение комплекса лечебно-диагностических мероприятий, основанного на ранней диагностике плацентарных нарушений позволило улучшить перинатальные исходы и снизить в 1,5 раза перинатальные потери (с 14,4‰ в 2012 г., до 9,8‰ в 2014 г.) в основной группе, за счет активного развития компенсаторных процессов в плаценте, более высокой пролиферативной активности интерстициального и внутрисосудистого цитотрофобласта в маточно-плацентарной области.



