Эндокринное бесплодие составляет 40% в структуре бесплодного брака; при этом основной причиной эндокринного бесплодия является синдром поликистозных яичников (СПКЯ) [1]. Актуальность СПКЯ обусловлена как высокой распространенностью этого заболевания (16–20% в популяции), так и большим количеством дискуссионных вопросов, связанных с его патогенезом, диагностикой и лечением. По данным Hart R. и соавт., СПКЯ занимает 18–25% в структуре бесплодного брака [2]. В программах вспомогательных репродуктивных технологий (ВРТ) при СПКЯ страдают как фолликулогенез и процессы созревания ооцитов (длительная стимуляция, избыточный или субоптимальный ответ, большой процент незрелых ооцитов, низкий процент оплодотворения и формирования бластоцист), так и процессы имплантации, что может быть связано с более высокой частотой патологии эндометрия, сопутствующей инсулинорезистентностью и гиперкоагуляцией [3, 4]. Повышение эффективности программ ВРТ за счет разработки индивидуального плана ведения пациенток остается актуальным вопросом репродуктивной медицины.
Целью настоящего исследования стало изучение клинико-анамнестических факторов, влияющих на исходы программ ВРТ при СПКЯ, и определение оптимальной тактики ведения таких пациенток.
Материалы и методы
В ретроспективное исследование были включены 311 пациенток с СПКЯ, которые обратились за лечением бесплодия с использованием программ ВРТ в ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации c 2017 по 2019 гг.
У 59 пациенток (группа I) перенос эмбрионов был выполнен в индуцированном цикле, а у 98 пациенток (группа II) из-за риска синдрома гиперстимуляции яичников (СГЯ) перенос был отменен и произведена криоконсервация всех эмбрионов хорошего качества. В III группу вошли 154 пациентки, у которых был выполнен перенос размороженных эмбрионов, полученных ранее в предыдущих программах ВРТ; у 35 из них с целью отбора эмбриона для селективного переноса проводилось преимплантационное генетическое тестирование на хромосомные аномалии (ПГТ-А) по 46 хромосомам методом NGS (подгруппа IIIa). У остальных пациенток ПГТ-А не проводилось (подгруппа IIIb, n=120).
Критериями включения в исследование были возраст женщин от 20 до 42 лет, наличие СПКЯ, показания к лечению методами ВРТ.
Критериями исключения являлись возраст моложе 20 и старше 42 лет, противопоказания к проведению лечения методом ВРТ, тяжелый мужской фактор бесплодия (азооспермия), наружный генитальный эндометриоз III–IV стадии, аномалии развития матки.
Для овариальной стимуляции со 2–3-го дня менструального цикла использовали препараты гонадотропинов (рекомбинантный фолликулостимулирующий гормон (ФСГ), человеческий менопаузальный гонадотропин или их комбинацию). Для подавления преждевременного пика лютеинизирующего гормона (ЛГ) преимущественно применяли антагонисты гонадотропин-рилизинг-гормона (ГнРГ). В качестве триггера финального созревания ооцитов в зависимости от риска СГЯ использовали рекомбинантный хорионический гонадотропин в дозе 250 мкг или агонисты ГнРГ (трипторелин) в дозе 0,2 мг. Через 35–36 ч после введения триггера финального созревания ооцитов выполняли трансвагинальную пункцию фолликулов и аспирацию ооцитов. Оплодотворение проводили методом ЭКО и/или интрацитоплазматической инъекции сперматозоида. Качество эмбрионов оценивали на основании общепринятых критериев. Со дня пункции для поддержки лютеиновой фазы цикла назначали препараты микронизированного прогестерона в виде вагинального геля 90 мг/сут или вагинальных капсул 600 мг/сут либо дидрогестерон в дозе 30 мг/сут. Перенос эмбрионов в полость матки осуществляли на стадии бластоцисты на 5-й день культивирования под контролем ультразвукового исследования. Переносили один или два эмбриона. При риске развития СГЯ (при получении более 15 ооцитов) перенос в индуцированном цикле отменяли и выполняли криоконсервацию всех эмбрионов хорошего качества. Подготовку к переносу размороженных эмбрионов выполняли в естественном цикле (у пациенток с овуляторной формой СПКЯ, фенотип D) или на фоне заместительной гормональной терапии. Также переносили один или два эмбриона. Для поддержки лютеиновой фазы цикла использовали препараты микронизированного прогестерона в виде вагинальных капсул 600 мг/сут либо геля 90 мг/сут и/или дидрогестерон в дозе 20–30 мг/сут.
Оценивали следующие характеристики протоколов ВРТ: продолжительность овариальной стимуляции, суммарную дозу гонадотропинов, количество полученных ооцит-кумулюсных комплексов; количество и процент зрелых (MII) ооцитов, частоту оплодотворения, дозу гонадотропинов в расчете на 1 ооцит (индекс овариальной чувствительности), частоту формирования бластоцист, толщину эндометрия на момент переноса эмбрионов, частоту имплантации, частоту биохимической и клинической беременности, частоту невынашивания беременности, частоту СГЯ. В циклах переноса размороженных эмбрионов также оценивали толщину эндометрия, частоту имплантации, частоту биохимической и клинической беременности, частоту невынашивания беременности. Также проводили корреляционный анализ для оценки влияния клинико-анамнестических характеристик (возраста, индекса массы тела (ИМТ), фенотипа СПКЯ, предварительной гормональной терапии, оперативных вмешательств в анамнезе, гормональных характеристик) на эмбриологические и клинические исходы программ ВРТ.
Статистический анализ
Статистическая обработка полученных данных выполнялась при помощи программы IBM SPSS, версии 23.0. Описательная статистика результатов исследования представлена для качественных величин в виде частот, выраженных в процентных долях, для абсолютных – в виде средних арифметических (М) и стандартных отклонений (SD) – М (SD). В случаях отсутствия нормального распределения признаков в описательной статистике использовались медиана (Ме) и квартили (Q25;Q75). Для оценки значимости статистических различий между исследуемыми группами применяли t-критерий Стьюдента для нормально распределенных признаков при условии равенства их дисперсии в сравниваемых группах по критерию Ливеня. В остальных случаях применялся непараметрический критерий Манна–Уитни. Значимость различий качественных признаков оценивали при помощи критерия χ2 Пирсона. При ожидаемой частоте встречаемости признака 5 и менее в таблицах «2×2» использовался точный критерий Фишера. При сравнениях в двух группах наблюдения различия считали статистически значимыми при р<0,05. При множественных сравнениях в трех группах наблюдения, с учетом поправки Бонферрони, использовали уровень статистической значимости различий р<0,02. Для определения корреляционных связей между переменными использовался расчет коэффициентов корреляции Пирсона (для количественных нормально распределенных переменных) и Спирмена (для количественных признаков, не имеющих нормального распределения, и категориальных переменных).
Для оценки степени влияния факторных признаков на вероятность наступления беременности или ее прерывания использовали расчет отношения шансов (ОШ). Оценивали шансы наступления беременности и невынашивания при переносе размороженных эмбрионов по отношению к переносам в индуцированном цикле, а также отдельно в группе пациенток с переносом размороженных эмбрионов при условии выполнения ПГТ-А. ОШ считали статистически значимыми, если обе границы доверительного интервала были больше или меньше 1.
Результаты
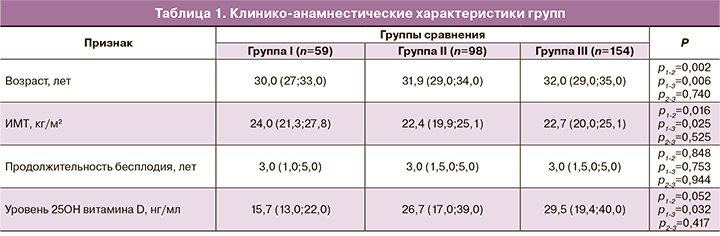
Исходные клинико-анамнестические характеристики групп представлены в таблице 1. Пациентки II группы были несколько старше, пациентки I группы имели более высокий ИМТ и более низкий уровень 25ОН витамина D; остальных различий между группами выявлено не было.
Распределение пациенток в разных группах в зависимости от фенотипа СПКЯ представлено в таблице 2.
В I группе значимо чаще встречался фенотип B (овуляторная дисфункция в сочетании с клинической и/или биохимической гиперандрогенией без поликистозной морфологии), что приводило к получению меньшего числа ооцитов, снижению риска СГЯ и позволяло выполнить перенос в индуцированном цикле.
Параметры овариальной стимуляции представлены в таблице 3.

Суммарная доза гонадотропинов, продолжительность стимуляции не различались между I и II группой, однако общее число полученных ооцитов оказалось больше во II группе по сравнению с I группой, чем и была обусловлена выбранная тактика. Процент оплодотворения оказался выше в I группе (73,6% против 64,4%; р=0,014), а частота формирования бластоцист была сопоставимой в обеих группах (60,05% и 65,81%; р=0,16). Доза гонадотропинов на 1 ооцит оказалась значимо выше в I группе (137,5 (95,19; 277,40) против 115,0 (70,23; 177,67); р=0,014). В III группе овариальная стимуляция не проводилась.
Селективный перенос одного эмбриона был выполнен у 67,8% пациенток I группы и в 69,7% случаев в III группе (p>0,05). Во II группе перенос эмбрионов не производился. Из-за гиперкоагуляционных нарушений при переносе эмбриона в индуцированном цикле гораздо чаще приходилось добавлять антикоагулянтную терапию, по сравнению с переносом размороженных эмбрионов (в 61% и 38,7% соответственно; р=0,12). Ни одного случая СГЯ при переносе в индуцированном цикле не наблюдалось. При криоконсервации всех полученных эмбрионов, благодаря использованию агониста ГнРГ в качестве триггера овуляции, также удалось избежать СГЯ.
Частота имплантации в I группе составила 37,2%, а в III группе – 50,7%, р<0,05. В подгруппе IIIa (после ПГТ-А) частота имплантации оказалась максимальной – 63,4%. Частота клинической беременности была значимо выше в III группе (70,6%) по сравнению с I группой (52,5%; р=0,013). Во II группе перенос эмбрионов не производился. ОШ для наступления беременности при переносе размороженных эмбрионов по сравнению с переносом в индуцированном цикле составило 2,168 (95% ДИ 1,168–4,022). Подгрупповой анализ показал, что после выполнения ПГТ-А и переноса эуплоидного эмбриона частота клинической беременности составила 82,9%, а без ПГТ-А – 66,9% (p=0,07). ОШ для наступления клинической беременности после ПГТ-А составило 2,386 (95% ДИ 0,91–6,23).
Наблюдалась положительная значимая корреляция между уровнем ЛГ и антимюллеровым гормоном (АМГ) (r=0,188; р=0,035), уровнями ЛГ и тестостерона (r=0,213; р=0,017), возрастом и дозой гонадотропинов (r=0,253; р=0,001), процентом зрелых ооцитов и процентом оплодотворения (r=0,607; р<0,001), процентом оплодотворения и временем от введения триггера до пункции фолликулов (r=0,181; р=0,023), наличием оперативных вмешательств на яичниках в анамнезе и длительностью бесплодия (r=0,205; р=0,010), процентом формирования бластоцист и частотой клинической беременности (r=0,284; р=0,031), толщиной М-эхо в день переноса эмбриона и частотой имплантации (r=0,275; р=0,035), а также ИМТ и частотой невынашивания беременности при переносе размороженных эмбрионов (r=0,203; р=0,011). Также наблюдалась отрицательная значимая корреляция между концентрацией тестостерона и 25ОНD (r=-0,419; р=0,012), наличием оперативных вмешательств на яичниках в анамнезе и уровнем ЛГ (r=-0,210; р=0,018), уровнем 17-ОН-прогестерона и частотой формирования бластоцист (r=-0,224; р=0,013), уровнем АМГ и частотой наступления беременности в индуцированном цикле (r=-0,315; р=0,015). Не было выявлено какой-либо связи межу приемом комбинированных оральных контрацептивов или гестагенов накануне стимуляции и эмбриологическими и клиническими исходами программ ВРТ у пациенток с СПКЯ.
При переносе размороженных эмбрионов риск невынашивания беременности был ниже, чем при переносе в индуцированном цикле (ОШ 0,381, 95% ДИ 0,20–0,72). Вероятность невынашивания беременности при проведении ПГТ-А снижалась в 2 раза (ОШ 0,428; 95% ДИ 0,19–0,97).
Обсуждение
Эффективность программ ВРТ определяется как исходными клинико-анамнестическими данными пациенток (возраст, ИМТ, оперативные вмешательства в анамнезе, уровни гормонов и др.), так и особенностями овариальной стимуляции в программе ВРТ. Также немаловажную роль может играть тактика переноса (в индуцированном цикле или криоконсервация всех полученных эмбрионов и отсроченный перенос). Продолжает обсуждаться эффективность и показания к проведению ПГТ-А в программах ВРТ.
Мы провели корреляционный анализ для выявления прогностических факторов эмбриологических и клинических исходов в программах ВРТ при СПКЯ и оценки влияния различных подходов для выбора наиболее оптимальной тактики.
Мы не обнаружили отрицательной корреляции между возрастом и эффективностью программ ВРТ. Количество пациенток старшего репродуктивного возраста (35 лет и старше) в I группе составило всего 17%; при этом самый старший возраст составил 38 лет. В 2016 г. было проведено исследование эффективности программ ВРТ при СПКЯ в зависимости от возраста [5]. Исходы лечения оценивали в разных возрастных группах (30–32; 33–35; 36–38; 39–41 год). Эффективность программ ВРТ при СПКЯ оказалась выше, чем при трубно-перитонеальном факторе в возрасте 33–35 лет (41,3% против 28,6%; р=0,038) и в возрасте 36–38 лет (40,4% против 15,1%; р=0,002). Авторы пришли к заключению, что, несмотря на то что в неселективной популяции эффективность программ ВРТ снижается уже в 35 лет, при СПКЯ она остается высокой до 38 лет включительно. В 2019 г. в исследовании с участием 3502 пациенток с СПКЯ и 18 596 женщин с трубно-перитонеальным фактором бесплодия также было продемонстрировано более медленное возрастное снижение эффективности программ ВРТ при СПКЯ. Даже у пациенток старше 40 лет наблюдались довольно высокие показатели имплантации (27,8% против 15,7%; р<0,05), клинической беременности (51,4% против 26,1%; р<0,05), частоты родов живым ребенком (42,3% против 18,2%; р<0,05) и кумулятивной частоты родов живым ребенком (50,0% против 21,5%; р<0,05) [6].
Мы наблюдали необходимость использования более высоких доз гонадотропинов у пациенток с СПКЯ старшего репродуктивного возраста, что может быть обусловлено снижением овариального резерва и более низким риском СГЯ у этих пациенток.
При получении большого числа зрелых ооцитов процент оплодотворения оставался высоким, причем, при увеличении времени от ведения триггера до пункции фолликулов получали больше зрелых ооцитов. Это может быть связано с тем, что в подавляющем большинстве циклов в качестве триггера овуляции использовали агонисты ГнРГ. Показано, что при синдроме пустых фолликулов увеличение времени, прошедшего от введения агониста ГнРГ до 40 ч, а также использование двойного триггера повышает количество получаемых при пункции ооцитов [7]. По нашим данным, высокую частоту формирования бластоцист можно считать положительным прогностическим фактором наступления клинической беременности у пациенток с СПКЯ.
Мы отмечали неблагоприятное влияние гиперандрогении на частоту формирования бластоцист и имплантации, а также повышался риск невынашивания беременности у таких пациенток при переносе эмбриона в индуцированном цикле, что также подтверждается данными литературы. Так, Yang в 2018 г. показал, что у пациенток с СПКЯ и гиперандрогенией количество полученных ооцитов было выше, суммарная доза гонадотропинов ниже, но частота невынашивания беременности выше, а частота родов живым ребенком ниже, чем у пациенток с СПКЯ без гиперандрогении и у женщин с трубно-перитонеальным фактором бесплодия [8]. В таких ситуациях авторы рекомендуют отменять перенос в индуцированном цикле, криоконсервировать все полученные эмбрионы и выполнять отсроченный перенос эмбрионов, чтобы избежать негативного влияния гиперандрогении на исходы программ ВРТ. Ранее проведенные исследования также продемонстрировали отрицательный эффект гиперандрогении на фолликулярный рост и эмбриогенез [9].
Сравнительная оценка эффективности программ ВРТ при переносе эмбрионов в индуцированных циклах и при переносе размороженных эмбрионов изучалась в многоцентровом рандомизированном плацебо-контролируемом исследовании с участием 1508 пациенток с СПКЯ [10]. Было показано, что частота родов живым ребенком после переноса размороженных эмбрионов достоверно выше, чем после переноса эмбриона в индуцированном цикле (49,3% против 42,0%; р=0,004); при этом риск СГЯ значимо снижался (1,3% против 7,1%; р<0,001), так же, как и снижалась частота невынашивания беременности (22,0% против 32,7%; р<0,001). Систематический обзор и метаанализ 2019 г. подтвердили более высокую частоту родов живым ребенком при переносе размороженных эмбрионов по сравнению с переносом в индуцированном цикле у пациенток с избыточным ответом на овариальную стимуляцию [11].
В последнее время в литературе продолжают широко обсуждаться показания к ПГТ-А в неселективной популяции пациентов с бесплодием и у отдельных групп пациентов [12]. Целесообразность проведения ПГТ-А при СПКЯ обусловлена не только необходимостью отбора из множества полученных эмбрионов наиболее перспективного, что позволит уменьшить время до наступления беременности, но и данными о, возможно, более высоком риске хромосомных аномалий у плода. Так, исследование ворсин хориона после прервавшихся беременностей в программах ВРТ показало, что при СПКЯ хромосомные аномалии встречались чаще (61,3% против 47,8%) [13]. Однофакторный и многофакторный анализы показали, что СПКЯ является независимым фактором риска хромосомных аномалий у эмбриона/плода. При этом в других работах было показано, что уровни тестостерона и дегидроэпиандростерона сульфата в сыворотке не влияют на плоидность эмбрионов в программах ВРТ [14]. Исследование роли ПГТ-А в программах ВРТ у молодых пациенток с СПКЯ требует дальнейшего изучения. По нашим данным, этот подход обеспечивает максимально высокую частоту клинической беременности и снижение риска невынашивания беременности. Однако существуют данные [15], что даже после переноса эуплоидного эмбриона риск ранних потерь плода при СПКЯ и нормальной массе тела выше, чем у пациенток без СПКЯ, что предполагает наличие дополнительных факторов риска невынашивания беременности. При СПКЯ и ожирении риски невынашивания беременности после переноса размороженных эмбрионов увеличиваются, что подтверждают полученные нами данные и результаты других исследований [16].
Важную роль при переносе эуплоидных эмбрионов играет рецептивность эндометрия. При проведении анализа экспрессии генов эндометрия у пациенток с СПКЯ были выявлены гены резистентности к прогестерону [17], что может препятствовать трансформации эндометрия и имплантации эмбриона. Мы наблюдали повышение вероятности имплантации при увеличении толщины эндометрия; при этом при наличии М-Эхо 15 мм и более перенос отменяли, и выполнялась гистологическая оценка эндометрия для исключения гиперпластических процессов. Данные о возможной резистентности к прогестерону при СПКЯ требуют пересмотра подходов к гестагенной поддержке в сторону ее индивидуализации. Вопросы наиболее оптимальной лютеиновой поддержки в циклах переноса размороженных эмбрионов и роли определения уровня прогестерона в оценке ее адекватности продолжают обсуждаться [18].
Заключение
Таким образом, факторами риска неблагоприятных эмбриологических и клинических исходов в программах ВРТ при СПКЯ являются гиперандрогения, высокий уровень АМГ и избыточная масса тела/ожирение. Поздний репродуктивный возраст, оперативные вмешательства на яичниках в анамнезе, фенотип В у пациенток с СПКЯ в программах ВРТ сопровождаются получением меньшего числа ооцитов, меньшим риском СГЯ и позволяют осуществить перенос в индуцированном цикле. Тем не менее перенос размороженных эмбрионов сопровождается более высокой частотой наступления беременности и более низким риском невынашивания беременности по сравнению с переносом в индуцированном цикле. Проведение ПГТ-А при СПКЯ позволяет добиться максимальной эффективности программ ВРТ при минимальном риске невынашивания беременности.



