Несмотря на увеличение случаев врастания плаценты в последние годы, влияние фактора врастания плаценты на неонатальные исходы и респираторную заболеваемость новорожденных не отражено ни в одном крупном многоцентровом клиническом исследовании. Литературные данные в большинстве случаев ограничиваются сравнением гестационного возраста детей, их массо-ростовых показателей и потребности в реанимационной помощи новорожденных.
Опубликовано несколько клинических исследований, показывающих, что фактор врастания плаценты у матери ассоциирован с повышением частоты развития респираторного дистресс-синдрома (РДС), а также с более длительной потребностью в респираторной поддержке новорожденных и использования им постоянного положительного давления в дыхательных путях [1, 2].
Проведенный нами ранее анализ продемонстрировал зависимость тяжести дыхательных и сердечно-сосудистых нарушений от наличия врастания плаценты у матери по сравнению с детьми аналогичного гестационного возраста (ГВ), рожденными у матерей без врастания плаценты, выражающийся в более тяжелом течении раннего неонатального периода и более высокой частоте развития РДС [3].
При анализе имеющихся современных клинических рекомендаций по ведению беременных с врастанием плаценты можно отметить некоторые различия относительно антенатальной профилактики РДС новорожденного.
Так, Международное общество врастания плаценты (IS-PAS) [4] и Американское общество акушеров и гинекологов (ACOG) [5] рекомендуют проводить антенатальную профилактику РДС с учетом ГВ согласно локальным протоколам ведения женщин с риском преждевременных родов, вне зависимости от наличия врастания плаценты. В свою очередь, ACOG рекомендует проводить однократный курс бетаметазона беременным женщинам в сроке гестации 34/0–36/6, в случае риска преждевременных родов в ближайшие 7 суток и при условии отсутствия ранее проведенных курсов [6].
Королевское общество акушеров-гинекологов (RCOG) рекомендует проведение одного курса антенатальной кортикостероидной (КС) терапии в сроке 34/0–35/6 недель беременным женщинам с низкорасположенной плацентой и предлежанием плаценты, без уточнения тактики при наличии врастания плаценты [7]. Эти рекомендации допустимо экстраполировать и на случаи врастания плаценты ввиду того, что врастание в подавляющем большинстве случаев сочетается с предлежанием плаценты.
В рекомендациях FIGO не затрагивается вопрос о проведении антенатальной профилактики РДС беременным с врастанием плаценты.
Российское общество акушеров-гинекологов (РОАГ) рекомендует проводить антенатальную профилактику РДС женщинам с врастанием плаценты до 36 недель при повторяющихся эпизодах кровяных выделений или сокращений матки, принимая во внимание высокий риск экстренного родоразрешения, а также рекомендует проведение повторного курса профилактики РДС, если от предшествующего курса КС прошло более 14 дней [8].
На сегодняшний день вопрос о проведении антенатальной профилактики РДС КС в когорте женщин со сроком гестации 34/0–36/6 недель остается дискутабельным [4, 9].
Ранее применение антенатальной профилактики РДС в группе позднего преждевременного родоразрешения (34/0–36/6 недель) в середине 90-х гг. было ограничено в связи с недостатком исследований, показывающих эффективность КС при применении после 34/0 недель [10]. Однако дальнейшие исследования выявили повышенную частоту неонатальной заболеваемости и смертности поздних недоношенных в сравнении с доношенными детьми [11].
Первым большим исследованием, показавшим эффективность антенатальной профилактики РДС при позднем преждевременном родоразрешении (34/0–36/6 недель), стало исследование Gyamfi-Bannerman C. et al., опубликованное в 2016 г. Оно продемонстрировало снижение частоты использования респираторной и сурфактантной терапии, дополнительной дотации кислорода у детей, матерям которых проводилась антенатальная профилактика бетаметазоном. Также в основной группе отмечалось значительное снижение частоты транзиторного тахипноэ новорожденного (ТТН) и бронхолегочной дисплазии. Из отрицательных эффектов была отмечена более высокая частота развития неонатальной гипогликемии [12].
Целью настоящего исследования явилась оценка эффективности антенатальной профилактики РДС новорожденного, проведенной в 34/0–36/6 недель гестации при досрочном родоразрешении по поводу врастания плаценты и определить оптимальный срок и кратность назначения КС беременным женщинам с врастанием плаценты.
Материалы и методы
Проведено проспективное сравнительное когортное исследование, в которое вошли 266 недоношенных детей, рожденных у матерей с врастанием плаценты, поступивших в ОРИТ им. проф. А.Г. Антонова Института неонатологии и педиатрии ФГБУ «НМИЦ АГП им. академика В.И. Кулакова» Минздрава России в период с января 2019 г. по декабрь 2022 г. включительно. У законных представителей новорожденных было взято информированное согласие на участие в исследовании. Данное клиническое исследование одобрено комиссией по этике биомедицинских исследований ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
В исследование были включены недоношенные дети ГВ 34/0–36/6 недель, рожденные у матерей с врастанием плаценты. Из исследования были исключены дети с врожденными пороками развития, хромосомными аномалиями, дети от многоплодных беременностей, дети, которым не проводилась антенатальная профилактика РДС (n=40). В анализ вошли 226 поздних недоношенных ребенка, рожденных у матерей с врастанием плаценты, которым проводилась антенатальная профилактика РДС.
На рисунке 1 представлена последовательность формирования выборки пациентов.
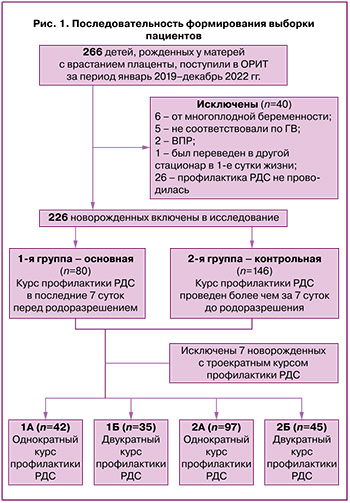
С целью оценки эффективности профилактического антенатального курса КС в когорте поздних недоношенных детей, рожденных у матерей с врастанием плаценты, дети, включенные в исследование, были разделены на 2 группы. В основную (1-я группа) (n=80) вошли дети, матерям которых в последние 7 дней перед родоразрешением был проведен полный курс профилактики РДС. Контрольную группу (2-я группа) (n=146) составили дети, рожденные у матерей с врастанием плаценты, которым антенатальная профилактика РДС была проведена более чем за 7 суток до родоразрешения.
Для сравнения эффективности повторных антенатальных профилактических курсов КС у данных групп пациентов дети были дополнительно разделены на 4 подгруппы в зависимости от кратности и срока проведения профилактического курса. В 1А подгруппу (n=42) вошли дети, матерям которых курс профилактики РДС был проведен однократно не более чем за 7 суток до родоразрешения. В 1Б подгруппу (n=35) – дети, матери которых получили 2 курса профилактики РДС, один из которых был проведен не более чем за 7 суток до родоразрешения. Подгруппы 2А (n=97) и 2Б (n=45) представлены детьми, матерям которых профилактика РДС проводилась более чем за 7 суток до родоразрешения однократно и двукратно соответственно. Из подгрупп были исключены 7 новорожденных, которым проводилось 3 курса профилактики РДС.
Характеристика групп пациентов включала в себя: ГВ, массу и длину тела при рождении, окружность головы, гендерную принадлежность, оценку по шкале Апгар на 1-й и 5-й минутах жизни, сроки проведения последнего курса профилактики РДС.
Первичные конечные точки исследования включали в себя частоту заболеваемости (РДС, врожденная пневмония (ВП), ТТН) и критерии тяжести дыхательных нарушений: частота и длительность респираторной терапии (неинвазивная респираторная терапия, искусственная вентиляция легких (ИВЛ), включая высокочастотную осцилляторную вентиляцию легких (ВЧОВЛ), используемую при тяжелых дыхательных нарушениях и неэффективности традиционной ИВЛ), максимальное требуемое среднее давление в дыхательных путях, частота, длительность и максимальная концентрация дополнительной дотации кислорода, частота проведения заместительной сурфактантой терапии.
Вторичными конечными точками являлись длительность пребывания в отделении реанимации и интенсивной терапии новорожденных (ОРИТН), общая длительность госпитализации новорожденного в сутках и частота развития гипогликемии как краткосрочного побочного эффекта антенатальной профилактики КС.
Антенатальная профилактика РДС проводилась согласно действующим клиническим рекомендациям, а именно: дексаметазоном в дозе 8 мг внутримышечно 3 раза с интервалом введения 8 ч (суммарная доза 24 мг) [13].
Статистический анализ
Статистический анализ проводился с использованием программы StatTech v. 3.0.9, а также с помощью программы IBM SPSS Statistics, version 26.0. Основываясь на предыдущем исследовании [3], размер выборки, рассчитанный с применением программы G*Power V3.1 по частоте использования ВЧОВЛ у новорожденных в группе контроля равной 23% и у детей, рожденных у матерей с врастанием плаценты, равной 42%, с соотношением количества групп контрольная/основная – 1,8, достаточный для настоящего исследования (для 80% мощности и уровня значимости α – 0,05 необходимо 76 пациентов в основной и 137 в контрольной группе). Перед проведением сравнительного анализа количественных данных в исследуемых группах проведена проверка соответствия нормальному распределению (критерий Шапиро–Уилка и критерий Колмогорова–Смирнова, графический анализ данных). Учитывая отсутствие нормального распределения данных, применялись методы непараметрической статистики. Количественные данные представлены в виде медианы (Ме) и интерквартильного размаха (IQR) 25–75 перцентиля. Для наглядности показатель максимальной требуемой концентрации кислорода представлен дополнительно в виде средней арифметической величины (M) со стандартным отклонением (SD) и границами 95% доверительного интервала (95% ДИ). Качественные переменные представлены в виде абсолютного числа и процент от общего числа в группе.
Сравнение количественных переменных в двух группах анализировали с помощью непараметрического теста Манна–Уитни, в трех и более группах – с помощью критерия Краскела–Уоллиса с последующим попарным сравнением с использованием критерия Манна–Уитни с поправкой на множественность Бонферрони. При сравнении качественных переменных использовался критерий χ2 Пирсона (ожидаемое явление >10), χ2 Пирсона с поправкой Йейтса (ожидаемое явление >5, но <10), точный критерий Фишера (ожидаемое явление <5). Для оценки влияния факторов риска были рассчитаны относительные риски (ОР) с 95% доверительным интервалом (ДИ). Статистически значимыми считались различия при р<0,05.
Результаты
Характеристика новорожденных, включенных в исследование, представлена в таблице 1.
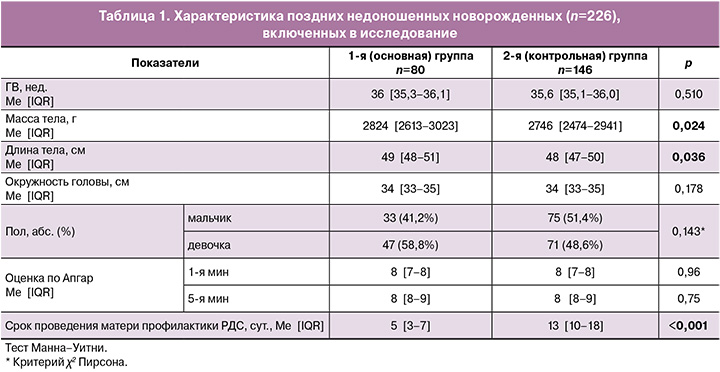
Исследуемые группы были сопоставимы по ГВ, массе тела при рождении, окружности головы, оценке по шкале Апгар на 1-й и 5-й минутах. У детей контрольной группы отмечалась значимо меньшая длина тела при рождении. Распределение по полу также было сопоставимым. Медиана времени, прошедшего от момента последнего курса профилактики РДС до родоразрешения, в основной группе составила 5 суток, в контрольной группе – 13 суток (р<0,001).
С целью оценки эффективности проведенных антенатальных курсов профилактики РДС проведено сравнение частоты заболеваемости ТТН, РДС и ВП. Структура причин дыхательных нарушений в исследуемых группах представлена в таблице 2.
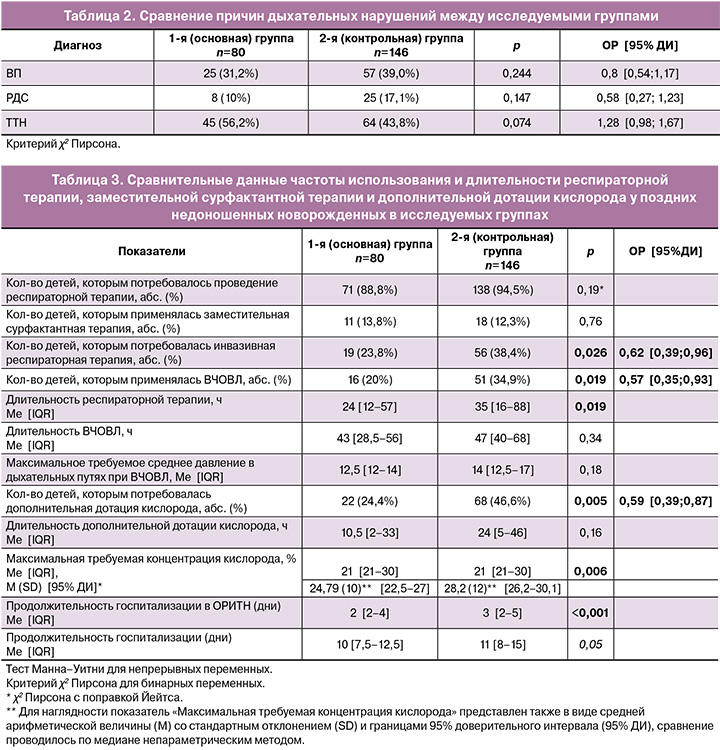
Статистически значимых различий в частоте заболеваемости ВП, РДС и ТТН не выявлено.
Для сравнения тяжести дыхательных нарушений в исследуемых группах нами проведен анализ частоты использования неинвазивной респираторной терапии, ИВЛ и ВЧОВЛ, дополнительной дотации кислорода, заместительной сурфактантной терапии, общей продолжительности респираторной терапии, длительности ВЧОВЛ и дополнительной дотации кислорода, и, как следствие, длительности пребывания детей в ОРИТН и в стационаре. Также проведено сравнение максимальных требуемых параметров респираторной терапии, в частности концентрации кислорода и среднего давления в дыхательных путях. Результаты представлены в таблице 3.
Выявлено, что детям, рожденным у матерей с врастанием плаценты, которым проводилась антенатальная профилактика РДС КС в период 7 дней до рождения, значимо реже проводились интубация и инвазивная респираторная терапия (ИВЛ или ВЧОВЛ); помимо этого, у них реже отмечалась потребность в дополнительной дотации кислорода.
Несмотря на то что детям основной группы в 1,6 раза реже требовалось проведение инвазивной респираторной терапии и в 1,8 раза реже был необходим перевод на ВЧОВЛ, продолжительность инвазивной респираторной поддержки в группах значимо не отличалась. Однако общая продолжительность респираторной терапии у детей контрольной группы была существенно выше. Это, в свою очередь, отразилось в значимо большей продолжительности пребывания в ОРИТН детей контрольной группы, а общая продолжительность госпитализации в обеих группах отмечена на границе значимости.
Дополнительная дотация кислорода детям без предшествующей профилактики РДС требовалась в 1,7 раза чаще, а также требуемая концентрация кислорода у данной группы была значимо выше.
Значимых различий в величине среднего давления в дыхательных путях при ВЧОВЛ, длительности кислородотерапии между группами выявлено не было.
Частота развития гипогликемий не различалась между группами: 1-я группа – 46/80 (57,5%), 2-я группа – 79/146 (54,1%), (р=0,624).
Для определения наиболее эффективной схемы антенатальной профилактики РДС дети были разделены на подгруппы в зависимости от срока и кратности проведения антенатального курса КС. Характеристика подгрупп представлена в таблице 4.
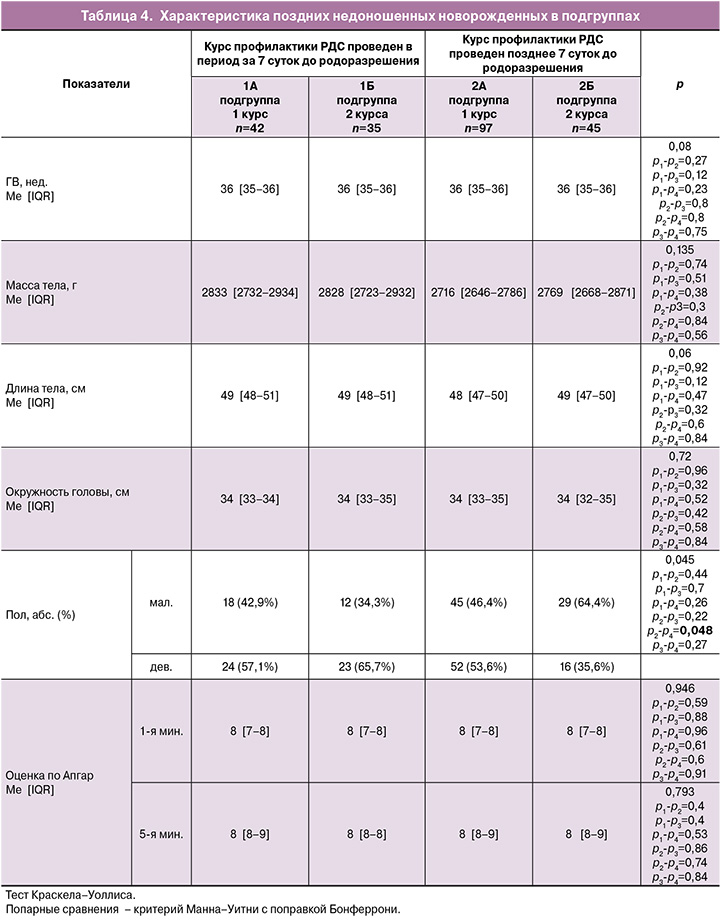
В исследуемых подгруппах 1А–2Б новорожденных ГВ, антропометрические показатели и оценка по шкале Апгар не отличались.
Проведено сравнение вышеперечисленных показателей респираторной терапии, длительности госпитализации в ОРИТН и частоты гипогликемий в подгруппах в зависимости от срока и кратности проведения антенатального курса КС. Результаты представлены на рисунках 2–5.
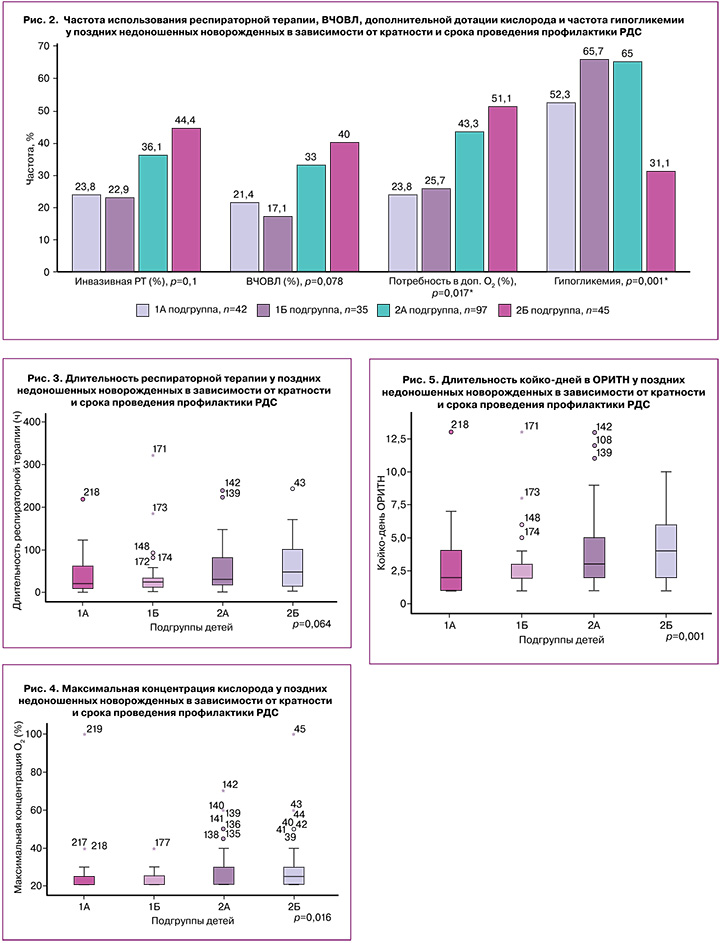
При сравнении частоты и длительности респираторной терапии и частоты потребности в дополнительной дотации кислорода в подгруппах статистически значимые различия были выявлены в частоте использования дополнительной дотации кислорода и максимально требуемой концентрации кислорода. Так, наибольшая частота использования дополнительного кислорода – 23/45 (51,1%) и максимальная концентрация кислорода отмечались в подгруппе детей, матерям которых было проведено 2 профилактических курса КС, последний из которых был позднее чем за 7 суток до родоразрешения, по сравнению с детьми, матерям которых проводился курс КС в последние 7 дней перед родоразрешением (р=0,017 и р=0,016 соответственно). При этом у детей, которым профилактический курс проводился позднее, чем за 7 дней до рождения, частота использования дополнительного кислорода и максимальная концентрация значимо не отличались в зависимости от кратности проведения курсов КС (1 курс – 42/97 (43,3%) или 2 курса – 23/45 (51,1%)). Не было выявлено значимых различий в частоте использования дополнительного кислорода и максимальной концентрации кислорода в подгруппах 1А и 1Б. При наличии 1 проведенного курса профилактики РДС за 7 дней до родов частота использования дополнительной дотации кислорода составила 10/42 (23,8%), при двукратном курсе, один из которых за 7 дней до родов, – 9/35 (25,7%).
Схожие результаты были выявлены при сравнении продолжительности госпитализации в ОРИТН. Наибольшая длительность отмечалась в подгруппе 2Б (в среднем 4 суток), тогда как продолжительность пребывания в ОРИТН в подгруппах с профилактикой РДС в последние 7 дней перед родоразрешением, вне зависимости от кратности проведенных курсов, составила в среднем 2 суток (р=0,001).
Значимых отличий в частоте использования ВЧОВЛ и инвазивной респираторной терапии, а также в длительности респираторной поддержки в подгруппах не отмечалось.
При сравнении частоты развития гипогликемии в подгруппах были выявлены значимые различия. Наиболее высокая частота развития неонатальной гипогликемии отмечалась в группе детей, матерям которых профилактика РДС была проведена дважды, и последняя – в период за 7 дней до родов – 23/35 (65,7%), а наименьшая частота гипогликемий – в группе поздней двукратной профилактики – 14/45 (31,1%) (р=0,001).
Обсуждение
До настоящего времени эффективность антенатальной профилактики РДС для улучшения созревания легочной ткани поздних недоношенных детей, рожденных у матерей с врастанием плаценты, прицельно не изучалась [4].
В мультицентровом, рандомизированном плацебо-контролируемом исследовании Gyamfi-Bannerman C. et al. (2016) продемонстрировано снижение частоты использования постоянного положительного давления в дыхательных путях (СРАР) и высокопоточных канюлей (ВПК), дополнительной дотации кислорода, сурфактантной терапии у новорожденных, матерям которых проводилась антенатальная профилактика бетаметазоном при позднем родоразрешении [12]. Эти данные частично согласовываются с результатами, полученными нами в данном исследовании, в частности выявлено снижение частоты использования дополнительной дотации кислорода и потребность в меньшей концентрации кислорода у детей основной группы.
Помимо этого, в исследовании Gyamfi-Bannerman C. et al. оценивался такой показатель, как потребность в проведении СРАР или ВПК более 12 ч, и он был значимо ниже у детей, матери которых получили курс профилактики РДС [12]. Это косвенно соотносится со снижением общей продолжительности респираторной терапии в основной группе, описанным в нашем исследовании. Дети, матери которых не получили своевременный курс профилактики РДС, пребывали в ОРИТН дольше, чем дети основной группы [12], что сопоставимо с нашими результатами.
Нами не было установлено значимых отличий в использовании неинвазивной респираторной терапии в целом и сурфактантной терапии. Также мы не получили значимых различий в частоте заболеваемости ТТН, РДС и ВП.
Выявленные расхождения могут объясняться тем, что не все женщины, попавшие в основную группу исследования Gyamfi-Bannerman C. et al. [12], прошли полный курс профилактики (лишь 60%). Также из исследования были исключены те, которым ранее уже проводился курс профилактики РДС, тогда как в нашем исследовании такие женщины присутствовали.
В 2016 г. был проведен систематический обзор с метаанализом, включавший, в том числе, и вышеописанное исследование [14].
По результатам данного метаанализа, новорожденные, матери которых получали антенатальные КС при сроке более 34 недель, имели значительно более низкий риск развития РДС, ТТН, более низкую частоту использования сурфактанта и ИВЛ, а также значительно меньшую продолжительность дополнительной дотации кислорода. Этим детям требовалась более низкая максимальная концентрация вдыхаемого кислорода, более короткое пребывание в ОРИТН, и у них были выявлены более высокие баллы по шкале Апгар, по сравнению с контрольной группой [14].
Из перечисленных показателей в нашем исследовании удалось выявить значимые отличия в частоте использования ИВЛ и дополнительной дотации кислорода, а также в максимальной требуемой концентрации дополнительного кислорода. Соотносятся и данные о снижении длительности пребывания в ОРИТН детей основной группы.
Ограничением использования антенатальной профилактики РДС на поздних сроках беременности служат описанные в настоящее время краткосрочные и долгосрочные побочные эффекты [15]. Среди них можно выделить замедленный рост плода [16], неонатальную гипогликемию [12], а также такие долгосрочные исходы, как недостаточная успеваемость в школе [17], повышенная уязвимость к физическим и психическим расстройствам, связанным со стрессом [18] и нарушение обмена веществ во взрослом возрасте [19, 20].
В ретроспективном когортном исследовании новорожденные, родившиеся в позднем недоношенном и в доношенном сроке, подвергшиеся антенатальному воздействию КС, имели значительно меньшую массу и длину тела при рождении и меньшую окружность головы. Причем выявленное замедление роста плода усугублялось при проведении многократных курсов КС [16].
В нашем исследовании, напротив, у детей, рожденных у матерей с врастанием плаценты, которым проводилась антенатальная профилактика РДС КС в период 7 дней до рождения, масса и длина тела при рождении была значимо выше, чем в контрольной группе. Остальные антропометрические показатели были сопоставимы в обеих группах, а при оценке данных показателей в зависимости от кратности проведенных профилактических курсов не было выявлено значимых различий.
Исследование Gyamfi-Bannerman C. et al. показало значительное увеличение частоты развития неонатальной гипогликемии у новорожденных, матерям которых проводились антенатальные курсы КС [12]. В нашем исследовании частота развития гипогликемии у детей, матерям которых профилактика проводилась в последние 7 дней до родоразрешения, и у детей, матери которых получили однократный курс профилактики КС в сроке более 7 дней до родоразрешения, значимо не отличалась. Интересен факт, что наименьшую частоту гипогликемий имела группа детей, матери которых получили 2 курса профилактики РДС, проведенные позднее 7 суток до родов. Полученные данные ставят под сомнение зависимость частоты развития гипогликемии от сроков и кратности назначения КС.
Ограничения исследования
Ограничениями нашего исследования явилась неравномерность количества детей в подгруппах (наибольшее количество (n=97) в подгруппе детей с однократной профилактикой, проведенной более чем за 7 дней до родоразрешения, и наименьшее (n=35) – в подгруппе детей с двукратной профилактикой, когда последняя проведена в течение 7 дней до родоразрешения). Также при анализе частоты гипогликемий не учитывалась доля сахарного и гестационного сахарного диабета у матерей.
Заключение
Таким образом, анализ нашего исследования показал, что проведение антенатального курса КС для профилактики РДС на сроке 34/0–36/6 недель у женщин с врастанием плаценты не позднее 7 суток до родоразрешения позволяет снизить тяжесть дыхательных нарушений, частоту применения и длительность инвазивной респираторной терапии, в том числе ВЧОВЛ у поздних недоношенных новорожденных, имеющих, как известно, более тяжелое течение раннего неонатального периода и высокую частоту РДС по сравнению с детьми, рожденными у матерей без врастания плаценты. Выявленные положительные эффекты не зависели от кратности проведения курсов профилактики РДС; основополагающим фактором являлся срок проведения профилактического курса. Проведенный курс профилактики РДС на более ранних сроках беременности не является определяющим, и требуется проведение дополнительного курса в последнюю неделю перед планируемым родоразрешением у пациенток с врастанием плаценты.



