Одной из основных причин ранних неонатальных потерь являются инфекционно-воспалительные заболевания, диагностика которых у недоношенных новорожденных во всем мире представляет значительные трудности. Клиническая картина неонатальных инфекций неспецифична и схожа с рядом других состояний, характерных для недоношенных пациентов, а определяемые рутинно лабораторные маркеры системного воспалительного ответа (С-реактивный белок (СРБ), уровень лейкоцитов, нейтрофилов и тромбоцитов) не обладают достаточной точностью при инфекциях раннего неонатального периода (ранний неонатальный сепсис (РНС), врожденная пневмония (ВП)) [1–3]. Выявление возбудителя в крови микробиологическими методами является стандартом постановки диагноза «сепсис», однако частота положительных результатов гемокультур у новорожденных крайне низка. В развитых странах мира частота микробиологически подтвержденного РНС у недоношенных составляет от 3,7 до 9,7 на 1000 живорождений (0,4–1%) [4–6]. При этом частота клинического сепсиса (не подтвержденного микробиологически), по данным различных авторов, в 6–16 раз выше подтвержденного и достигает 24,4% среди новорожденных, родившихся ранее 33 недель гестации [4, 7–9]. Роль микробиологического исследования отделяемого слизистой верхних дыхательных путей (ВДП) и желудочно-кишечного тракта (ЖКТ) в 1-е сутки жизни в комплексной диагностике инфекционных заболеваний раннего неонатального периода изучена недостаточно. Таким образом, клиническая значимость и целесообразность рутинного микробиологического скрининга нестерильных локусов у новорожденных, поступающих в отделения реанимации и интенсивной терапии (ОРИТН), ставится под сомнение. Вместе с тем, учитывая крайне низкую частоту выявления положительных гемокультур, исследование материала нестерильных локусов наряду с исследованием микрофлоры цервикального и вагинального отделяемого женщин незадолго до родов, а также исследование амниотической жидкости и плодных оболочек являются единственными источниками информации о предполагаемом спектре возможных перинатальных патогенов. К тому же, эта информация имеет важное эпидемиологическое значение.
Цель исследования: определить клиническую значимость микробиологического исследования посевов со слизистой ВДП и ЖКТ в 1-е сутки жизни у недоношенных новорожденных, госпитализированных в ОРИТН.
Материалы и методы
Проведено проспективное обсервационное исследование, в которое были включены 205 недоношенных новорожденных гестационного возраста (ГВ) менее 37 недель, родившихся в ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России в период с января 2020 г. по апрель 2021 г. Все дети поступили из родильного блока в течение 1-го часа жизни для обследования и лечения в ОРИТН № 2. Критериями невключения в исследование у новорожденных являлись: наличие врожденных пороков развития, наследственных болезней обмена веществ и хромосомных аномалий.
У всех пациентов сразу после рождения собирался биологический материал из трех локусов (образцы крови, отделяемое со слизистой оболочки зева и прямой кишки). Проводилось микробиологическое исследование с использованием микроскопического и культурального метода с видовой идентификацией микроорганизмов MALDI-TOF-MS анализом (матрично-активированная лазерная дезорбционная/ионизационная времяпролетная масс-спектрометрия (Matrix-Assisted Lazer Desorption/ Ionization Time-of-Flight Mass Spectrometry). В данной работе при исследовании новорожденных не использовались специфические среды для детекции внутриклеточных микроорганизмов (Ureaplasma sp., Micoplasma sp.).
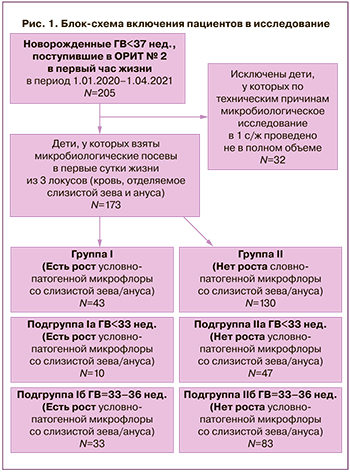
В ходе предварительного анализа собранного биоматериала из исследования были исключены 32 пациента, у которых по техническим причинам микробиологическое обследование в 1-е сутки жизни было проведено не в полном объеме (биоматериал одного из локусов отсутствовал). Новорожденные, вошедшие в окончательный анализ (n=173), были разделены на 2 основные группы в зависимости от наличия роста условно-патогенных микроорганизмов (УПМ) в посевах отделяемого со слизистых ВДП и ЖКТ: группу I составили 43 новорожденных ребенка, у которых был обнаружен рост УПМ, группу II – 130 новорожденных, у которых при проведении микробиологического исследования биоматериала из указанных выше локусов был получен отрицательный результат. Сравнение пациентов, включенных в исследование, проводилось в подгруппах в зависимости от ГВ: а) ГВ<33 недель, б) ГВ=33–36 недель. Блок-схема включения детей в исследование приведена на рисунке 1.
Всем новорожденным с целью выявления/исключения врожденной инфекции проводилось стандартное клинико-лабораторное обследование, включавшее клинический анализ крови с подсчетом абсолютного числа лейкоцитов, тромбоцитов, нейтрофилов и вычисление нейтрофильного индекса (НИ), определение концентрации СРБ, рентгенографию органов грудной полости, анализ гемокультуры. По результатам проведенного клинико-лабораторного и инструментального обследования и оценки динамики клинического состояния ребенка в возрасте 72 ч жизни делалось заключение о наличии или отсутствии врожденной инфекции. Дифференциальный диагноз между ВП, респираторным дистресс-синдромом (РДС) и транзиторным тахипноэ новорожденных (ТТН) проводился в соответствии с клиническими рекомендациями [10, 11]. Диагноз «ранний неонатальный подтвержденный сепсис» устанавливался на основании выявления у ребенка в первые 72 ч жизни положительной гемокультуры и наличия одного и более клинических признаков инфекционного процесса (Приложение) [11–13]. Диагноз «клинический ранний неонатальный сепсис» устанавливался в течение первых 72 ч жизни при отсутствии выявления микроорганизмов в образце культуры крови, но при наличии не менее двух клинических и не менее двух лабораторных признаков инфекционного процесса, согласно критериям, принятым «The Expert Meeting on Neonatal and Paediatric Sepsis, London 2010» [14].
Антибактериальная терапия (АБТ) проводилась в соответствии с клиническими рекомендациями, стартовая схема была представлена комбинацией следующих препаратов: ампициллин+гентамицин [11]. АБТ по подозрению на реализацию РНС и ВП назначалась в 1-е сутки жизни следующим категориям детей с дыхательными нарушениями: 1) пациенты с очень низкой массой тела, 2) новорожденные, находящиеся на инвазивной искусственной вентиляции легких (ИВЛ). При наличии показаний по результатам первичного клинико-лабораторного обследования АБТ назначалась пациентам массой тела при рождении свыше 1500 г, имевшим дыхательные нарушения, но не потребовавшим проведения ИВЛ, а также находящихся на неинвазивной дыхательной терапии (спонтанное дыхание с постоянным положительным давлением (СРАР), неинвазивная ИВЛ) или пациентам без респираторной терапии. АБТ, начатая по подозрению в 1-е сутки жизни, отменялась при отсутствии клинико-лабораторных и инструментальных данных, подтверждающих течение ВП в течение 72 ч жизни. Назначение противогрибковых препаратов новорожденным проводилось строго по показаниям, профилактическое назначение антимикотических препаратов у новорожденных, вошедших в данное исследование, не применялось [15].
В исследуемых подгруппах проводили оценку следующих показателей: частота РНС и ВП, осложнений (синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром), внутрижелудочковые кровоизлияния (ВЖК), перивентрикулярная лейкомаляция (ПВЛ), некротизирующий энтероколит (НЭК), бронхолегочная дисплазия (БЛД), ретинопатия недоношенных) и летальных исходов, оценивались частота инвазивной ИВЛ, частота и длительность антимикробной и кардиотонической терапии. Диагноз НЭК устанавливался согласно критериям, предложенным Bell et al. (1978), в модификации Walsh and Kliegman (1987) [16–18]. Наблюдение за пациентами проводилось до достижения ими постконцептуального возраста (ПКВ) 37 недель или до выписки из стационара, если она произошла ранее 37 недель ПКВ.
Проведен анализ взаимосвязи результатов микробиологического исследования со значениями оценки тяжести состояния по шкале NEOMOD, оценки тяжести полиорганной недостаточности (шкала nSOFA) на 1-е и 3-и сутки жизни [19, 20].
Сопоставлялись частота выявления идентичных штаммов УПМ при получении положительных гемокультур и посевов со слизистых ВДП и ЖКТ, а также анализ видового состава УПМ, выделенных у новорожденных основной и контрольной групп в целом. Также проанализированы частота повышения и абсолютные значения лабораторных маркеров системной воспалительной реакции на 1-е и 3-и сутки жизни в зависимости от результатов микробиологического исследования отделяемого со слизистых ВДП и ЖКТ.
Статистический анализ
Статистическую обработку результатов исследования проводили с помощью пакета статистического анализа IBM SPSS Statistics version 23 (США). Проверку нормальности распределения оценивали с помощью критерия Колмогорова–Смирнова с поправкой Лиллиефорса. В группах отмечалось распределение, отличное от нормального, при оценке различий количественных переменных использовался непараметрический U-критерий Манна–Уитни. Результаты представлены как медиана (Ме) и интерквартильный размах 25-й–75-й процентили, минимальное и максимальное значения (Min–Max). Различия считали значимыми при уровне значимости p<0,05. При анализе номинальных переменных применялись критерий χ2 Пирсона с поправкой Йетса, точный критерий Фишера при малом количестве наблюдений, расчет относительного риска (ОР). Для оценки информативности диагностических методов использовали операционные характеристики: чувствительность (Se), специфичность (Sp), прогностическая значимость положительных результатов (PPV), прогностическая значимость отрицательных результатов (NPV).
Результаты
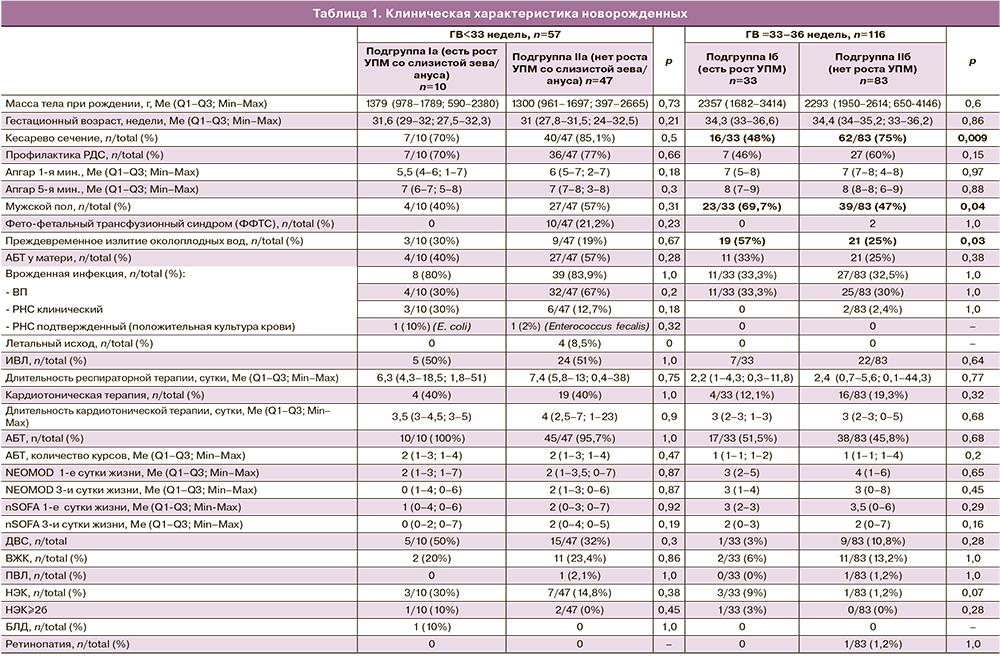
Сравниваемые подгруппы новорожденных не различались по антропометрическим данным, оценкам по шкалам Апгар, NEOMOD и nSOFA. Недоношенные дети ГВ<33 недель чаще рождались путем операции кесарева сечения, чем дети ГВ 33–36 недель (82 и 67%). Доля младенцев, родившихся путем операции кесарева сечения, не различалась в подгруппах глубоконедоношенных новорожденных. В группе детей ГВ 33–36 недель доля детей, родившихся в ходе оперативного родоразрешения, была статистически значимо ниже среди новорожденных, имевших отрицательные посевы в 1-е сутки жизни, сравнении с новорожденными, имевшими рост УПМ в отделяемом со слизистых ВДП и ЖКТ.
Охват антенатальной стероидной профилактикой в подгруппах новорожденных был сопоставим. В подгруппе детей IIб (ГВ<33 недель без роста УПМ) отмечено 4 летальных исхода у глубоконедоношенных новорожденных (из них 2 детей с фето-фетальным трансфузионным синдромом, 1 – с тяжелым течением гемолитической болезни новорожденных, состояние после внутриутробного лечения) в результате полиорганной недостаточности на фоне течения РНС. В подгруппе детей с наличием роста УПМ в отделяемом ВДП и ЖКТ летальных исходов не было, однако различия между подгруппами не достигли статистической значимости. Частота развития осложнений неонатального периода, таких как: НЭК, ВЖК, ПВЛ, ретинопатия недоношенных, БЛД в сравниваемых подгруппах не отличалась. Анализ длительности госпитализации, респираторной терапии и кардиотонической терапии произведен без учета показателей умерших детей. Клиническая характеристика пациентов исследуемых групп приведена в таблице 1.
Анализ данных микробиологического обследования новорожденных ГВ<33 недель
Положительная гемокультура была выявлена у 1 ребенка среди новорожденных подгруппы Iа (ГВ<33 недель) (10%), при этом отмечалось совпадение вида УПМ (Escherichia coli) в гемокультуре и в посевах отделяемого со слизистой ВДП и ЖКТ. В подгруппе IIа также у 1 новорожденного (2,1%) была получена положительная гемокультура, представленная Enterococcus fecalis, тогда как из нестерильных локусов роста УПМ обнаружено не было. Таким образом, в единственном случае одновременного получения положительного результата посева крови и нестерильных локусов был выделен идентичный штамм УПМ.
Частота выявления положительных культур отделяемого со слизистой ВДП и ЖКТ составила 17,5% (10/57). УПМ, наиболее часто определяемыми микроорганизмами при исследовании отделяемого ВДП и ЖКТ у новорожденных ГВ менее 33 недель являлись грибы рода Candida, E. coli, и Staphylococcus epidermidis, изолированно или в ассоциации с другими микроорганизмами (рис. 2).
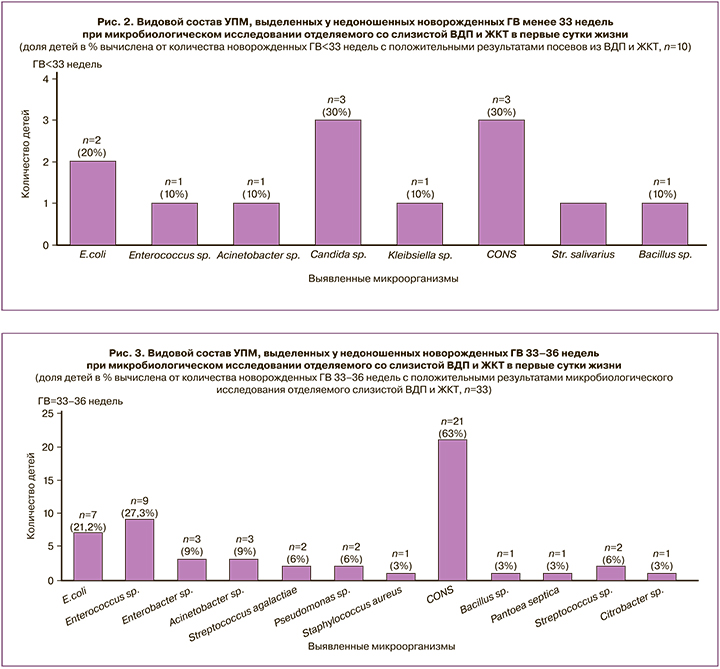
Рост грибов рода Candida при микробиологическом исследовании отделяемого слизистой ВДП и ЖКТ отмечен у 3 пациентов и во всех случаях сопровождался развитием врожденных инфекций: клинический РНС, ВП, инвазивный кандидоз кишечника и кожи. При этом посев крови на стерильность во всех случаях был отрицательным. Выделение Escherichia coli из нестерильных локусов отмечалось у 2 детей из 10 новорожденных подгруппы Ia и также сопровождалось развитием врожденных инфекций в обоих случаях: ВП и ранний неонатальный микробиологически подтвержденный E. coli-сепсис. Выявление роста Staphylococcus epidermidis (коагулазонегативные cтафилококки/coagulase negative staphylococci, CONS) в 2 случаях из 3 ассоциировалось с развитием врожденной пневмонии.
Однако следует отметить, что развитие РНС и пневмонии наблюдалось с той же частотой и у новорожденных с отрицательными результатами первичных посевов из ВДП и ЖКТ. Проведенный регрессионный анализ не выявил статистически значимой взаимосвязи между развитием ранних неонатальных инфекций и положительными результатами микробиологических исследований отделяемого ВДП и ЖКТ в 1-е сутки жизни.
Далее мы провели анализ результатов без учета новорожденных, при микробиологическом исследовании которых определялись лишь бактерии-комменсалы (CONS, альфагемолитические стрептококки, Bacillus sp., негемолитические стрептококки и др.) [21, 22]. Таким образом, после корректировки количество пациентов в подгруппе детей ГВ<33 недель с положительными результатами микробиологического исследования отделяемого слизистых ВДП и ЖКТ составило 7 человек. Соответственно, доля детей, колонизированных с рождения УПМ (E. coli, Candida sp., K. pneumoniae, Acinetobacter sp., Enterococcus faecium) в подгруппе детей ГВ<33 недель составила 12,2% (7/57), а распределение микроорганизмов в посевах со слизистой ВДП и ЖКТ было представлено следующим образом: Candida sp. – 3/7 (43%), E. coli – 2/7 (29%), E. faecium – 1/7 (14%), Acinetobacter sp. – 1/7 (14%), K. pneumoniae – 1/7 (14%). У 1 из 7 детей, имевших положительные посевы, отмечена микробная ассоциация – E. coli + Candida sp. При анализе зависимости ранних неонатальных инфекций от наличия роста УПМ в посевах со слизистой ВДП и ЖКТ без учета микроорганизмов-комменсалов было выявлено, что частота РНС (клинического и микробиологически подтвержденного) была статистически значимо выше в подгруппе детей с положительными результатами микробиологических исследований по сравнению с новорожденными с отсутствием роста отделяемого со слизистой ротоглотки и ЖКТ: 4/7 vs 7/50 (p=0,02). Результаты представлены в таблице 2. При этом следует отметить высокий уровень специфичности Sр (93,5%) и прогностической ценности отрицательных результатов NPV (86%) в отношении реализации РНС.
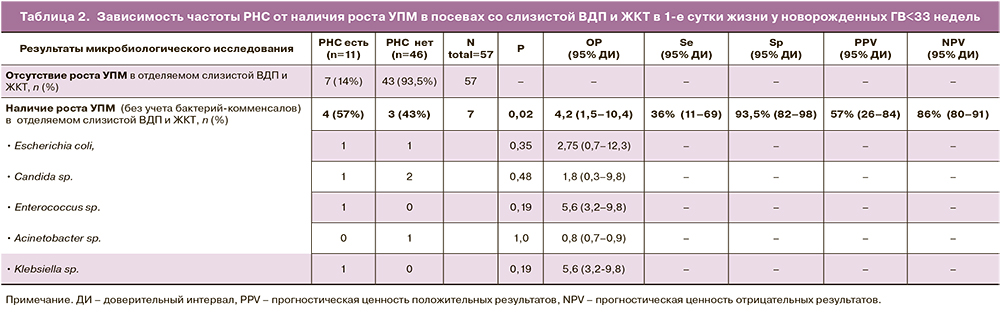
Частота осложнений неонатального периода, а также оценка степени тяжести состояния по шкалам nSOFA, NEOMOD у новорожденных исследуемых подгрупп на 1-е и 3-и сутки жизни не различались. При сравнении уровней маркеров системного воспалительного ответа в подгруппах обратил на себя внимание более высокий уровень СРБ на 3-и сутки жизни: у новорожденных подгруппы Ia с наличием роста УПМ: Me=2,7 мг/л, Q1–Q3 1,6–23,4 vs Me=0,95 мг/л, Q1–Q3 0,33–5,0 у новорожденных подгруппы IIa с отсутствием роста УПМ в отделяемом со слизистых ротоглотки и прямой кишки, р=0,008. Уровни лейкоцитов, нейтрофилов, тромбоцитов на 1-е и 3-и сутки жизни между подгруппами не различались.
Анализ микробиологических данных в подгруппе новорожденных ГВ 33–36 недель
Спектр УПМ, выделенных в микробиологических исследованиях со слизистой ВДП и ЖКТ у новорожденных ГВ 33–36 недель, представлен на рисунке 3.
Положительных гемокультур в данной подгруппе детей не было выявлено. Частота выявления роста микроорганизмов в отделяемом со слизистой ротоглотки и прямой кишки составила 28,5% (33/116), что значительно выше, чем у новорожденных ГВ<33 недель (17,5%). Обращало на себя внимание существенно большее видовое разнообразие УПМ у новорожденных, родившихся позднее 33-й недели гестации, что связано с бóльшим количеством новорожденных, родившихся через естественные родовые пути среди детей данного ГВ. Рост УПМ при микробиологическом исследовании отделяемого ВДП и ЖКТ отмечен у 16/78 (20%) детей, родившихся путем операции кесарева сечения, в то время как при родоразрешении через естественные родовые пути – у 17/38 (45%) (р=0,009). Также при родоразрешении через естественные родовые пути у новорожденных значительно чаще отмечался рост E. coli (5/38 (13%) vs 2/78, p=0,04) и микробных ассоциаций (11/38 (64%) vs 5/78 (32%), p=0,003). Рост стрептококка группы B (Streptococcus agalactiae) обнаружен лишь у новорожденных от самопроизвольных родов.
При анализе данных микробиологического исследования без учета микроорганизмов, относящихся к бактериям-комменсалам [21, 22] частота выявления роста УПМ в отделяемом со слизистых ВДП и ЖКТ составила 17,2%. Различий в частоте РНС, ВП, изучаемых осложнений неонатального периода в зависимости от наличия или отсутствия роста УПМ в отделяемом ВДП и ЖКТ выявлено не было. Также не было отмечено принципиальных отличий в тяжести клинического состояния детей в раннем неонатальном периоде, что подтверждается отсутствием статистически значимой разницы в оценках по шкалам NEOMOD, nSOFA. Не было обнаружено значимых различий в степени выраженности системной воспалительной реакции (абсолютное количество лейкоцитов, нейтрофилов, тромбоцитов, значения нейтрофильного индекса и СРБ) на 1-е и 3-и сутки жизни между сравниваемыми подгруппами Iб и IIб.
С целью выявления зависимости частоты ранних неонатальных инфекций, а также развития их осложнений, от выявления тех или иных УПМ в посевах отделяемого слизистой ВДП и ЖКТ в 1-е сутки жизни, проведен анализ относительного риска. УПМ оценивались в качестве предикторов/факторов риска реализации заболеваний по отдельности и ассоциациями. Для подгруппы новорожденных ГВ 33–36 недель статистически значимая прогностическая значимость получена исключительно в отношении E. coli и НЭК. Доля детей, у которых в последствии развился НЭК, составила 3/33 (9%) в подгруппе детей Iб (с наличием роста УПМ) vs 1/83 (1,2%) в подгруппе IIб (с отсутствием роста УПМ). Рост E. coli в 1-е сутки жизни в посевах со слизистой ВДП и ЖКТ отмечен у 2/4 новорожденных с НЭК и явился независимым фактором, ассоциированным с развитием данного осложнения (р=0,01). При этом риск реализации НЭК у детей с отрицательными результатами посевов был в 15,6 раз ниже по сравнению с детьми с наличием колонизации E. coli с рождения (ОР=15,6 (95% ДИ 2,6–91), NPV – 98%, прогностическая ценность положительных результатов (PPV) – 50%, р=0,018.
Анализ всех случаев НЭК у недоношенных новорожденных ГВ 24–36 недель
Принимая во внимание повышенный риск возникновения НЭК у недоношенных новорожденных, а также руководствуясь данными ряда исследований о взаимосвязи неконтролируемого роста условно-патогенной микрофлоры с развитием НЭК, нами был проведен дополнительный этап анализа с целью выявления УПМ, колонизация которыми с 1-х суток жизни может быть потенциально ассоциирована с развитием данного осложнения неонатального периода.
В данном исследовании развитие НЭК I–III стадий отмечено у 15/173 (8,6%) новорожденных, 11 из которых родились ранее 33-й недели беременности, 4 – на сроках 33–36 недель гестации. Частота развития НЭК составила 11/57 (19%) у детей ГВ<33 недель и 4/116 (3,4%) у детей ГВ 33–36 недель. Распределение детей с НЭК по степени тяжести представлено следующим образом: НЭК Iа-б – 5/15, НЭК IIа – 7/15, НЭК IIб – 1/15, НЭК IIIб – 2/15. Таким образом частота НЭК ≥2б стадии среди всех недоношенных составила 1,7% (3/173). Оперативное вмешательство по поводу перфорации кишечника потребовалось 2 детям с НЭК (13%, 2/15). В 3 случаях реализация данного осложнения отмечалась у новорожденных с наличием роста E. coli в высоком титре 107 КОЕ в посевах со слизистых ВДП и ЖКТ. Взаимосвязь выявления E. coli и развития НЭК была статистически значимой (ОР=4,8 (95% ДИ 1,6–14,7), р=0,03) (табл. 3). При анализе способа родоразрешения было выявлено, что двое из указанных трех детей родились путем самопроизвольных родов, что, согласно приведенным выше данным, влияет на частоту ранней колонизации слизистых новорожденных в 1-е сутки жизни. Еще одним УПМ, с которым статистически значимо ассоциировалось развитие НЭК, являлись дрожжеподобные грибы рода Сandida (ОР=9,6 (95% ДИ 3,5–26,7), р=0,02) (табл. 3). Результаты исследования показали высокие значения Sр и NPV для E. coli и Candida sp. (99,2 и 93%; 95,3 и 93%, соответственно) (табл. 3).
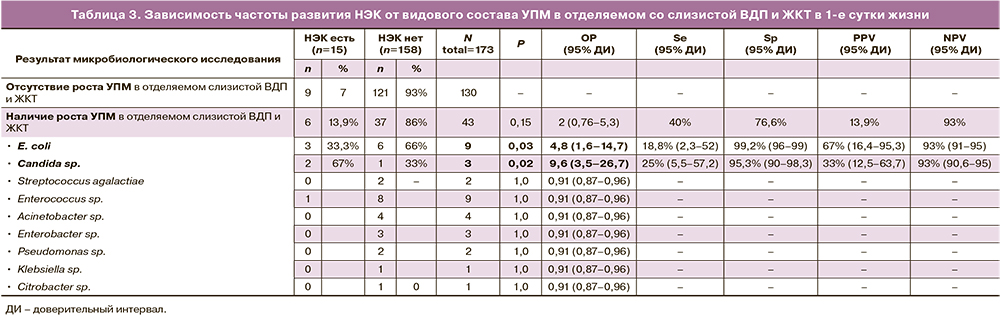
Сам по себе положительный результат посева со слизистых ВДП и ЖКТ в 1-е сутки жизни не влиял на частоту НЭК, также, как и выявление других УПМ, кроме E. coli и Candida sp.
Анализ чувствительности УПМ, выявленных при микробиологическом исследовании отделяемого со слизистой ВДП и ЖКТ в 1-е сутки жизни, к антибактериальным и противогрибковым препаратам
Микробиологическое обследование новорожденным в данной работе проводилось в 1-е сутки жизни, и соответственно, особый клинический интерес представляли данные о чувствительности УПМ к стартовой АБТ (ампициллин и гентамицин), комбинация которых использовалась в качестве эмпирической схемы лечения детей при подозрении на врожденную инфекцию. В данный анализ вошли результаты микробиологического исследования без учета случаев выделения штаммов УПМ, относящихся к бактериям-комменасалам (CONS, альфагемолитические стрептококки, Bacillus sp., негемолитические стрептококки).
E. coli была выявлена у 9 пациентов, и в 6 случаях имела чувствительность как к ампициллину, так и к гентамицину. В 3 случаях – резистентна к ампициллину, но в 100% случаев чувствительна к гентамицину.
Candida sp. У 3 детей при первичном микробиологическом обследовании был выявлен рост грибов рода Candida (2 – Candida albicans, 1 – Candida parapsilosis). У 1 ребенка из 3 Candida albicans была резистентна к флуконазолу и чувствительна к микафунгину и амфотерицину В. В приведенном случае результаты микробиологического обследования глубоконедоношенного ребенка в сочетании с клинико-лабораторными признаками течения инфекционного процесса явились объективными источниками информации, на основании которых была своевременно назначена таргетная противогрибковая терапия.
Рост Enterococcus sp. выявлен у 10 недоношенных детей, при этом в 80% случаев определялась чувствительность к ампициллину и гентамицину. Однако у 2/10 пациентов отмечался рост Enterococcus faecium, чувствительного исключительно к ванкомицину и линезолиду, что в совокупности с клиническими данными послужило основанием для смены стартовой схемы АБТ.
Резистентных к гентамицину штаммов Acinetobacter sp., Enterobacter sp., Klebsiella pneumoniae, Citrobacter freundii в настоящем исследовании выявлено не было.
Streptococcus agalactiae выявлен у 2 детей с чувcтвительностью к антибиотикам пенициллинового ряда. Данные о чувствительности представлены на рис. 4.
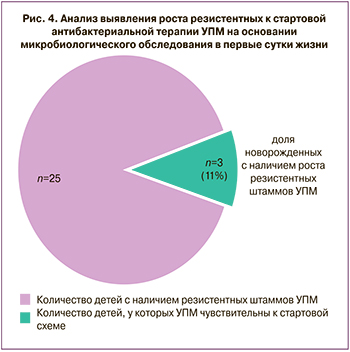
Количество новорожденных, у которых был получен рост резистентных к стартовой АБТ УПМ, составило 11% (3 ребенка – Enterococcus fecalis+Candida albicans; 1 ребенок – Enterococcus faecalis; 1 ребенок – Pseudomonas oryzihabitans). Двум новорожденным ГВ 32 недели с течением ВП потребовалась смена АБТ в первые 72 ч жизни в связи с клинико-лабораторными данными неэффективности стартовой схемы АБТ, что было осуществлено с учетом имеющихся результатов их первичного микробиологического обследования.
Обсуждение
Основной целью настоящей работы было определение прогностической и диагностической значимости микробиологического исследования отделяемого со слизистых оболочек ВДП и ЖКТ в 1-е сутки жизни у недоношенных новорожденных, поступающих в ОРИТН в отношении развития ранних неонатальных инфекций.
В ходе данного исследования показано:
Обнаружение роста УПМ (E. coli, Candida sp., Klebsiella sp., Enterococcus sp.), ассоциировано с более высоким риском развития РНС и системного врожденного кандидоза у новорожденных ГВ<33 недель и сопровождается более высоким уровнем СРБ на 3-и сутки жизни.
У детей более старшего ГВ – 33–36 недель факт наличия роста УПМ в посевах отделяемого со слизистых оболочек ВДП и ЖКТ в 1-е сутки жизни не являлся статистически значимым прогностическим фактором развития ранних неонатальных инфекций и не влияет на тяжесть состояния новорожденных и показатели летальности.
Более высокая частота НЭК у недоношенных новорожденных с наличием роста E. coli и/или Candida sp. со слизистых оболочек ВДП и ЖКТ в 1-е сутки жизни.
Для сравнения полученных результатов нами был проведен поиск релевантных отечественных и зарубежных исследований.
В настоящее время одним из наиболее масштабных исследований в области эпидемиологии и этиологии РНС является работа B. Stoll et al. [5], в которую были включены 217 480 новорожденных, в том числе 30879 недоношенных из 18 родовспомогательных учреждений США. В нем приведена детализация выявленных в образцах крови УПМ в зависимости от ГВ и массы тела детей при рождении, представлены результаты анализа гемокультур отдельно для доношенных и недоношенных пациентов. Наиболее часто выявляемыми возбудителями РНС у недоношенных новорожденных по данным B. Stoll et al. являются E. coli (51%) и Streptococcus group B (GBS, 13%), далее следуют Haemophylus sp. (5,3%), Klebsiella sp. (5,3%), Candida albicans (3,1%), что согласуется с результатами нашего исследования. Несмотря на то, что выделение положительной гемокультуры считается стандартом диагностики РНС, во всех исследованиях, включая проведенное нами, частота положительных гемокультур крайне низка: в исследовании В. Stoll среди недоношенных она составила 0,42% и была обратно пропорциональна ГВ: при ГВ 22–28 – 1,84%, ГВ 29–33 – 0,62% и 0,07% при ГВ 34–36 недель, соответственно.
В настоящем исследовании частота положительных гемокультур в 1-е сутки жизни составила 1,16% (2/173) среди всех недоношенных и 3,5% (2/57) в подгруппе новорожденных ГВ<33 недель. Положительные результаты исследования гемокультуры были отмечены только среди детей ГВ<33 недель: E. coli (1 ребенок) и Enterococcus faecalis (1 ребенок). Выявленная нами в исследовании частота положительных гемокультур несколько выше значений, приводимых другими учеными (0,37% или 3,71 на 1000 живорожденных среди всех недоношенных детей ГВ 22–36 недель и 1,1% среди детей с очень низкой массой тела), что, вероятно, обусловлено включением в данное исследование исключительно пациентов ОРИТН [23]. Низкая выявляемость возбудителей в посевах крови на стерильность, возможно, объясняется невысоким уровнем бактериемии у новорожденных, предшествовавшей АБТ у матери, чувствительностью микроорганизмов к условиям культивирования, невозможностью повторных отборов проб крови и сбора образцов крови большого объема из-за риска флеботомических потерь.
Анализируя полученную нами несколько более высокую частоту выявления УПМ в культурах крови у недоношенных новорожденных, следует отметить, что данный показатель, вероятнее всего, обусловлен особенностями структуры пациентов Центра как медицинской организации IIIб уровня с преобладанием пациенток с крайне отягощенным соматическим и акушерско-гинекологическим анамнезом, поступающих из различных регионов РФ, и, как правило, нуждающихся в длительном пребывании в стационаре. Также относительно высокая частота положительных гемокультур может быть обусловлена рядом, факторов, зависящих от технологии и методологии проведения микробиологического обследования [24, 25], а именно:
1) Объем исследуемого материала. Доказано, что чувствительность посева крови на стерильность уменьшается на 10–40% при использовании 0,5 мл крови по сравнению с 1,0 мл [7, 26]. Для выявления бактериемии с высокой концентрацией УПМ в большинстве случаев достаточно 0,5 мл. Однако при низкой концентрации возбудителя (менее 4 КОЕ в мл) для его идентификации необходим объем крови не менее 1,0 мл.
2) Стандарты культивирования и пробоподготовки, особенности применяемых селективных сред.
3) Использование дополнительных методов идентификации, таких как: полимеразная цепная реакция (ПЦР) в режиме реального времени, инновационые протеометрические методы – матрично-активированная лазерная дезорбционная/ионизационная времяпролетная масс-спектрометрия (Matrix-Assisted Lazer Desorption/Ionization Time-of-Flight Mass Spectrometry, MALDI-TОF-MS), а также методы, основанные на применении таргетного и полногеномного секвенирования [27].
Важно отметить, что в нашем исследовании использование оптимального объема анализируемого биоматериала, а также высокотехнологичных методов идентификации УПМ методом прямой MALDI-TОF-MS в положительной гемокультуре повышало чувствительность метода, и, главное, скорость выполнения микробиологического исследования.
Заслуживает отдельного упоминания факт выявления идентичных штаммов УПМ в гемокультуре и посевах со слизистых оболочек ротоглотки и прямой кишки. Это согласуется с результатами работы A. Berger et al. [4]: у детей с положительными гемокультурами штаммы УПМ, выделенные из крови (E. coli и Listeria monocytogenes), на 100% совпадали со штаммами, которые обнаруживались в посевах из нестерильных локусов, что может иметь клиническое значение для выбора комбинации антимикробных препаратов.
Большинство ранее проведенных исследований 80–90-х гг. предыдущего столетия продемонстрировали отсутствие прогностической ценности микробиологических исследований нестерильных локусов в отношении развития раннего неонатального сепсиса [4, 28–30]. Однако, следует учитывать их методологическую неоднородность, а также то, что большая часть работ выполнена с использованием исключительно стандартных микробиологических методов. В связи с этим проведение сравнения полученных нами данных с результатами этих исследований представляется затруднительным. Следует также отметить, что подавляющем большинстве работ отсутствует анализ результатов микробиологических исследований в зависимости от ГВ новорожденных, хотя это критически важно с учетом доказанных различий колонизационной резистентности слизистых оболочек и особенностей иммунного ответа при взаимодействии с УПМ в зависимости от степени зрелости плода и новорожденного [4, 23, 29, 31–35].
Наиболее современной публикацией, максимально схожей по дизайну и методам с нашей работой, является исследование, выполненное под руководством A. Berger в 2004 г. [4], в которое вошли недоношенные новорожденные ГВ менее 34 недель (n=221), родившиеся в результате операции кесарева сечения. Используемые микробиологические методы включали культивирование микрофлоры на специальных питательных средах, в том числе пригодных для идентификации Ureaplasma urealyticum и Mycoplasma hominis, но идентификация УПМ проводилась без использования протеометрических методов. Биологический материал для культурального исследования содержал образцы амниотической жидкости, плацентарной мембраны, а также 2 мазка/посева отделяемого из наружного слухового прохода и/или ротоглотки, и/или кожи. Частота микробиологически подтвержденного сепсиса в этом исследовании составила 1% (2/198) среди всех обследованных детей ГВ<34 недель. При этом медиана ГВ детей с сепсисом составила 29,3 недели по сравнению с 31 неделей ГВ в подгруппе a) нашего исследования. Частота клинического (не подтвержденного микробиологически) сепсиса составила 24,4% (48/198) по сравнению с 15,7% (9/57) в нашем исследовании в подгруппе детей ГВ<33 недель. Однако следует отметить, что в своей работе А. Berger et al. использовали критерии клинического сепсиса, принятые до момента публикации дефиниций экспертного собрания (Лондон, 2010) [4, 14]. Общая частота сепсиса, представленная в статье A. Berger et al., составила 50/198 (25,2%), что также несколько выше, чем в нашей работе – 11/57 (19,2%). Рост УПМ в посевах кожи и/или со слизистой ротоглотки обнаруживался в 17,2% случаев (34/198). Наиболее часто идентифицируемыми УПМ явились U. urealyticum (68%, 23/34), стрептококк группы В (Streptococcus agalactiae) (8,8%, 3/34) и E. coli (5,9%, 2/34). Поверхностные посевы анализировались без учета бактерий-комменсалов (CONS, альфагемолитические стрептококки, Bacillus sp. и др.) [21]. В нашей работе идентификация уреаплазмы не проводилась; при сравнении частоты положительных посевов без учета уреаплазмы и бактерий-комменсалов количество положительных результатов в нашем исследовании почти в 2 раза превышало таковое в исследовании A. Berger: 12,2% (7/57) vs 5,5% (11/198).
В работе A. Berger обнаружение роста УПМ в поверхностном биоматериале детей не выявило взаимосвязи с реализацией РНС и было признано экономически нецелесообразным. По сравнению с посевами с поверхности кожи, рост УПМ значительно чаще обнаруживался при исследовании амниотической полости: суммарно – 38%, 85/221 (отдельно амниотических оболочек – 34%, амниотической жидкости – 19,2%, оболочек плаценты – 26%), и статистически значимо ассоциировался с развитием РНС у новорожденных (ОШ=6,1 высокая прогностическая значимость отрицательных результатов NPV=84,1% и относительно низкая прогностическая значимость положительных результатов PPV=57,1%). Авторы подчеркивают, что, несмотря на то, что самым частым УПМ в амниотической полости, также, как и при исследовании посевов с поверхности кожи, являлась U. urealyticum (65%, 56/85), наиболее выраженная корреляция с развитием РНС отмечалась при выявлении других УПМ (E. coli, Streptococcus group B, Enterococcus sp., Candida sp. и др.). АБТ новорожденным проводилась препаратами ампициллин+гентамицин и не включала макролиды.
Видовой состав УПМ, распределение и частота положительных результатов выделения УПМ в поверхностных посевах в нашем исследовании отличались от таковых у А. Berger et al., что отчасти можно объяснить методологическими различиями (в исследование А. Berger были включены только дети после операции кесарева сечения, не исследовались посевы из ануса, а только с поверхности кожи и ушной раковины, имелись различия в применяемых микробиологических методах. В задачи нашего исследования не входил анализ АБТ матерей до родоразрешения, а также интранатальной антибиотикопрофилактики инфекций, вызванных стрептококком группы В, что также могло оказать влияние. Согласно крупным эпидемиологическим исследованиям, распределение УПМ, определяемых в гемокультурах недоношенных детей в раннем неонатальном периоде, изменилось за последние 10–15 лет на фоне внедрения профилактики инфекции, вызванной стрептоккокком группы В. Несмотря на то, что частота сепсиса, ассоциированного со стрептококком группы В, значительно сократилась, отмечается рост числа случаев E. coli-сепсиса (8,68 на 1000 родившихся живыми в 2017 г. по сравнению с 5,07 в 2009 г., р=0,008). При этом наиболее тревожным является факт увеличения доли резистентных штаммов E. coli. Отсутствие чувствительности и к ампициллину, и к гентамицину отмечена в 7,8% случаев. Резистентность к гентамицину выросла за последние годы с 3 до 11% [5, 36].
Выявление дрожжевых грибов рода Candida преимущественно у недоношенных новорожденных ГВ<33 недель, наиболее вероятно, ассоциировано с длительной госпитализацией матерей в акушерском стационаре и множественными курсами АБТ, направленными на лечение акушерских инфекций, однако требует дальнейшего детального изучения.
Значимым результатом нашего исследования является статистически значимая связь обнаружения E. coli и Candida sp. при микробиологическом исследовании посевов со слизистых ВДП и ЖКТ в 1-е сутки жизни у всех недоношенных детей ГВ 24–36 недель с более высоким риском последующего развития НЭК, что может быть объяснено выраженной незрелостью иммунной системы, избыточной активацией TLR4, а также низкой колонизационной резистентностью слизистых оболочек недоношенных новорожденных.
Взаимосвязь ранней (с 1-х суток жизни) колонизации E. coli слизистых ВДП и ЖКТ с последующим развитием НЭК у новорожденных в настоящее время недостаточно изучена. Однако ассоциация выявления E. coli и НЭК в позднем неонатальном периоде хорошо известна [37, 38]. Кроме того, многочисленные современные гистологические исследования резецированных участков кишечника при НЭК у новорожденных и экспериментальных животных, доказывают, что чрезмерная бактериальная (E. coli) стимуляция рецепторов TLR4 вызывает высвобождение каскада провоспалительных цитокинов, активацию нуклеарного фактора-κB (NF-κB), запускает процессы апоптоза и некроптоза при НЭК, а бактериальная транслокация через слизистую оболочку кишечника активирует TLR4 на эндотелии кишечной сосудистой стенки, что приводит к снижению кровотока и развитию ишемии стенки кишечника и некроза [39–46].
Заключение
В ходе данной работы показана клиническая значимость микробиологического исследования отделяемого слизистых ВДП и ЖКТ в когорте глубоконедоношенных новорожденных, у которых обнаружение роста УПМ является статистически значимым фактором, ассоциированным с развитием РНС и сопровождается более высоким уровнем СРБ. Однако, указанная взаимосвязь отсутствует у детей ГВ>33 недель. Также, у недоношенных новорожденных с отрицательными результатами микробиологического обследования риск реализации НЭК значительно ниже по сравнению с новорожденными, чьи слизистые с рождения колонизированы E. coli и/или Candida sp.
В остальных случаях сам факт наличия роста УПМ в посевах отделяемого со слизистой ВДП и ЖКТ в 1-е сутки жизни не является статистически значимым фактором, ассоциированным с развитием инфекционного процесса у новорожденных, тяжестью состояния новорожденных и исходами.
Знания о видовом составе УПМ в посевах со слизистой ВДП и ЖКТ, а также в гемокультуре недоношенных новорожденных, информация об их чувствительности к антибактериальным и противогрибковым препаратам, являются незаменимым источником информации при выборе антимикробной терапии и определении ее длительности.
Таким образом, изучение спектра УПМ, колонизирующих слизистые оболочки недоношенных детей различного ГВ при рождении, с помощью современных микробиологических методов, является ценным инструментом для оценки риска развития ранних неонатальных инфекций и нуждается в дальнейшем изучении.
Вопрос об экономической целесообразности микробиологического исследования отделяемого слизистых ВДП и ЖКТ у всех недоношенных новорожденных также требует дополнительного изучения.
Сильные стороны и ограничения исследования
Ограничения данного исследования: 1) относительно небольшой объем выборки новорожденных ГВ<33 недель.
Сильные стороны: 1) использованы современные высокотехнологичные микробиологические методы; 2) проведен детальный анализ результатов микробиологического обследования недоношенных в зависимости от гестационного возраста; 3) выполнено сопоставление полученных данных с клиническими и лабораторными признаками инфекционного процесса, а также тяжестью состояния пациентов и развитием осложнений; 4) выявлена статистически значимая взаимосвязь выявления определенных УПМ на слизистой ЖКТ и ВДП с развитием РНС и НЭК; 5) актуализированы эпидемиологические данные о частоте выявления и видовом составе УПМ у недоношенных пациентов ОРИТН в раннем неонатальном периоде.
Направления для дальнейшего исследования: определение диагностической ценности и экономической целесообразности расширенного микробиологического исследования с использованием дополнительного биоматериала (амниотической жидкости, амниотических оболочек, амниотической мембраны плаценты); дальнейший анализ УПМ в отношении предикции НЭК.
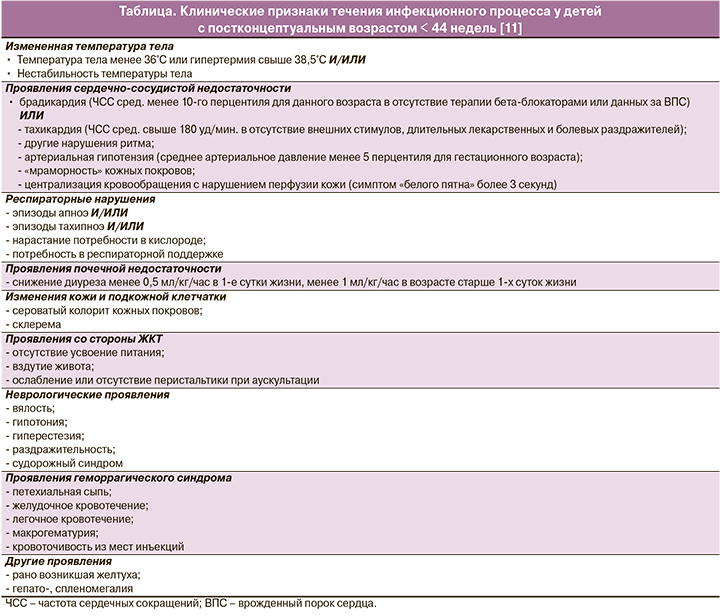
Приложение