Предимплантационная генетическая диагностика (ПГД) – это диагностика генетических нарушений эмбриона в рамках программы вспомогательных репродуктивных технологий (ВРТ) до его переноса в полость матки пациентки [1]. Обследование проводится с целью профилактики рождения больных детей у семейных пар с известными генетическими нарушениями, которые могут быть унаследованы их детьми. В настоящее время используется термин ПГТ-М – предимплантационное генетическое тестирование моногенных заболеваний [2]. Для ПГТ-М используются различные методики. Их можно разделить на два класса – прямые и непрямые методы исследования [3]. Прямые методы исследования способны обнаруживать непосредственное генетическое нарушение (генная или хромосомная мутация, являющаяся причиной развития заболевания). Однако использование только прямых методов исследования может быть недостаточным из-за эффекта «выпадения» аллелей (allele drop-out) [1].
Непрямые методы исследования не способны обнаруживать непосредственное генетическое нарушение, однако с их помощью возможно отследить наследование соответствующих участков хромосом от родителей. Классическим методом непрямой ПГТ-М является фрагментный анализ STR-маркеров. Он основан на анализе коротких тандемных повторов (STR, short tandem repeats) [4]. Данный подход также не лишен недостатков. Во-первых, для успешного тестирования необходимы разработка соответствующих методик и время на их валидацию. Во-вторых, как уже отмечалось выше, для каждого тестирования необходимо сразу несколько таких методик, так как, кроме проблемы выпадения аллеля, возможно, что часть маркеров будет неинформативной из-за совпадения у отца и матери.
В 2010 г. для проведения ПГТ-М был предложен универсальный метод, основанный на картировании однонуклеотидных полиморфизмов в родительских хромосомах, который получил название «кариомэппинг» [5]. За счет своих технологических особенностей данный метод позволяет проводить ПГТ-М очень быстро, а интерпретация результатов с его помощью относительно проста. Он может быть использован для тестирования любых семейных моногенных заболеваний без необходимости разработки и валидации пациент-специфического теста.
Метод представляет собой полногеномный сцепленный анализ, в котором несколько сотен тысяч единичных нуклеотидных последовательностей (SNP), разбросанных по всему геному, генотипированы у обоих родителей и эмбриона. Каждый регион хромосомы имеет уникальный SNP-отпечаток, позволяющий отслеживать наследование сегментов хромосом (или генов, которые они содержат) от одного поколения к другому. Путем сравнения результатов SNP члена семьи с установленным генетическим заболеванием с родительскими (т.е. другого родственника, несущего такую же мутацию) возможна идентификация мутантного гена за счет комбинации ассоциированных SNP-аллелей. В результате перенос эмбриона, несущего патологическую хромосому (определенную по SNP-локусам), проводиться не будет.
Кариомэппинг является дорогостоящим методом и описан лишь для одной платформы на базе биологических чипов фирмы Illumina, что ограничивает его повсеместное применение. Однако в настоящее время существует высокая клиническая потребность в подобных методах, не привязанных к ограниченному числу технологических платформ. Это привело к разработке ряда альтернативных методов на том же принципе [6, 7].
Целью данной работы были разработка и применение метода гаплотипирования с помощью SNP для ПГТ-М с использованием чипов Affymetrix Inc., США.
Материалы и методы
В лаборатории молекулярно-генетических методов Центра с помощью ПГТ были обследованы 23 семьи с моногенной патологией (у обратившихся пациентов, их детей или родственников). Характер патологии представлен в таблице 1. В связи с малым количеством поступившего для анализа материала (трофэктодермы) исследование начинали с применения методов полногеномной амплификации ДНК. Выбор метода зависел от применяемых в дальнейшем способов тестирования. При применении SNP-гаплотипирования использовали MDA (Qiagen, USA), в остальных случаях WGA-PCR (Picoplex, USA).
Тестирование представляло собой комплексный подход с одновременным применением ПГТ-М и ПГТ анеуплоидий (ПГТ-А). Для проведения ПГТ-М были использованы следующие методы: фрагментный анализ STR-маркеров, SNP-гаплотипирование, секвенирование по Сэнгеру, полимеразная цепная реакция (ПЦР) в реальном времени для анализа наиболее частых мутаций (например, F508del при муковисцидозе, GJB2: 35delG при врожденной нейросенсорной тугоухости). ПГТ-А осуществляли с помощью высокопроизводительного секвенирования (NGS) (ReproSeq™ PGS Kit Thermo Fisher Scientific, USA) и сравнительной геномной гибридизации на чипах (aCGH) (GenetiSure Agilent, USA).
Подход к SNP-гаплотипированию был разработан в рамках настоящего исследования. Пробоподготовка предоставленных образцов включала рестрикцию, лигирование с адаптерами, амплификацию, очистку ПЦР-продуктов, фрагментирование, мечение флуорофором в соответствии с протоколом производителя (Affymerix Inc., США). После прохождения образцами всех контролей качества, требуемых производителем, полученные образцы наносили на микрочипы высокого разрешения CytoScan 750К, после чего осуществляли ДНК-гибридизацию в течение 18 ч при температуре 50°С. В последующем проводили промывку и окрашивание микрочипов на приборе Fluidic Station 450 (ThermoFisher, США) и сканирование их с помощью Scanner 3000 7G (ThermoFisher, США). Результаты были проанализированы в программе Chromosome Analysis Suite (ChAS). В последующем были составлены списки генотипов по представленным на микроматрицах однонуклеотидным полиморфизмам (SNP-гаплотипам).
По данным генотипирования отца, матери и больного ребенка определяли ключевые позиции, по которым имелась возможность однозначно определить, какую из хромосом ребенок унаследовал от одного из родителей. Сравнение генотипов в блоках ключевых позиций заданного размера у больного и эмбрионов позволяло определить, одинаковые или разные фрагменты хромосом унаследованы от родителей, и выбрать эмбрионы, которым заболевание родителей не передалось.
Поскольку для определения наследования одновременно исследуется большое количество точек, то явление allele drop-out в отдельных точках не влияет на результат. Остальные методики осуществляли стандартным образом.
Результаты
Из результатов таблицы очевидно, что эуплоидных эмбрионов (n=55) было значительно меньше, чем всего направленных на тестирование (n=93). По данным ПГТ-А в наблюдениях 5, 11 и 22 проведение ПГТ-М было нецелесообразно, так как все эмбрионы явились анеуплоидными. В остальных 20 наблюдениях, где анализ был продолжен, перенос в полость матки оказался возможен только для 38 эмбрионов. Из них у 20 мутации отсутствовали, и 18 явились гетерозиготными носителями. В 14 наблюдениях из 23 (таблица) ПГТ-А было выполнено с использованием aCGH и в 9 – с применением NGS. Полученные данные свидетельствовали, что оба метода были информативными для выявления анеуплоидий в эмбрионах. Вместе с тем метод NGS позволяет, кроме того, получать информацию об уровне хромосомного мозаицизма.
Было установлено, что на результаты SNP-гаплотипирования оказывает влияние метод полногеномной амплификации. Валидные результаты могут быть получены только с помощью MDA. В процессе исследования установлено, что интерпретация результатов SNP-гаплотипирования более проста и надежна по сравнению с STR-анализом. Данная методика не требует индивидуальной разработки для каждого случая и является универсальной. Несмотря на применение в настоящей работе подтверждения результатов прямыми методами, SNP-гаплотипирование может быть использовано изолированно.
Приводим описание двух клинических наблюдений.
Наблюдение № 1
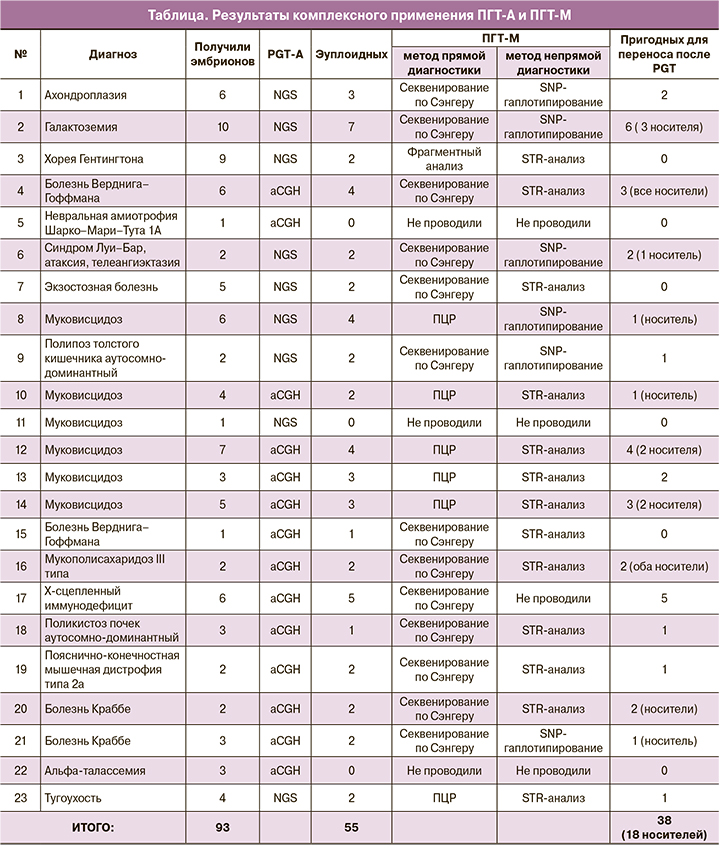
Пациентка Н., 22 лет, обратилась на консультацию в Центр для применения ВРТ в связи с наличием у супруга ахондроплазии. Ранее при молекулярно-генетическом анализе мужчины была выявлена мутация G1138A (Gly380Arg) в гене FGFR3 в гетерозиготном состоянии. Супруги были обследованы. Женщина фенотипически нормальная, соматически здоровая, менструальный цикл без особенностей. У мужчины – тератозооспермия. Случай ахондроплазии в семье единичный.
Учитывая высокий риск проявления у потомства ахондроплазии – 50% в связи с аутосомно-доминантным типом наследования, желание супругов провести ПГТ-М, супруги направлены под наблюдение репродуктологов и на молекулярно-генетическое обследование. По данным секвенирования у мужчины подтверждено наличие гетерозиготного носительства мутантного гена FGFR3 (Gly380Arg), у женщины мутация не выявлена. Секвенирование отца и матери мужчины также не выявило данную мутацию, что подтверждает ее возникновение de novo.
После клинического обследования и проведения программы экстракорпорального оплодотворения с использованием метода ИКСИ было получено 13 яйцеклеток и 6 эмбрионов – криоконсервированы. Было проведено косвенное ДНК-тестирование методом SNP-гаплотипирования. Установлено, что у эмбрионов 1, 3, 4, 6 один отцовский аллель гена FGFR3, у эмбрионов 2 и 5 – другой. Для валидации полученных результатов методом прямого секвенирования по Сэнгеру проведен поиск мутации Gly380Arg в гене FGFR3 у эмбрионов 1, 2, 3, 4, 5, 6. У эмбрионов 3 и 4 выявлена мутация Gly380Arg в гене FGFR3 в гетерозиготном состоянии, у эмбрионов 2 и 5 данная мутация не обнаружена, для эмбрионов 1 и 6 валидных данных получить не удалось.
 Таким образом, было установлено, что эмбрионы 1, 3, 4, 6 унаследовали мутацию Gly380Arg в гене FGFR3.
Таким образом, было установлено, что эмбрионы 1, 3, 4, 6 унаследовали мутацию Gly380Arg в гене FGFR3.
С целью исключения хромосомной патологии в представленных образцах трофэктодермы проводилось ПГТ-А методом aCGH (Agilent, USA). Сбалансированный генотип был обнаружен в материале эмбрионов 2, 5 и 6. В результате сочетанного применения ПГТ-М и ПГТ-А в рамках программы ЭКО не было выявлено противопоказаний к переносу в полость матки эмбрионов 2 и 5 (рис. 1). Пациентам была рекомендована пренатальная инвазивная диагностика при наступлении беременности для подтверждения результатов предимплантационного тестирования.
Произведен перенос одного эмбриона в полость матки. Беременность не наступила. Женщине предложена контрацепция с последующим переносом второго обследованного эмбриона. Однако через 4 месяца у женщины наступила самопроизвольная беременность. В связи с высоким риском рождения ребенка с ахондроплазией предложена инвазивная пренатальная диагностика; проведена в сроки беременности 11–12 недель с помощью трансабдоминального хориоцентеза – без осложнений.
Ткань хориона исследована цитогенетическим и молекулярно-генетическим методами. Было установлено: при цитогенетическом анализе – кариотип нормальный мужской: 46, ХY; при секвенировании – мутация в гене FGFR3 (Gly380Arg), в гетерозиготном состоянии аналогичная отцовской. В связи с наличием у плода мутации, ассоциированной с ахондроплазией, на консилиуме Центра женщине было рекомендовано прерывание беременности. Проведено прерывание беременности в 12–13 недель без осложнений. Предложена контрацепция с последующим переносом в полость матки обследованного эмбриона.
Наблюдение № 2
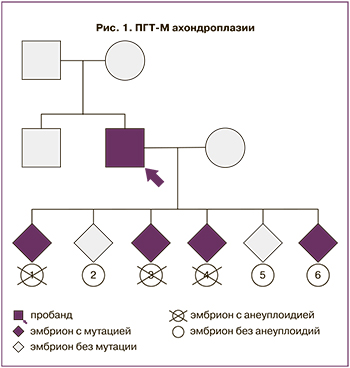
Пациентка Ж., 30 лет, обратилась на консультацию в Центр для применения ВРТ в связи с отсутствием беременности в течение 4 лет при регулярной половой жизни без контрацепции. В анамнезе срочные самопроизвольные роды. Родился живой доношенный мальчик, умерший на 17-е сутки в реанимационном отделении больницы. По данным вскрытия, у ребенка опухоль головного мозга, острая печеночная недостаточность, галактоземия. При исследовании его крови была выявлена мутация с.А563G(р.Q188R) в гомозиготном состоянии в гене GALT. Аналогичное нарушение в гетерозиготном состоянии выявлено у отца ребенка. У матери заподозрено носительство протяженной делеции в гене GALT. У нее была обнаружена гетерозиготная микроделеция участка короткого плеча 9 хромосомы с позиции 34646154 до позиции 34651207, захватывающая регион 9р13.3 с вовлечением гена GALT (аrr[hg19]9p13.3(34646154_34651207)х1).
Супруги обследованы в Центре. У женщины отклонений не обнаружено, у мужчины выявлена тератозооспермия. Противопоказаний к применению ВРТ не отмечено. При проведении у пациентки протокола ЭКО/ИКСИ получено 19 ооцитов и 10 эмбрионов. На полученном материале трофэктодермы проводили ПГТ-А с помощью NGS. У эмбрионов 6, 3 и 9 были выявлены различные хромосомные нарушения. В дальнейшем эти эмбрионы не использовались для проведения косвенного ДНК-тестирования.
Методом SNP-гаплотипирования было проведено косвенное ДНК-тестирование и установлено, что: у эмбрионов 11, 13 и 19 отсутствуют обе мутации; у эмбриона 14 присутствует мутация Q188R в гетерозиготном состоянии и отсутствует делеция; у эмбрионов 10 и 15 присутствует делеция в гетерозиготном состоянии и отсутствует мутация Q188R; у эмбриона 16 присутствуют обе мутации. Для валидации полученных результатов использовали ПЦР в реальном времени для детекции мутации Q188R. Мутация подтверждена у мужчины в гетерозиготном состоянии и у двух эмбрионов – в гомозиготном (эмбрион 16) и гетерозиготном (эмбрион 14) состоянии.
В результате сочетанного проведения ПГТ-М и ПГТ-А не было выявлено противопоказаний к переносу в полость матки в рамках программы ЭКО эмбрионов 11, 13 и 19 (нет искомых мутаций), а также эмбрионов 10, 14 и 15 (имеется только одна из мутаций в гетерозиготном состоянии, то есть они – носители аутосомно-рецессивной патологии, рис. 2). Пациентам было рекомендовано проведение пренатальной инвазивной диагностики в случае наступления беременности для подтверждения результатов ПГТ.
Обсуждение
Как уже было замечено выше, одного лишь прямого генетического тестирования для проведения ПГТ может быть недостаточно. Дело в том, что для работы с небольшим количеством биологического материала (единичные бластомеры, полярные тельца, образцы трофэктодермы) необходимо его амплифицировать (размножить) для того, чтобы в дальнейшем использовать уже эти продукты амплификации для исследования. Амплификация с каждой из родительских хромосом может идти с разной эффективностью, что может приводить к «выпадению» одного из аллелей (allele drop-out). При анализе такого «несбалансированного» амплификата возможны как ложноположительные ошибки (избирательная амплификация патогенного аллеля в гетерозиготном состоянии может привести к ошибочной интерпретации, что он находится в гомозиготном состоянии), так и ложноотрицательные. Это означает, что обнаружение гомозиготного состояния нормального аллеля может также случиться и при выпадении мутантного аллеля, но в случае тестирования аутосомно-рецессивных заболеваний перенос такого эмбриона в любом случае возможен, так как ребенок будет здоров. При обнаружении гомозиготного состояния мутантного аллеля такой эмбрион будет признан непригодным для переноса, хотя в случае выпадения нормального аллеля такой эмбрион был бы признан носителем и мог бы быть рекомендован к переносу. Таким образом, мы видим, что в случае ПГТ-М аутосомно-рецессивных заболеваний такое явление, как выпадение аллеля, не может приводить к переносу эмбрионов с двумя мутациями и к рождению больных детей, однако в ряде случаев возможна выбраковка гетерозиготных эмбрионов, которые могли бы быть перенесены [1].
Гораздо серьезнее ситуация с аутосомно-доминантными заболеваниями. С одной стороны, обнаружение гомозиготного состояния мутантного аллеля однозначно трактуется как основание для запрета переноса данного эмбриона. С другой стороны, обнаружение гомозиготного состояния нормального аллеля не является достаточным основанием для переноса данного эмбриона. Ведь в случае наличия выпадения мутантного аллеля у этого ребенка разовьется соответствующее заболевание. Таким образом, эффект выпадения аллеля при использовании одного лишь прямого генетического тестирования может приводить как к переносу эмбрионов с патогенными аллелями, так и к запрету переносов здоровых эмбрионов, являющихся носителями мутантного аллеля [3].
Для непрямого ПГТ-М в настоящее время, как правило, используется фрагментный анализ коротких тандемных повторов (STR, short tandem repeats) [4]. Он основан на том факте, что в геноме человека присутствуют так называемые STR, представляющие собой повторяющиеся последовательности из двух, трех, четырех и более азотистых оснований. Подобные повторы расположены практически по всему геному человека, и существует теоретическая возможность подобрать соответствующие маркеры практически для каждого исследуемого региона. В связи с тем, что данные маркеры различаются у разных людей, возможно, оценив их наличие в эмбриональной ДНК, определить, какая именно хромосома от отца или матери (содержащая или не содержащая патогенный аллель) попала в геном эмбриона. Таким образом, даже в случае невозможности детекции прямым методом наличия мутации в геноме эмбриона можно предсказать его генетический статус. Проблема выпадения аллеля также присутствует и в случае непрямого тестирования, однако возможно выбрать сразу несколько маркеров и проводить тестирование сразу по нескольким из них. По совокупности полученных результатов можно сделать комплексный вывод о генетическом статусе исследуемого эмбриона [6].
Главным достоинством гаплотипирования с помощью SNP для ПГТ-М является универсальность данного подхода. Как видно из приведенных выше примеров, данный подход может быть применен к различным генетическим заболеваниям. Нет необходимости для подбора и тестирования специфических STR-маркеров в зависимости от исследуемой патологии, усложняющей и замедляющей проведение анализа. Интерпретация результатов ПГТ унифицирована, что уменьшает вероятность выдачи ошибочных результатов. Главным же недостатком метода является на сегодня лишь его высокая стоимость, обусловленная необходимостью проведения хромосомного микроматричного анализа для каждого исследуемого образца, включая образцы эмбрионов, родителей и больных родственников. Вместе с тем очевидно, что, учитывая скорость развития современных технологий в ближайшей перспективе, снижение себестоимости данного подхода позволит охватить им значительное число пациентов, обращающихся за ПГТ-М.
Даже при условии использования гаплотипирования с помощью SNP для ПГТ-М нельзя полностью отказываться и от прямого тестирования, так как в ряде случаев (в том числе и при аутосомно-доминантном наследовании) генетический статус эмбрионов невозможно определить только лишь с помощью непрямого тестирования. Однако, по нашим данным, применение прямых методов не всегда давало возможность получить ожидаемые результаты из-за эффекта «выпадения» аллелей (allele drop-out), чего не наблюдалось при использовании SNP-гаплотипирования.
Тестирование для обнаружения анеуплоидий у эмбрионов пациенток в программах ВРТ (с дальнейшим использованием только нормальных), как было показано в ряде работ, приводит к увеличению шансов на прогрессирующую беременность, а также снижает риски невынашивания и рождения детей с анеуплоидиями. Следовательно, сочетание тестирования моногенных генетических заболеваний со скринингом анеуплоидий улучшает клиническую результативность ПГТ.
Заключение
Результаты данной работы свидетельствуют, что пациентам, обращающимся за проведением ПГТ М, также рекомендовано и одновременное проведение ПГТ-А, так как в любой возрастной группе пациенток существует риск наличия в их эмбрионах анеуплоидий. Проведение одного лишь ПГТ-М не гарантирует перенос эмбриона без хромосомной патологии.
Представляется оптимальной следующая универсальная схема проведения ПГТ.
1. Полногеномная амплификация с использованием метода MDA на полученном материале.
2. Проведение ПГТ-А с помощью NGS для получения данных о хромосомном статусе эмбрионов.
3. При наличии эуплоидных эмбрионов – гаплотипирование с помощью SNP.
4. Валидация результатов путем прямого тестирования мутации (опционально).
5. Анализ полученных данных и выписка заключения о возможности переноса протестированных эмбрионов.
Внедрение в клиническую практику разработанного в рамках данной работы подхода позволит увеличить доступность ПГТ для пациентов за счет увеличения скорости и надежности исследования.



