Синдром поликистозных яичников (СПКЯ) относится к числу наиболее распространенных эндокринных нарушений у женщин репродуктивного возраста. Согласно 3-му консенсусу по здоровью женщин с СПКЯ, его частота в общей популяции составляет 6–20% [1]. СПКЯ характеризуется функциональной яичниковой гиперандрогенией (ГА) и гиперсекрецией АМГ, ассоциированными с репродуктивными нарушениями (овуляторной дисфункцией и бесплодием), а также с метаболическими расстройствами (ожирением, инсулинорезистентностью (ИР), гиперинсулинемией (ГИ), нарушением толерантности к глюкозе (НТГ), дислипидемией).
Высокая частота ГИ, нарушений углеводного обмена, их взаимосвязь с яичниковой ГА и ановуляцией послужили основанием для применения инсулиносенситайзеров в качестве альтернативной терапии СПКЯ. Наиболее изучено действие метформина (МФ). Считается, что коррекция репродуктивных нарушений на фоне терапии МФ опосредована повышением чувствительности тканей к инсулину, подавлением секреции инсулина В-клетками поджелудочной железы, нормализацией пиковой секреции ЛГ и снижением инсулин-зависимого синтеза андрогенов в клетках теки [2]. Имеются данные о том, что МФ способен оказывать прямой эффект на синтез половых стероидов, а также воздействовать на функцию клеток гранулезы, способствуя снижению уровня АМГ [3]. В настоящее время в ряде стран МФ рекомендован в качестве монотерапии с целью регуляции ритма менструаций при СПКЯ, в том числе у пациенток с индексом массы тела (ИМТ)<30кг/м2 и у пациенток, незаинтересованных или имеющих противопоказания к приему комбинированных оральных контрацептивов [4]. В последние годы МФ в комбинации с кломифена цитратом рассматривается, как 1-я линия терапии ановуляторного бесплодия у женщин с СПКЯ [5, 6]. Следует отметить, что эффективность МФ варьирует в широких пределах и не всегда определяется наличием ГИ или ожирения. Результаты проведенного нами ранее анализа показали, что эффективность терапии МФ сопоставима у пациенток с андрогенными и неандрогенным формами СПКЯ [7]. В литературе можно встретить данные о более высокой частоте восстановления овуляции и наступление беременности при фенотипах В и С [8]. Однако следует заметить, что сделанные авторами выводы основаны на статистически недостоверных результатах. По данным ряда зарубежных публикаций частота восстановления овуляции на фоне приема МФ выше у пациенток с исходно более низкими уровнями общего тестостерона (Тобщ) [9, 10]. К числу прогностических маркеров эффективности МФ и кломифена цитрата некоторые авторы относят уровень АМГ, который в настоящее время рассматривается, как перспективный диагностический критерий СПКЯ [11, 12]. В целом же вопрос значимости Тобщ, АМГ и других клинико-лабораторных параметров для прогнозирования оценки ответа на терапии МФ остается дискуссионным. Тогда как с клинической точки зрения крайне важна разработка предикторов ответа на терапию МФ для определения группы пациенток, резистентных к данному виду лечения.
Цель данного исследования – выявить возможные клинические и эндокринно-метаболические предикторы эффективности терапии МФ при СПКЯ.
Материал и методы исследования
В исследование включены 143 женщины с СПКЯ в возрасте от 18 до 35 лет (средний возраст – 26,4±4,6 года, средний ИМТ – 23,8±4,8 кг/м2). Критериями включения явились: наличие СПКЯ, установленного в соответствии с Роттердамскими критериями (2003 г.), незаинтересованность в гормональной контрацепции, отсутствие сопутствующей эндокринной и некомпенсированной экстрагенитальной патологии, а также гормональной терапии в течение 3 и более месяцев до вступления в исследование.
Всем пациенткам на 5–7-й день менструального цикла проводили ультразвуковое исследование органов малого таза на аппарате 2000 Toshiba SSA-240 (Япония) трансвагинальным конвексным датчиком частотой 7,5 Мгц. На 2–3-й день менструального цикла оценивалось содержание гормонов в сыворотке крови (ЛГ, ФСГ, Тобщ и свободного тестостерона (Тсв), андростендиона, глобулина, связывающего половые стероиды (ПССГ), пролактина, тиреотропного гормона ) иммунохемилюминесцентным методом на автоматическом анализаторе Immulite 2000 (Siemens, USA). Уровень АМГ в сыворотке крови измеряли методом ELISA с использованием тест-систем AMHGenIIELISA (BeckmanCoulter, USA).
В рамках данного исследования пациенткам проводили 2-часовой оральный глюкозотолерантный тест (ГТТ) с 75 г глюкозы с определением уровня инсулина натощак и дважды после углеводной нагрузки.
Композиционный состав тела оценивался методом двухэнергетической денситометрии по программе «Total Body Tissue Quantitation» на денситометре «Prodigy» фирмы «Lunar» (США). Определяли общее содержание жировой ткани в процентах от массы тела, распределение в отдельных анатомических областях, по андроидному или гиноидному типу, с расчетом соотношения андроидного и гиноидного жира (индекс A/G).
Контроль овуляции производился путем определения уровня прогестерона и эхографических признаков произошедшей овуляции на 20–24-й день менструального цикла.
В качестве инсулиносинсетайзера был выбран МФ (глюкофаж лонг, MerckSante, Франция), суточная доза составляла 1500 мг. Оценка эффективности терапии проводилась через 6 месяцев на основании результатов повторного клинико-лабораторного обследования, включающего исследование гормонального профиля, ГТТ, денситометрию жировой ткани.
Перед началом терапии все потенциальные участницы исследования были проинформированы о возможности проведения альтернативной терапии (гормонотерапии комбинированными оральными контрацептивами или прогестагенами, вступлении в протокол стимуляции овуляции или в программу вспомогательных репродуктивных технологий) и возможности завершения начатого лечения по желанию. Выбыли из исследования 11 женщин: 7 были исключены ввиду низкой комплаентности, 4 – в связи с нежелательными эффектами: из них 3 – в виде тошноты, диареи, 1 – в связи с обострением экземы.
Клиническая эффективность терапии оценивалась по регуляции менструального цикла и зачатию. Полный эффект терапии – наличие более 10 менструаций в пересчете на год или наступление беременности, частичный – увеличение числа менструаций до 10 в год. Соответственно неэффективной считалась терапия при отсутствии регуляции ритма менструаций. В зависимости от эффективности терапии были сформированы две группы. В 1-ю были включены 70 (53,1%) пациенток с полным эффектом от терапии МФ, в их числе 33 пациентки, у которых наступила самопроизвольная беременность. В связи с этим они были исключены из анализа динамики гормональных показателей на фоне терапии МФ. Вторую группу составили 48 (36,3%) пациенток, не ответивших на терапию МФ. Из анализа были исключены 14 (10,6%) пациенток с частичным эффектом от лечения.
Статистический анализ материала проводился с помощью программы SPSS (IBM Statistical Package for the Social Sciences, 21-я версия). Все данные представлены как средние ± стандартное отклонение, сравнение проводилось с помощью t-критерия Стьюдента, U-теста Манна–Уитни. Методом Спирмена оценивались корреляции. Cтатистически значимыми считались результаты при достижении уровня ошибки p<0,05. Для расчета порогового уровня показателей, их специфичности и чувствительности для предикции ответа на терапию был проведен ROC-анализ. Оптимальные показатели чувствительности и специфичности определялись методом наибольшей суммы. Метод логистической регрессии использовался для проведения многофакторного анализа маркеров коррекции овуляторной дисфункции.
Результаты исследования
На основании результатов клинико-лабораторного обследования проведена стратификация пациенток по фенотипам. Фенотип А (ГА+ олигоменорея (ОМ)+поликистозные яичники (ПКЯ)) установлен у 90 (62,9%) женщин, фенотип В (ГА+ОМ) – у 4 (2,8 %), фенотип С (ГА+ПКЯ) – у 7 женщин (4,9%), фенотип Д (ОМ+ПКЯ) – у 42 женщины (29,4%).
Анамнестические и клинико-лабораторные характеристики пациенток с полным эффектом и без эффекта от терапии МФ представлены в табл. 1. Исследуемые группы были сопоставимы по возрасту, ИМТ, характеру нарушений менструального цикла, длительности бесплодия, объему яичников, структуре репродуктивных фенотипов (p>0,05).
Сравнительная оценка гормонального профиля выявила более низкие исходные уровни Тобщ и АМГ у пациенток с полным эффектом от терапии (p<0,05). Средний уровень АМГ в группе без регуляции ритма менструаций был выше на 50,4% (р<0,05), а уровень Тобщ – на 15,8% по сравнению с женщинами, ответившими на терапию (р<0,05). Содержание Тобщ в сыворотке крови не превышало установленных нормативных показателей у 70% (n=49) пациенток 1-й группы и у 45,8% (n=22) пациенток 2-й группы (p<0,05). Уровень АМГ был выше порогового, определенного ранее для СПКЯ (5,2 нг/мл) у 95,7% (n=67) женщин 1-й группы и 95,8% (n=46) 2-й (p>0,05).
Анализ показателей композиционного состава тела не выявил различий по проценту общей жировой массы (табл. 1).Однако имелись различия по характеру распределения жировой ткани. В группе пациенток, не ответивших на терапию, был преимущественно андроидный тип отложения жировой ткани, о чем свидетельствовал более высокий индекс A/G (p<0,05).
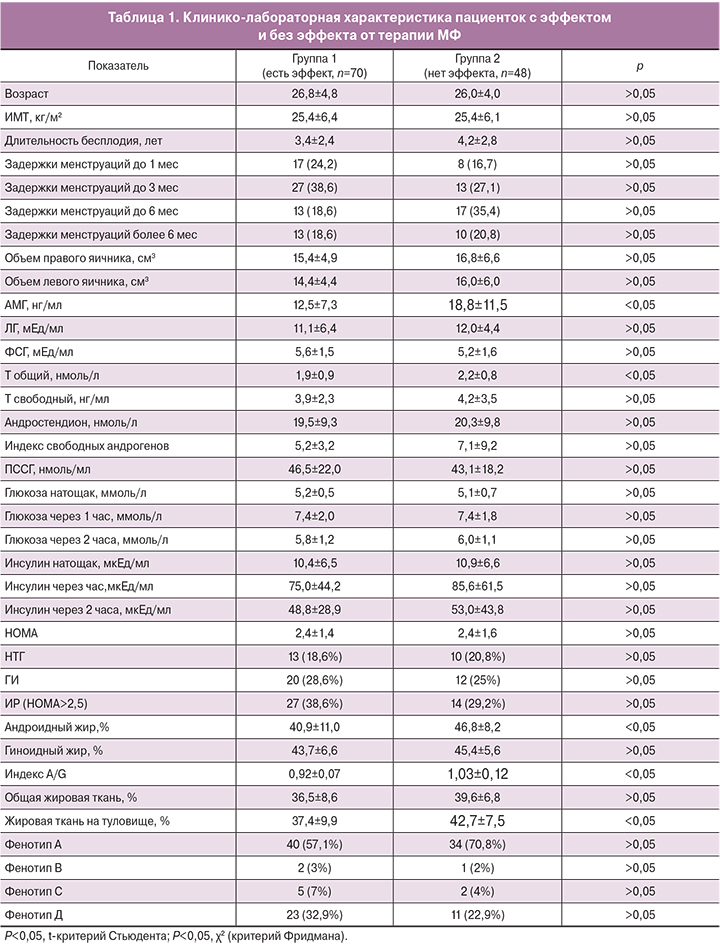
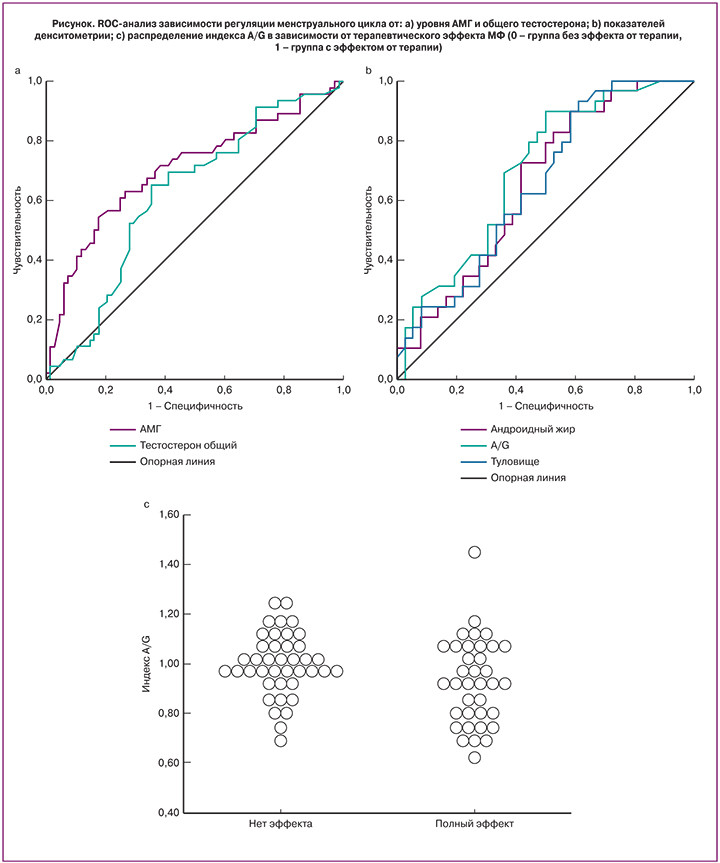
С целью прогнозирования эффективности терапии был проведен ROC-анализ показателей, по которым были выявлены межгрупповые различия (АМГ, Тобщ, процент андроидного жира и жира на туловище, индекс A/G) (рис.1 а, b). Наибольшую прогностическую значимость показал уровень АМГ, площадь под кривой (AUC) – 0,705 (CI0,604 – 0,806. Для Тобщ это значение составило – 0,622 (CI 0,518–0,726). Среди показателей денситометрии: площадь под кривой для индекса A/G – 0,698 (CI 0,571–0,825), для количества жировой ткани на туловище – 0,654 (CI 0,522–0,786), для андроидного жира – 0,655 (CI 0,522–0,787), что несколько уступает по прогностической мощности индексу A/G.
Полученные пороговые уровни для анализируемых показателей, а также чувствительность и специфичность представлены в табл. 2.
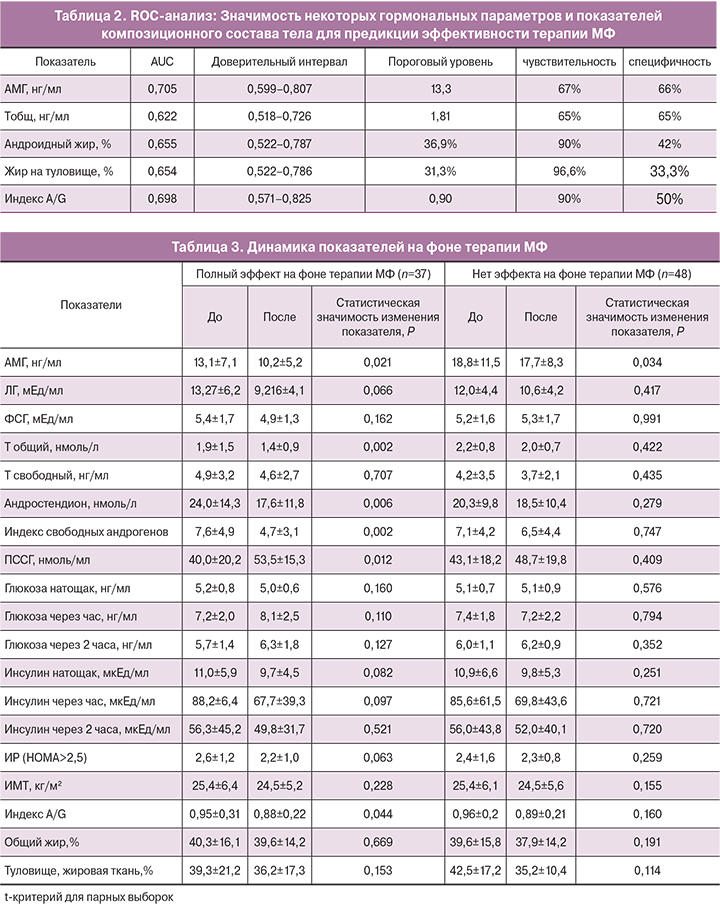
При рассмотрении взаимосвязи между частотой восстановления ритма менструаций и индексом распределения жировой массы A/G (рис. 1с), были выявлены следующие закономерности. Из 25 женщин с A/G≤0,9 терапия оказалась эффективной у 22 (88%) женщин, в то время, как в подгруппе с A/G>0,9 восстановление регулярного ритма менструаций было достигнуто лишь у 18 (35,3%) женщин, у 6 (11,8%) наблюдалась частичная регуляция цикла и у 27 (52,9%) – терапия была неэффективной. Анализ гормональных показателей в подгруппе с индексом A/G>0,9 показал значительные различия по уровню АМГ. Его средние значения среди женщин, не ответивших на терапию, составили 18,1±8,2 нг/мл, среди ответивших – 9,6±6,2 нг/мл (р<0,05). По данным ROC-анализа чувствительность и специфичность метода при пороговом уровне АМГ равном 9,6 нг/мл (AUC=0,726) в подгруппе женщин с A/G>0,9 составили 77,8 и 54,5% соответственно.
Таким образом, прогнозирование ответа на терапию МФ возможно на основе оценки исходных уровней АМГ, Тобщ и показателей денситометрии жировой ткани (процент андроидного жира и жира на туловище, индекс A/G). Пороговые значения этих показателей, представленные в табл. 2, позволяют выделить пациенток, у которых терапия МФ, вероятно, будет наиболее эффективной. Проведение многофакторного анализа методом логарифмической регрессии не позволило выявить комбинацию факторов, определяющих терапевтический исход.
В рамках данного исследования был проведен также сравнительный анализ динамики гормональных показателей среди пациенток, ответивших и не ответивших на терапию МФ. Результаты отражены в табл. 3.
Средние уровни ЛГ и ФСГ на фоне терапии МФ значительно не изменились (p>0,05). В обеих группах наблюдалось значительное снижение уровня АМГ (p<0,05). В группе с полным эффектом от терапии средний уровень АМГ снизился с 13,1±7,1 нг/мл до 10,2±5,2 (на 22,1%), в группе без эффекта – с 18,8±11,5 нг/мл до 17,7±8,3 нг/мл (на 5,8%). Статистически значимое снижение средних уровней Тобщ, андростендиона, индекса свободных андрогенов и повышение среднего уровня ПССГ прослеживалось только в 1-й группе. Так, например, уровень Тобщ снизился на 26,3%, андростендион – на 26,7%, уровень ПССГ повысился на 33,5%. Это привело к снижению индекса свободных андрогенов с 7,6 до 4,7 (p<0,05). В группе женщин, не ответивших на терапию, показатели оставались без существенной динамики (табл. 3).
Оценка показателей углеводного обмена указывает на то, что уровень глюкозы на фоне терапии МФ существенно не изменился в обеих группах (p>0,05). Снижение уровня инсулина и индекса НОМА наблюдалось в общей группе с 10,6±5,8 мкЕд/мл до 9,2±4,7 мкЕд/мл и с 2,4 до 2,1 соответственно (p<0,05). Однако после деления на группы в зависимости от полученного эффекта терапии различия оказались недостоверными (p>0,05).
Анализ показателей денситометрии в общей группе выявил снижение содержания андроидного жира (%), жировой ткани на туловище и ногах (%), а также индекса A/G(p<0,05). Однако после деления на группы, отмечалось лишь снижение индекса A/G в группе пациенток, ответивших на терапию (табл. 3).
Обсуждение
Исследования ИР, как патогенетического механизма формирования СПКЯ, начатые еще в 80-х гг. прошлого века, послужили основанием для использования в клинической практике инсулиносинсетайзеров – лекарственных препаратов, повышающих чувствительность к инсулину. Наиболее эффективен и широко применяется для лечения СПКЯ МФ, на его фоне наблюдается снижение уровня андрогенов, инсулина, нормализация показателей углеводного обмена, регуляция менструального цикла. Терапия МФ не приводит к формированию «тонкого эндометрия», многоплодным беременностям, не требует тщательного ультразвукового мониторинга в отличие от индукторов овуляции [13].
Овуляторный менструальный цикл на фоне терапии МФ восстанавливается у 45–60% женщин с СПКЯ. Хотя МФ изначально был рекомендован для лечения женщин с ИР, ожирением и НТГ, в ряде исследований было показано, что его эффективность не зависит от выраженности овуляторной дисфункции, наличия ожирения, НТГ и ГИ [14]. В последние годы отношение к показаниям для назначения МФ при СПКЯ меняется. Согласно рекомендациям Европейского общества эндокринологов (2014 г.) терапия МФ при СПКЯ возможна вне зависимости от наличия ИР. В клинических рекомендациях Австралийского общества по изучению СПКЯ (2015 г.) указывается на целесообразность назначения МФ пациенткам с ИМТ<30кг/м2 [6]. Обзор литературы показал, что, несмотря на 25-летний опыт применения МФ при СПКЯ до настоящего времени нет единого мнения относительно того, у какой категории пациенток следует ожидать регуляцию ритма менструаций и восстановление овуляции. Эксперты Европейского общества эндокринологов (2014 г.) делают заключение, что необходимо проведение дальнейших исследований по поиску предикторов успешности терапии МФ [14]. В связи с этим целью данного исследования явилось выявление возможных прогностических критериев эффективности терапии МФ у пациенток с СПКЯ.
В результате 6 месяцев терапии МФ восстановление регулярного ритма менструаций было достигнуто у 53,2% женщин, у 10,9% отмечалась заметная положительная динамика, однако сохранялась олигоменорея, в 35,9% случаев терапия оказалась неэффективной. Согласно полученным данным, возраст пациенток, ИМТ, длительность задержек менструаций, а также исходные показатели углеводного обмена не влияли на вероятность восстановления ритма менструаций. Эффективность терапии ассоциировалась с достоверно более низким содержанием АМГ и Тобщ в сыворотке крови. Исходные значения среднего уровня АМГ в группе пациенток, не ответивших на терапию, превышали показатели в группе с успешным лечением на 50,4%, средние значения Тобщ – на 15,8%. Это согласуется с современными представлениями о ведущей роли АМГ в дизрегуляции фолликулогенеза [15].
Была выявлена взаимосвязь эффективности терапии и индекса распределения жировой ткани A/G. Оказалось, что лучший ответ на терапию можно ожидать при более низких значениях A/G, не зависимо от ИМТ.
Проведенный ROC-анализ подтвердил прогностическую значимость 3 показателей (АМГ, Тобщ и A/G), наибольшую имела модель по оценке АМГ, пороговый уровень составил 13,3 нг/мл (чувствительность 67%, специфичность 66%). Пороговый уровень Тобщ для предикции ответа на терапию составил 1,81 нг/мл (чувствительность 65%, специфичность 65%). Среди показателей композиционного состава тела прогностически более значимым оказался индекс распределения жировой ткани A/G. Пороговый уровень составил 0,9 (чувствительность 90%, специфичность 50%). При значениях индекса A/G ниже порогового терапия МФ оказалась эффективной у 88% пролеченных пациенток, при более высоких показателях – только у 35,3%. Проведение многофакторного анализа не позволило выявить комбинацию факторов, определяющих терапевтический исход. Это дает основание рассматривать уровень АМГ и Тобщ в сыворотке крови, а также индекс распределения жировой массы A/G, как независимые предикторы эффективности терапии, обосновывает целесообразность проведения комплексного обследования перед началом терапии. Результаты проведенного исследования согласуются с данными K. Welt и соавт. (2014). Авторы показали, что на фоне 12 недель терапии МФ в дозе 1500 мг/сутки у 61% женщин с СПКЯ восстановился овуляторный менструальный цикл, эффективность терапии ассоциировалась с исходно более низким базальным уровнем Тобщ, не зависела от антропометрических показателей и результатов ГТТ. В указанном исследовании не определялись уровни АМГ, а оценка композиционного состава тела была проведена лишь у небольшого числа женщин [14].
Изучение динамики гормональных показателей на фоне проводимой терапии показало, что снижение содержания Тобщ в сыворотке крови и повышение ПССГ наблюдалось лишь в группе пациенток, ответивших на терапию восстановлением ритма менструаций. Выявленная взаимосвязь коррекция ГА и ОМ подтверждает роль избытка андрогенов в генезе овуляторной дисфункции при СПКЯ. Учитывая отсутствие существенной динамики уровней инсулина, можно предположить, что эффект терапии в значительной степени опосредуется прямым влиянием МФ на стероидогенез в яичниках. Полученные данные о преимущественном снижении уровня АМГ в группе пациенток с полным ответом на терапию подтверждают ведущую роль АМГ в блокаде роста и созревания фолликулов и возникновения ановуляции. На это косвенно указывает результаты ряда исследований о фенотипических различиях продукции АМГ при СПКЯ. Так, ранее было показано, что пациентки с овуляторным фенотипом СПКЯ имеют более низкие уровни АМГ по сравнению с неовуляторными фенотипами. Результаты проведенного исследования дают основания оценивать динамику уровней АМГ и Тобщ для контроля терапии и целесообразности ее продолжения.
На основании результатов проведенного исследования можно сделать заключение о достаточно высокой эффективности терапии МФ при СПКЯ, которая не зависит от возраста пациенток, характера нарушений менструального цикла, ИМТ, наличия ИР, ГИ, НТГ. Предикция ответа на терапию возможна по исходным значениям уровней АМГ (менее 13,3 нг/мл) и Тобщ (менее 1,81 нг/мл) в сыворотке крови, а также по индексу распределения жировой ткани A/G (менее 0,9), определяемому при денситометрии. Прогнозирование ответа на терапию МФ позволит оптимизировать тактику ведения пациенток с СПКЯ, при заведомо неблагоприятном прогнозе выбирать альтернативные методы или комбинированную терапию. Однако для уточнения пороговых уровней лабораторных показателей целесообразно проведение дальнейших исследований с большей выборкой пациенток и последующей валидацией метода.



