С современных позиций синдром поликистозных яичников (СПКЯ) рассматривается как полигенное эндокринное расстройство, сопряженное с репро-дуктивными и метаболическими нарушениями, в структуре которых доминируют инсулинорезистентность (ИР) и гиперинсулинемия. В популяции частота СПКЯ достигает 18-20% [1], среди пациенток с сахарным диабетом 2 типа, ожирением и метаболическим синдромом - превышает 30% [2, 3]. Осознание ИР как ключевого фактора развития СПКЯ и его отсроченных осложнений обосновывает назначение инсулиносенситайзеров. В клинической практике нашли применение бигуаниды (метформин), тиазолидиндионы (пиоглитазон, росиглитазон) и инозитолы (D-хиро-инозитол и миоинозитол). Наиболее изучен и широко внедрен для клинического использования метформин; он эффективен и не ассоциирован с серьезными побочными эффектами, такими как онкологические и сердечно-сосудистые риски, характерные для тиазолидиндионов. Однако для метформина свойственна достаточно высокая частота диспепсических расстройств, которые можно минимизировать, назначая пролонгированные формы и титруя дозу препарата.
Согласно международному клиническому протоколу по тактике ведения пациенток с СПКЯ (2018) и рекомендациям Российского общества акушеров-гинекологов (2021), метформин показан только пациенткам с индексом массы тела (ИМТ) более 25 кг/м2, в качестве терапии 2-й линии при непереносимости комбинированных гормональных контрацептивов или для индукции овуляции у пациентов с резистентностью к кломифена цитрату [4]. Однако результаты некоторых исследований указывают на высокую эффективность метформина у пациентов без ИР. В основе восстановления репродуктивной функции у данной категории пациенток может лежать ингибирующее влияние метформина на функцию клеток гранулезы и теки, опосредованное нормализацией функции дыхательной цепи митохондрий, ассоциированное с последующим снижением секреции антимюллерова гормона (АМГ) и андрогенов [5-7]. Известно также, что метформин может приводить к повышению разнообразия кишечной микробиоты и изменению ее качественного состава с преобладанием бактерий, продуцирующих короткоцепочечные жирные кислоты, что способствует снижению проницаемости кишечной стенки, купированию хронического воспалительного ответа и коррекции ИР [8, 9].
По данным ранее представленного исследования, восстановление регулярного ритма менструаций на фоне метформина при СПКЯ наблюдается в каждом 2-м случае [10]. По данным N. Schweighofer et al. (2014), метформин оказался эффективным лишь у каждой 3-й пациентки с СПКЯ [11]. Несмотря на ограниченную эффективность терапии метформином, не разработан персонифицированный подход к ее назначению.
Цель настоящего исследования - поиск клинико-лабораторных и молекулярно-генетических предикторов восстановления регулярного ритма менструаций у пациенток с СПКЯ на фоне терапии метформином.
Материалы и методы
В проспективное исследование по разработке модели предикции эффективности метформина включены 143 женщины с СПКЯ (средний возраст - 26,4 (4,6) года, средний ИМТ - 23,8 (4,8) кг/м2). Критериями включения явились наличие СПКЯ (Роттердамские критерии, 2003 г.), а также наличие добровольного информированного согласия. Из исследования исключены пациентки с сопутствующей эндокринной патологией, гормонотерапией в течение 3 месяцев до исследования. Ультразвуковое исследование органов малого проведено с исполь-зованием вагинально-ректальных датчиков (частота 7,5 Мгц, 2000 Toshiba SSA-240, Япония). Оценка гормонального профиля включала исследование на 2-3-й день менструального цикла уровней лютеи-низирующего гормона (ЛГ), фолликулостимулиру-ющего гормона (ФСГ), пролактина, тиреотропного гормона, общего (Тобщ) и свободного тестостерона, андростендиона, глобулина, связывающего половые гормоны (ГСПГ) (иммунохемилюминес- центный метод, Immulite 2000, Siemens, США), уровня АМГ (AMH Gen II ELISA, Beckman Coulter, США). Оценка метаболического статуса проведена с помощью 2-часового перорального глюкозотолерантного теста с 75 г глюкозы с трехкратным определением секреции инсулина на фоне нагрузки. Пациенткам также проводилась оценка композиционного состава тела методом двухэнергетической рентгеновской денситометрии (Lunar, США).
Исследование полиморфизма 45 локусов было выполнено в лаборатории молекулярно-генетических методов ФГБУ «НМИЦ АГП им. академика В.И. Кулакова» Минздрава России методами полимеразной цепной реакции в режиме реального времени и таргетного секвенирования # (IonS5, чипы 520, 530). Исследованы полиморфизмы, ассоциированные с нарушением биосинтеза андрогенов (CYP2C9* rs1057910, rs1799853; CYP17A1* rs743572; CYP19A1 * rs936306), фолликулогенеза (FSHR# rs12994034, rs17038027, rs6166, rs2349415, rs148976413; DENND1A# rs2479106, rs10818854; YAP1 # rs1894116; АМН# rs10407022; LHCGR# rs12470652, rs13405728), обмена углеводов (THADA# rs12478601, rs78635447, rs12468394; INSR* rs2059807, rs3815902; FTO* rs9939609, rs8050136; KCNJ11* rs5219; PPARGC1A* rs8192678; ОСТ1# (rs6282031, rs34130495, rs72552763, rs113569197; SLCO1B1* rs4149056; Rub5B/SUOX# rs705702; IRS1* rs1801278; TCF7L2* rs7903146, rs12255372; PPARA* rs4253778; LEP* rs7799039) и другие (C9orf3# rs4385527; AGTR1* rs5186; GNB3* rs5443; IL1B* rs1143627; UCP2* rs660339; ATM* rs11212617, rs683369; END1* rs5370; ACE* rs4340; HGMA2# rs2272046).
Всем пациенткам был проведен курс терапии метформином (препарат «Глюкофаж Лонг» 750 мг, Merck Serono) в течение 6 месяцев 1500 мг/сут с титрованием дозы. Исключены из исследования в связи с низкой комплаентностью или побочными эффектами 11 пациенток. Исследование завершили 132 пациентки. Группу 1 составили 70 (53,1%) женщин с регуляцией ритма менструаций (межменструальный интервал до 35 дней), группу 2 - 48 (36,3%) женщин без регуляции ритма (сохраняющаяся олигоменорея или аменорея). Частичный ответ на терапию в виде тенденции к регуляции менструального ритма (менее 5 менструаций за 6 месяцев) наблюдался у 14 (10,6%) женщин, которые были исключены из дальнейшего исследования.
Статистический анализ
Анализ данных проводился с помощью системы IBM Statistical Package for the Social Sciences 21. Тест Колмогорова-Смирнова показал гауссовское распределение данных, которые представлены как среднее арифметическое и стандартное отклонение (М (SD)). Сравнение количественных характеристик проведено с помощью t-критерия Стьюдента, качественных - с помощью критерия Фишера. Отношение шансов (ОШ), как симметричная величина, применялось для количественной оценки риска в генетических исследованиях. Расчет ОШ проведен с доверительным интервалом (ДИ) 95%, рассчитанным по методу Уилсона, который позволяет оценить доверительные интервалы для очень малых и очень больших частот и применим для выборок малого объема. Статистически значимыми считались различия при достижении уровня p<0,05.
При построении бинарной логистической рег-рессионной модели использовался метод обратной селекции. В качестве исхода рассматривали наличие или отсутствие регуляции цикла на фоне терапии метформином, в качестве предикторов — клинико-лабораторные и молекулярно-генетические характеристики пациенток. Качество приближения регрессионных моделей при каждом последующем шаге оценивалось при помощи функции подобия — отрицательного удвоенного значения логарифма этой функции (-2LL). Оценка качества полученных моделей проводилась с помощью ROC-анализа по площади ROC-кривой (AUC). AUC приведена с 95% ДИ. Часть дисперсии, объяснимая с помощью логистической регрессии, вычислялась по методу Наделькеркеса. В качестве порогового значения традиционно рассматривали 50% вероятность исхода.
Поскольку исследование являлось пилотным, а в литературе не удалось найти данных, позволяющих адекватно оценить ожидаемый эффект, расчет объема выборки не производился.
Результаты
С целью изучения эффективности и прогнозирования успешности терапии метформином был проведен сравнительный анализ клинико-лабораторных характеристик пациенток с регуляцией и без регуляции менструального цикла на фоне терапии метформином (табл. 1). До начала терапии олигоменорея наблюдалась у 81,4% пациенток с последующей регуляцией менструального ритма и у 79,2% пациенток без эффекта от терапии метформином (р>0,05); частота аменореи составила 18,6 и 20,8% соответственно (р>0,05).
Исследуемые группы не различались по ИМТ, частоте ожирения, показателям гликемии, инсулина натощак, частоты нарушений толерантности к глюкозе, ИР, гиперинсулинемии (p>0,05). Среди показателей гормонального профиля в группе с регуляцией менструального цикла наблюдались более низкие исходные уровни АМГ (p=0,001), Тобщ (p=0,015); хотя не было выявлено различий по представленности различных фенотипов СПКЯ (табл. 1). Оценка характера распределения жировой ткани показала, что терапевтический эффект метформина не зависит от общего процента жировой ткани в организме (табл. 1). Однако пациентки с регуляцией ритма менструаций имели меньший процент андроидной жировой ткани (p=0,02) и наименьшее значение индекса A/G (p=0,002), отражающего соотношение андроидной жировой ткани к гиноидной.
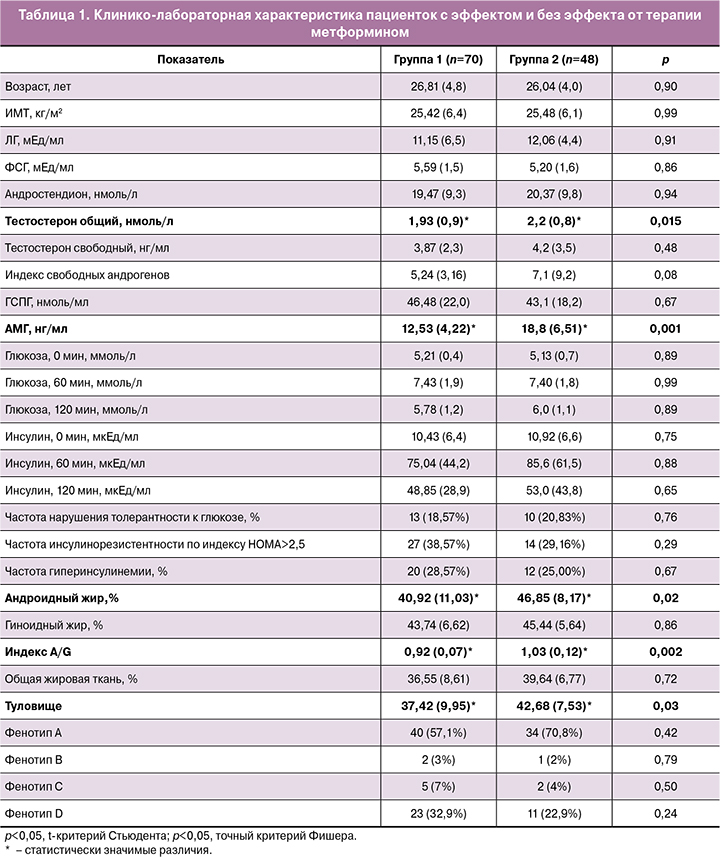
Проведение ROC-анализа показало, что восста-новление менструального цикла наиболее вероятно при исходном уровне АМГ<13,3 нг/мл (AUC=0,70 (ДИ 0,60-0,81)), уровне Тоб <1,81 нг/мл (AUC=0,62 (ДИ 0,52-0,73)) и значении индекса A/G<0,90 (AUC=0,69 (ДИ 0,57-0,82)).
С целью разработки персонализированного подхода к назначению терапии метформином при СПКЯ был проведен сравнительный анализ по 45 полиморфным локусам пациенток в зависимости от терапевтического эффекта. В генетическую панель были включены локусы, ассоциированные с нарушением фолликулогенеза, углеводного обмена и гиперандрогенией, согласно результатам предшествующих зарубежных молекулярно-гене-тических исследований. Полученные результаты указывают на взаимосвязь эффекта от терапии с 4 полиморфными локусами: SLCO1B1 (rs4149056), АСЕ (rs4340), FSHR (rs2349415), ОСТ1 (rs113569197) (рис. 1). Сравнительный анализ частоты аллелей гена SLCO1B1 (rs4149056) показал, что среди пациенток с полным эффектом от терапии метформином чаще встречался аллель С (42/140, 30,0%), чем в группе без эффекта (15/87, 17,0%), р=0,022. Частота носителей аллеля Т гена SLCO1B1 (rs4149056) в исследуемых группах составила 72/87 (83%) и 98/140 (70,0%) соответственно. В связи с малым объемом выборки тип наследования установить не удалось (рис. 1а).
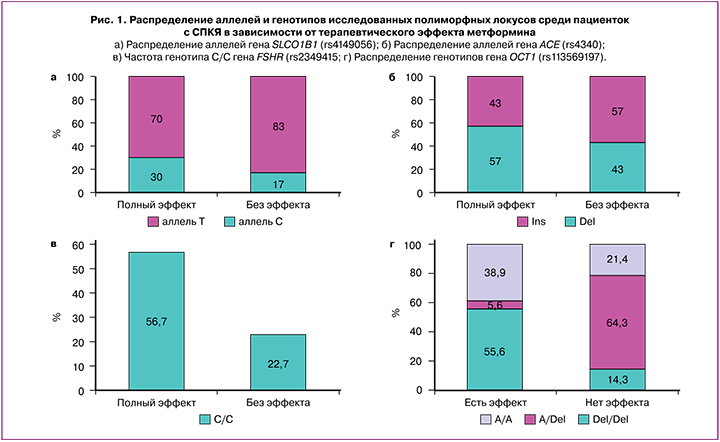
Анализ полиморфизма гена АСЕ (rs4340) показал, что среди пациенток с регуляцией ритма менструаций чаще встречался аллель Del (80/140, 57,0%), чем аллель Ins (60/140, 43,0%) по сравнению с паци-ентками без эффекта от терапии, среди которых частота аллеля Del составила 39/90 (43,0%), аллеля Ins - 51/90 (57,0%), р=0,04. Различия по распределению генотипов не достигали статистической значимости (р=0,80, рис. 1б).
Среди пациенток с полным эффектом от терапии метформином частота генотипа С/С составила 17/30 (56,7%), частота носителей Т/* - 13/30 (43,3%); среди пациенток без эффекта частота гено-типа С/С - 5/22 (22,7%), генотипо в Т/* - 17/22 (77,2%) (р=0,01; ОШ=4,45; 95% ДИ 1,30-15,23). Обладательницы генотипа С/С имеют шанс регуляции ритма менструаций на фоне терапии метформином в 4,5 раза больший, по сравнению с носительницами аллеля Т (генотипы С/Т и Т/Т, рис. 1в).
Среди пациенток с полным эффектом от терапии чаще встречался генотип Del/Del (10/18, 55,6%), чем генотипы А/* (8/18, 44,5%) гена ОСТ1 (rs113569197), по сравнению с пациентками без эффекта от терапии, среди которых частота генотипов составила 2/14 (14,3%) и 12/14 (85,7%) соответственно (р=0,02; ОШ=7,50;95% ДИ 1,29-43,69)).
На основе полученных данных была создана мате-матическая модель для прогнозирования регуляции ритма менструаций при СПКЯ на фоне терапии метформином. Согласно результатам регрессионного анализа, генотип FSHR (rs2349415) и исходный уровень АМГ являются факторами, определяющими успешность терапии (AUC=0,75; ДИ 95% 0,66-0,85), чувствительность 83%, специфичность 60%). Методом логистической регрессии подобрана функция, включающая исходный уровень АМГ в сыворотке крови и генотип FSHR (rs2349415), характеризующая вероятность восстановления регулярного ритма менструаций в результате терапии. Часть дисперсии, которую можно объяснить с помощью логистической регрессии (вычисленная по методу Наделькеркеса) составила 72,1%.
Значения коэффициентов в логистической регрессии и проверка их значимости приведены в таблице 2.

Классифицирующая дискриминантная функция имеет вид:
Z=2,435xAMr - 0,075xFSHR +4,69,
где FSHR - количество аллелей С в локусе -521Т>С гена SLCOB1; АМГ - уровень АМГ в сыворотке крови до терапии.
Вероятность регуляции ритма менструаций в результате терапии метформином (р) определялась по формуле p=1/(1+e-z). При значении р>0,5 (50% вероятность исхода) можно предположить полный эффект от терапии метформином, а при значении р<0,5 успешность терапии маловероятна.
Точность прогнозирования успешности курса метформина при СПКЯ с использованием независимых переменных составляет 70,9%. Проведена оценка полученной модели методом ROC-анализа. Чувствительность составила 83% (71-93%), спе-цифичность - 60% (48-80%), значение площади под кривой для данной модели составляет 0,755, 95% ДИ 0,664-0,847 (р=3,5x10-13).
Обсуждение
Гетерогенность клинических и эндокринно-мета-болических характеристик СПКЯ существенно затрудняет диагностику и поиск оптимальных схем терапии; выделение репродуктивных фенотипов не позволяет персонализировать подходы к ведению пациенток. Традиционно в качестве первой линии терапии СПКЯ применяются комбинированные гормональные контрацептивы; их назначение способствует коррекции биохимической гиперан- дрогении, уменьшению клинических проявлений андрогенизации и регуляции менструального цикла. Однако остается группа пациенток с СПКЯ, которые имеют метаболические нарушения, требующие соот-ветствующей коррекции, или пациентки, не ориен-тированные на прием гормональных контрацептивов, имеющие противопоказания к их применению или побочные эффекты от их использования, а также те, кто заинтересован в реализации репродуктивной функции без применения вспомогательных репродуктивных технологий. Это определяет целесообразность применения альтернативных схем терапии.
В качестве 2-й линии терапии СПКЯ могут быть назначены инсулиносенситайзеры, в частности, метформин. Следует отметить, что исследования по изучению ИР как патогенетического механизма формирования СПКЯ были начаты еще в 80-х гг. прошлого века. В настоящее время метформин назначается пациенткам с СПКЯ при наличии ИР, гиперинсулинемии, нарушении толерантности к глюкозе и ожирении. Считается, что восстановление чувствительности тканей к инсулину под воздействием метформина ассоциируется с ингибированием цитохрома Р450с17а в яичниках, снижением базального уровня 17а-гидроксипрогестерона и синтеза андрогенов в яичниках и надпочечниках [12]. На фоне терапии метформином отмечается также восстановление синтеза протеина, связывающего инсулиноподобный фактор роста (IGFBP-1) клетками гранулезы, снижение свободных биологически активных фракций IGF-1, что также способствует подавлению синтеза андрогенов клетками теки [13]. Часть этих эффектов опосредована стимулирующим влиянием метформина на АМФ-активируемую протеинкиназу (АМРК), активность которой снижена у пациентов с сахарным диабетом 2 типа, метаболическим синдромом и ожирением [14]. Известно также, что метформин обладает и инсулин-независимыми эффектами; к их числу относят ингибирование стероидогенеза путем подавления комплекса I митохондриальной дыхательной цепи, снижение экспрессии генов StAR и CYP171a [15], повышение активности сигнального пути печеночной киназы В1 (LKBI/AMPK) [16], снижение активности митоген-активируемой про- теинкиназы (МАРК-сигнального пути), в частности ERK1/2, нормализацию кишечной микробиоты, а также прямое влияние на секрецию гонадотропин- рилизинг-гормона и ЛГ [17]. Указанные механизмы могут лежать в основе нормализации функции клеток теки, гранулезы, кумулюса, собственно ооцита и объяснять снижение уровня АМГ, коррекцию гиперандрогении и нарушений репродуктивной функции, включая восстановление ритма менструаций, у пациенток с нормальной массой тела даже при отсутствии ИР [18, 19]. Этим можно объяснить полученный эффект от метформина в виде регуляции ритма менструаций у пациенток с СПКЯ, включенных в наше исследование, который не зависел от ИМТ, наличия и степени выраженности ИР, гиперинсулинемии и нарушения толерантности к глюкозе. По некоторым данным, эффективность терапии метформином у женщин с ИМТ менее 25 кг/м2 может достигать 41,65% [20], что в целом согласуется с результатами представленного нами исследования. Стоит также отметить, что, по некоторым данным, терапия метформином в дозе 1500 мг/сут приводит к более выраженному снижению уровня Тобщ и андростендиона у пациенток с нормальным ИМТ, чем с ожирением [20].
Несмотря на достаточно широкое применение метформина в клинической практике, до настоящего времени не решен вопрос предикции эффективности терапии на этапе ее назначения. Исследования по этому вопросу малочисленные и достаточно про-тиворечивые. Так, в литературе представлены данные о том, что терапия метформином оказалась более эффективной при выраженной гиперсекреции ЛГ [21]; имеются также указания на то, что уровень АМГ может определять терапевтический эффект метформина при СПКЯ [7, 22]. В настоящем исследовании не установлено взаимосвязи исходного уровня ЛГ с восстановлением ритма менструаций, однако получены данные о высокой вероятности регуляции цикла при уровне Тобщ в сыворотке крови <1,81 нг/мл и уровне АМГ<13,3 нг/мл. Это может быть связано, как с коррекцией ИР, так и с подавлением активности клеток гранулезы.
Результаты настоящего исследования показали также, что носительство полиморфных локусов SLCO1B1 (rs4149056), ОСТ1 (rs113569197), FSHR (rs2349415), АСЕ (rs4340) может определять исходы терапии. В доступной литературе не представлены данные о влиянии полиморфизма SLCO1B1 на мета-болизм и действие метформина, однако по результатам российского ассоциативного генетического исследования этот локус является геном-кандидатом СПКЯ [23]. Согласно данным полногеномного исследования, носители полиморфного локуса SLCO1B1 (rs4149056) имеют более низкий уровень ГСПГ [24]. В настоящем исследовании носительство аллеля С гена SLCO1B1 (rs4149056) ассоциировалось с регуляцией ритма менструаций на фоне 6 месяцев терапии метформином. Вероятно, полиморфизм SLCO1B1 (rs4149056) может приводить к повышению биологически активных фракций андрогенов и формированию гиперандрогении при СПКЯ посредством снижения синтеза ГСПГ. Терапия метформином, как известно, приводит к повышению уровня ГСПГ и коррекции андрогенного профиля.
Нам не удалось установить возможные механизмы, определяющие взаимосвязь гена АСЕ (rs4340) с биологическими эффектами метформина при СПКЯ, однако, по данным некоторых зарубежных исследований, указанный полиморфный локус ассоциируется с гиперандрогенией и может увели-чивать риск развития СПКЯ [25].
Известно, что функция яичников взаимосвязана с полиморфизмами гена FSHR, вариантные локусы могут определять как более высокий уровень эндогенного ФСГ и большую длительность фолликулярной фазы менструального цикла, так и меньшую чувствительность к ФСГ, при которой требуются более высокие дозы экзогенного ФСГ в протоколах вспомогательных репродуктивных технологий [26, 27]. Результаты проведенного исследования показали, что носители генотипа С/С гена FSHR (rs2349415) имеют почти пятикратное увеличение шансов на восстановление ритма менструаций, по сравнению с носителями аллеля Т. Согласно ранее опубликованным данным, указанный полиморфный локус может определять более высокий уровень ФСГ и более низкий уровень эстрадиола [10]. Однако, его взаимосвязь с исходами стимуляции овуляции у пациенток с заболеваниями репродуктивной системы еще не изучена.
Другим локусом, ассоциированным с регуляцией ритма менструации на фоне терапии метформином, является ген OCT1 (rs113569197) (органический транспортер катионов/organic cation transporter). В предшествующих исследованиях было показано, что метформин является субстратом специфических для печени и почек ОСТ1 и ОСТ2 [28], активность которых опосредует его фармакокинетику и фармакодинамику [29]. Ученые из Китая показали взаимосвязь полиморфизма ОСТ1 (rs683369 и rs628031) с эффективностью метформина, хотя не выявили влияния носительства полиморфного локуса на риски формирования СПКЯ [30]. В другом же исследовании был подтвержден риск развития синдрома у носителей ОСТ1 (rs628031), что может быть связано с высокой межэтнической вариабельностью структуры данного гена (Ensembl (http://ensembl.org). На основе результатов исследования была создана математическая модель, которая дает возможность прогнозировать эффективность терапии метформином с учетом генотипа С/С FSHR (rs2349415) и уровня АМГ в сыворотке крови женщин с СПКЯ.
Заключение
Таким образом, терапия метформином в дозе 1500 мг/сут позволяет добиться восстановления регулярного ритма менструаций без назначения гормонотерапии у каждой 2-й пациентки с СПКЯ. Вероятность восстановления ритма менструаций не зависит от возраста, особенностей течения синдрома, ИМТ, наличия ИР и нарушенной толерантности к глюкозе, однако определяется уровнями АМГ (<13,3 нг/мл), Тобщ (<1,81 нг/мл) в сыворотке крови и характером распределения жировой ткани (индекс A/G<0,9). В качестве молекулярно-генетических маркеров могут рассматриваться 4 полиморфных локуса — это гены FSHR (rs2349415), SLCO1B1 (rs4149056), АСЕ (rs4340), ОСТ1 (rs113569197). Можно полагать, что использо-вание математической модели, включающей генотип FSHR (rs2349415) и уровень АМГ в сыворотке крови менее 13,3 нг/мл, на этапе выбора метода терапии позволит выделить группу пациенток с потенциально высокой вероятностью регуляции ритма менструаций в ответ на метформин.



