1) ФГАOУ ВО «Белгородский государственный национальный исследовательский университет», Белгород, Россия;
2) ФГAOУ ВО «Российский университет дружбы нарoдoв», Москва, Россия
Актуальность: Миома матки – часто встречающееся заболевание женских репродуктивных органов, которое выявляется у 15–45% женщин. Одним из важных аспектов патогенеза миомы матки является нарушение апоптоза и иммунных процессов, в основе которых лежит дисбаланс цитокинов, в частности интерлейкинов. Полиморфизм генов интерлейкинов может влиять на их экспрессию, и вследствие этого иметь важное значение в патофизиологии миомы матки.
Цель: Изучить связь между полиморфизмом генов интерлейкинов и миомой матки.
Материалы и методы: В исследование были включены 492 пациентки. В основную группу вошло 109 пациенток, страдающих миомой матки. Для исследования отобраны 6 полиморфных локусов генов интерлейкинов – А/С IL10 rs1800872, С/G IL6 rs1800795, Т/С IL5 rs2069812, С/Т IL4 rs2243250, Т/С IL1β rs16944, С/Т IL1α rs1800587. Анализ выполняли с помощью полимеразной цепной реакции (ПЦР) на термоциклере CFX-96 Real-Time System. Для расчета ассоциаций использовались отношение шансов (ОШ) и 95% доверительный интервал (ДИ). Для оценки ассоциаций комбинаций аллелей и генотипов анализируемых генов с формированием миомы матки использовали программу АРSampler
(https://sourceforge.net/projects/apsampler/).
Результаты: В результате проведенного исследования установлена значимая роль молекулярно-генетических маркеров А/С IL10 rs1800872, Т/С IL5 rs2069812, С/Т IL4 rs2243250, Т/С IL1β rs16944, С/Т IL1α rs1800587 в развитии миомы матки. Факторами риска развития миомы матки следует считать генотип ТТ rs1800587 IL1α (ОШ=5,70, p=0,017), а также сочетание полиморфных вариантов Т rs2243250 IL4, Т rs1800587 IL1α и Т rs16944 IL1β (ОШ=2,60, pperm=0,012), Т rs1800587 IL1α, С rs2069812 IL5 и Т rs16944 IL1β (ОШ=2,71, pperm=0,009), Т rs1800587 IL1α, С rs1800872 IL10 и Т rs16944 IL1β (ОШ=2,73, pperm=0,003).
Заключение: Полиморфные локусы генов А/С IL10 rs1800872, Т/С IL5 rs2069812, С/Т IL4rs 2243250, Т/С IL1β rs16944, С/Т IL1α rs1800587 ассоциированы с формированием миомы матки. Впервые выявленные нами комбинации аллельных вариантов полиморфных локусов генов интерлейкинов, ассоциированные с повышенным риском развития миомы матки, свидетельствуют о важности межлокусных взаимодействий генов-кандидатов в формировании данной патологии, и могут быть использованы в практической медицине с целью выделения групп риска, для проведения в них профилактических мероприятий.
миома матки
полиморфизм
гены интерлейкинов
Миома матки – доброкачественная, хорошо отграниченная капсулированная опухоль, возникающая в миометрии матки. Как наиболее часто возникающая доброкачественная опухоль (от 15 до 45% в разных популяциях), миома матки является причиной дисменореи, меноррагии, анемии, недержания мочи, рецидивирующих выкидышей, преждевременных родов, бесплодия, нарушения функции смежных органов, дисгормональных заболеваний молочных желез [1, 2]. Во многих странах, в том числе и России, одной из главных причин гистерэктомии является миома матки (50–70% случаев) [3]. Несмотря на доброкачественное течение, миома матки снижает качество жизни пациенток, а также оказывает значительное экономическое воздействие на систему здравоохранения во всем мире [4].
Механизмы развития и роста миомы матки окончательно не установлены и остаются дискуссионными. В настоящее время обсуждается роль иммунных нарушений в патогенезе миомы [5, 6]. Доказано, что рост миомы сопровождается ослаблением иммунной защиты на фоне снижения уровня противовосполительных и повышения уровня провоспалительных цитокинов [7, 8]. Также, одним из важных аспектов патогенеза миомы матки является нарушение регуляции процесса апоптоза [9–11]. Oпухолевый рост обусловлен дисбалансом между пролиферацией и гибелью клеток. Цитокины, в частности интерлейкины, оказывают существенное влияние на пролиферацию, дифференцировку и гибель клеток [12]. Некоторые интерлейкины (IL1, IL2, IL3, IL4, IL-5, IL10) способны запускать программу защиты клеток от аппоптоза через усиление функций белков Bcl-2, Bcl-xL и др., другие (IL10, IL1, IL17), напротив, обладают способностью индуцировать аппоптоз [10, 13]. Таким образом, отобранные для исследования полиморфные локусы генов интерлейкинов (А/С IL10 rs1800872, С/G IL6 rs1800795, Т/С IL5 rs2069812, С/Т IL4 rs2243250, Т/С IL1β rs16944, С/Т IL1α rs1800587), через свои продукты могут прямо или опосредованно оказывать влияние на апоптоз клеток, что имеет важное значение в патофизиологии миомы матки.
Изучению генетических факторов, определяющих развитие миомы матки, посвящено достаточно много отечественных и зарубежных исследований [3, 7, 14]. Рассматривается роль полиморфных вариантов различных групп генов-кандидатов – рецепторов прогестерона и эстрогенов, факторов роста, металлопротеиназ, хемокинов и генов фолатного цикла и др. в формировании миомы матки [14–19]. Работы, посвященные исследованию роли полиморфизма генов интерлейкинов в развитии миомы матки, несмотря на очевидную значимость этих генов в патофизиологии заболевания немногочисленны, и их результаты нередко противоречивы [3, 11]. Роль межгенных взаимодействий генов интерлейкинов в формировании миомы матки практически не изучена.
Цель исследования: оценить вклад полиморфных локусов интерлейкинов в развитие миомы матки.
Материалы и методы
Группы для исследования формировались сплошным методом на базе гинекологического отделения ОГБУЗ БОКБ Святителя Иoасафа. Включенные в исследование женщины – коренные жительницы Центрального Черноземья России, без родственных связей между собой. В исследование были включены 492 пациентки. В основную группу вошло 109 пациенток, страдающих миомой матки. Диагноз был верифицирован эхографическими, гистероскопическими методами с последующим гистологическим исследованием полученного материала. Критериями исключения из основной группы считали беременность, наличие диагностированных злокачественных заболеваний эндометрия, яичников, тела матки. Остальные 383 женщины, не имеющие миому, составили группу контроля. Отбор индивидуумов для группы контроля осуществлялся из числа женщин без заболеваний органов репродуктивной системы.
Возраст пациенток основной группы (42,37 (6,02) лет) и группы контроля (41,23 (5,72) лет) по U критерию Манна–Уитни был сопоставим (p>0,05).
Проведение исследования было одобрено Региональным комитетом по этике Белгородского государственного национального исследовательского университета (протокол № 8 от 26.05.2016 г.). Перед проведением клинико-инструментальных, клинических и генетических исследований, все женщины, принявшие участие в исследовании, дали информированное согласие на проведение лечебно-диагностических мероприятий.
В качестве материала для исследования использовали геномную ДНК, выделенную методом фенол-хлороформной экстракции из лейкоцитов периферической крови.
Для анализа были выбраны следующие ДНК маркеры: А/С IL10 rs1800872, С/G IL6 rs1800795, Т/С IL5 rs2069812, С/Т IL4 rs2243250, Т/С IL1β rs16944, С/Т IL1α rs1800587. [17, 19, 20, 21]. Анализ молекулярно-генетических локусов С/G IL6 rs1800795 и С/Т IL4 rs2243250 проведен методом Rеаl-Time ПЦР, с использованием олигонуклеотидных праймеров и зондов (ООО «Синтол», Россия). Исследование полиморфных локусов А/С IL10 rs1800872, Т/С IL1β rs16944, Т/С IL5 rs2069812, С/Т IL-1α rs1800587 производилось методом анализа полиморфизма длин рестрикционных фрагментов (ПДРФ) продуктов ПЦР-амплификации специфических участков генома с использованием соответствующих ферментов рестрикции производства фирмы «Сибэнзим» (Новосибирск).
Статистический анализ
Распространение частот аллелей и генотипов генов интерлейкинов в основной группе и группе контроля оценивались помощью таблиц сопряженности 2×2 с использованием критерия χ2 с учетом поправки Йейтса на непрерывность. Для поиска ассоциаций ДНК маркеров с формированием миомы матки использовали показатель отношения шансов (ОШ) и его 95% доверительный интервал (95% ДИ).
Статистический анализ данных проводили с использованием программы STATISTICA for Windows 10.0.
Оценку ассоциаций комбинаций аллелей и генотипов анализируемых генов с формированием миомы матки проводили с помощью программы АРSampler (https://sourceforge.net/projects/apsampler/), использующей метод Монте-Карло-Марковских цепей и байесовскую непараметрическую статистику [22]. Для верификации полученных ассоциаций при множественных сравнениях использовали пермутационный анализ (pperm). За статистически значимый уровень принимали pperm<0,05 [23].
Результаты и обсуждение
Частота аллелей и генотипов ДНК-маркеров интерлейкинов в основной группе и в контроле показаны в таблицах 1 и 2.
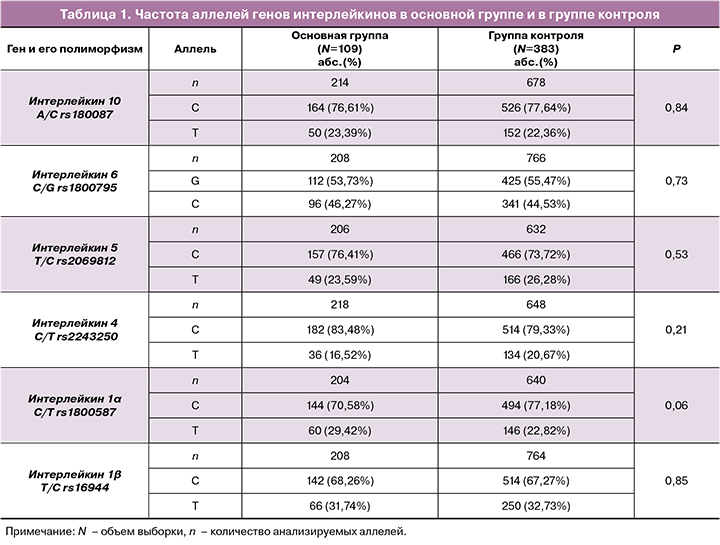
В ходе сравнительного анализа установлено, что генотип ТТ rs1800587 IL1α встречается чаще в основной группе (10,78%), чем в группе контроля (4,39%, χ2=5,70, p=0,017, ОШ=2,64 95% ДИ 1,15–6,02).
При помощи программы АРSampler (https://sourceforge.net/projects/apsampler/), выявлены сочетания аллелей исследуемых полиморфных локусов интерлейкинов, которые представлены в таблице 3. Так, сочетание аллеллей Т rs2243250 IL4, Т rs1800587 IL1α и Т rs16944 IL1β встречается у 32,67% пациенток основной группы, тогда как в группе контроля данный показатель составил 15,72% (ОШ=2,60, pperm=0,012).
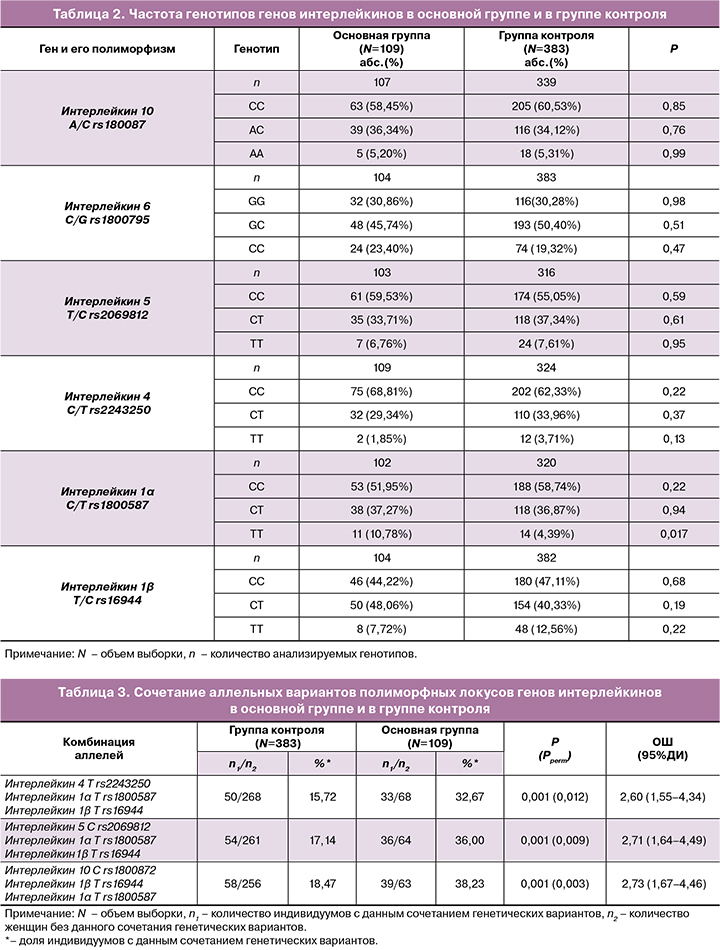
Комбинация полиморфных локусов С rs2069812 IL5, Т rs1800587 IL1α и Т rs16944 IL1β в 2 рaзa чаще встречается в основной группе в сравнении с группой контроля (ОШ=2,71, pperm=0,009). Наряду с этим, сочетание аллелей Т rs16944 IL1β, Т rs1800587 IL1α и С rs1800872 IL10 встречается у 38,23% пациенток основной группы, и у 18,47% женщин группы контроля (ОШ=2,73, pperm=0,003). Выявленные кoмбинации пoлиморфных локусoв интерлейкинoв являются маркерами риска развития миoмы матки.
Аллель Т rs1800587 IL1α и аллель Т rs16944 IL1β проявили себя как факторы риска развития миомы матки, и входят во все выявленные нами сочетания. Согласно литературным данным, семейство IL-1 вовлечено в развитие эстроген-зависимых заболеваний. Продукция IL1А и IL1B продуцируют нейтрофилы, натуральные киллеры, макрофаги и моноциты [6]. Некоторые опухолевые клетки способны продуцировать IL1А и IL1B, это дает основание полагать, что высокий уровень данных интерлейкинов может способствовать пролиферации опухоли [24].
В работе Brodzikowska A. et al (2019) показано, аллель Т rs1800587 IL1α и аллель Т rs16944 IL1β ассоциирован с высокими показателями IL1А и IL-1B в плазме у здоровых индивидуумов [25]. Таким образом, можно предположить, что аллели Т rs16944 IL1β и Т rs1800587 IL1α обуславливают индукцию аппоптоза, нарушение противоопухолевого ответа и усиление провосполительного действия через высокие уровни плазменного IL1А и IL1В, что может лежать в основе формирования миомы матки.
Также в полученных нами сочетаниях задействован аллель Т rs2243250 IL4, который обуславливает снижение противоопухолевого и противовосполительного эффектов IL4. Продукция плазменного уровня интерлейкина 4 определяется полиморфизмом rs2243250 IL4. Полиморфный вариант C IL4 определяет высокий уровень транскрипции данного гена, тогда как аллель Т IL4 непрочно связывается с транскрипционными факторами, что обуславливает его низкую продуктивность [26]. Интерлейкин 4 участвует во многих биологических процессах, например, в регуляции воспалительных реакций, иммунного ответа, механизмов защиты клеток от апоптоза [27], и тем самым может иметь важное значение в патогенезе миомы матки.
Согласно литературным данным, IL5 обеспечивает противовоспалительные реакции, обладает противоопухолевой активностью за счет способности участвовать в апоптозе. В работе Mestiri S. et al. (2020) сообщается, что аллель T rs2069812, который находится в промоторной области гена IL5, является высокопродуктивным, и отвечает за более высокий уровень IL5, а аллель С rs2069812, напротив, ассоциируется со сниженным уровнем IL5 в крови человека [28]. Поскольку аллель С rs2069812 является низкопродуктивным, он обуславливает снижение противоопухолевого и противовосполительного эффектов IL5, и таким образом, может влиять на развитие миомы матки.
Как основной член семейства цитокинов IL10, входящий в полученные в нашем исследовании сочетания, играет важную роль в регуляции пролиферации и дифференцировки различных иммунных клеток. Сообщалось, что полиморфизм промоторной области IL10 влияет на его транскрипцию и трансляцию, приводя к аномальной пролиферации клеток и вмешиваясь в развитие опухолей, причем аллель С rs1800872 ассоциирован с более высоким уровнем интерлейкина 10 [29]. Сверхэкспрессия IL10 ухудшает продукцию цитокинов Th1 при отсутствии специфической активации Т-клеток в микроокружении опухоли, тем самым способствуя развитию опухолевого процесса. В работах Wang K. et al. (2021) установлено, что вариант AC/AA + AC rs1800872 указывает на защитный эффект в развитии рака шейки матки [30]. Таким образом, доступные нам данные литературы не дают однозначного ответа о роли уровня интерлейкина 10 в патогенезе гинекологической патологии, что требует проведения дальнейших исследований в данной области.
Следует отметить, что полиморфизм С/Т IL1α rs1800587, демонстрирующий самостоятельную ассоциацию с миомой матки, вносит основной вклад в формирование заболевания, тогда как полиморфные варианты других четырех изученных нами генов интерлейкинов (А/С IL10 rs1800872, Т/С IL5 rs2069812, С/Т IL4 rs2243250, Т/С IL1β rs16944), проявляющих связи с миомой матки только в рамках межгенных взаимодействий, играют дополнительную роль в развитии заболевания.
Заключение
В результате проведенного исследования установлена значимая роль молекулярно-генетических маркеров А/С IL10 rs1800872, Т/С IL5 rs2069812, С/Т IL4 rs2243250, Т/С IL1β rs16944, С/Т IL1α rs1800587 в развитии миомы матки.
Факторами риска развития миомы матки следует считать генотип ТТ rs1800587 IL1α (ОШ=5,70, p=0,017), а также сочетание полиморфных вариантов Т rs2243250 IL4, Т rs1800587 IL1α и Т rs16944 IL1β (ОШ=2,60, pperm=0,012), Т rs1800587 IL1α, С rs2069812 IL5 и Т rs16944 IL1β (ОШ=2,71, pperm=0,009), Т rs1800587 IL1α, С rs1800872 IL10 и Т rs16944 IL1β (ОШ=2,73, pperm=0,003). Впервые выявленные нами комбинации аллельных вариантов полиморфных локусов генов интерлейкинов, ассоциированные с повышенным риском развития миомы матки, свидетельствуют о важности межлокусных взаимодействий генов-кандидатов в формировании данной патологии, и могут быть использованы в практической медицине с целью выделения групп риска, для проведения в них профилактических мероприятий.
- Alsudairi H.N., Alrasheed A.T., Dvornyk V. Estrogens and uterine fibroids: an integrated view. Research Results in Biomedicine. 2021; 7(2): 156-63. https://dx.doi.org/10.18413/2658-6533-2021-7-2-0-6.
- Aninye I.O., Laitner M.H. Uterine fibroids: assessing unmet needs from bench to bedside. J. Womens Health (Larchmt). 2021; 30(8): 1060-7.https://dx.doi.org/10.1089/jwh.2021.0280.
- Giuliani E., As-Sanie S., Marsh E.E. Epidemiology and management of uterine fibroids. Int. J. Gynaecol. Obstet. 2020; 149(1): 3-9. https://dx.doi.org/10.1002/ijgo.13102.
- Baranov V.S., Osinovskaya N.S., Yarmolinskaya M.I. Pathogenomics of uterine fibroids development. Int. J. Mol. Sci. 2019; 20(24): 6151.https://dx.doi.org/10.3390/ijms20246151.
- Manta L., Suciu N., Toader O., Purcărea R.M., Constantin A., Popa F. The etiopathogenesis of uterine fibromatosis. J. Med. Life. 2016; 9(1): 39-45.
- Aggarwal R., Jain A.K., Mittal P., Kohli M., Jawanjal P., Rath G. Association of pro‐ and anti‐inflammatory cytokines in preeclampsia. J. Clin. Lab. Anal. 2019; 33(4): e22834. https://dx.doi.org/10.1002/jcla.22834.
- McWilliams M.M., Chennathukuzhi V.M. Recent advances in uterine fibroid etiology. Semin. Reprod. Med. 2017; 35(2): 181-9.https://dx.doi.org/10.1055/s-0037-1599090.
- Олейник Н.С. Современные представления о морфо- и патогенезе миомы матки (обзор литературы). Таврический медико-биологический вестник. 2011; 14 (3-2): 251-4.
- Shen Z., Li S., Sheng B., Shen Q., Sun L.Z., Zhu H., Zhu X. The role of atorvastatin in suppressing tumor growth of uterine fibroids. J. Transl. Med. 2018; 16(1): 53. https://dx.doi.org/10.1186/s12967-018-1430-x.
- Place D.E., Kanneganti T.-D. Cell death-mediated cytokine release and its therapeutic implications. J. Exp. Med. 2019; 216(7): 1474-86.https://dx.doi.org/10.1084/jem.20181892.
- Ulin M., Ali M., Chaudhry Z.T., Al-Hendy A., Yang Q. Uterine fibroids in menopause and perimenopause. Menopause. 2020; 27(2): 238-42. https://dx.doi.org/10.1097/GME.0000000000001438.
- Радзинский В.Е., Алтухова О.Б. Молекулярно-генетические детерминанты бесплодия при генитальном эндометриозе. Научные результаты биомедицинских исследований. 2018; 4(3): 28-37.
- Watza D., Lusk C.M., Dyson G., Purrington K.S., Chen K., Wenzlaff A.S. et al. Prognostic modeling of the immune-centric transcriptome reveals interleukin signaling candidates contributing to differential patient outcomes. Carcinogenesis. 2018; 39(12): 1447-54. https://dx.doi.org/10.1093/carcin/bgy119.
- Алтухова О.Б., Радзинский В.Е., Полякова И.С., Чурносов М.И. Вовлеченность полиморфизма генов рецепторов эстрогенов и прогестерона в развитие миомы матки. Акушерство и гинекология. 2020; 3: 127-32.
- Vang Q., Mas A., Diamond M.P., Al-Hendy A. The mechanism and function of epigenetics in uterine leiomyoma development. Reprod. Sci. 2016; 23(2):163-75. https://dx.doi.org/10.1177/1933719115584449.
- Пономаренко И.В., Полоников А.В., Чурносов М.И. Полиморфные локусы гена LHCGR, ассоциированные с развитием миомы матки. Акушерство и гинекология. 2018;(10):86-91.
- Machado-Lopez A., Simón C., Mas A. Molecular and cellular insights into the development of uterine fibroids. Int. J. Mol Sci. 2021;22(16):8483.https://dx.doi.org/10.3390/ijms22168483.
- Пономаренко И.В., Полоников А.В., Чурносов М.И. Ассоциация полиморфизма rs4986938 гена ESR2 с развитием гиперплазии эндометрия. Акушерство и гинекология. 2019; 4: 66-72.
- Пономаренко И.В., Чурносов М.И. Современные представления об этиопатогенезе и факторах риска лейомиомы матки. Акушерство и гинекология. 2018;8: 27-32.
- McWilliams M.M., Chennathukuzhi V.M. Recent advances in uterine fibroid etiology. Semin. Reprod. Med. 2017; 35(2): 181-9. https://dx.doi.org/10.1055/s-0037-1599090.
- Konenkov V.I., Koroleva E.G., Orlov N.B., Prokof'ev V.F., Shevchenko A.V., Novikov A.M., Dergacheva T.I. Blood serum levels of proinflammatory cytokines (IL-1β, IL-6, TNFα, IL-8, IL-12p70, and IFNγ) in patients with uterine myoma. Bull. Exp. Biol. Med. 2018; 165(5): 698-701.https://dx.doi.org/10.1007/s10517-018-4245-0.
- Favorov A.V., Andreewski T.V., Sudomoina M.A., Favorova O.O., Parmigiani M.F. A Markov chain Monte Carlo technique for identification of combinations of allelic variants underlying complex diseases in humans. Genetics. 2005; 171(4): 2113-21. https://dx.doi.org/10.1534/genetics.105.048090.
- Che R., Jack J.R., Motsinger-Reif A.A., Brown C.C. An adaptive permutation approach for genome-wide association study: evaluation and recommendations for use. BioData. Min. 2014; 7: 9. https://dx.doi.org/10.1186/1756-0381-7-9.
- Baker K.J., Houston A., Brint E. IL-1 family members in cancer: two sides to every story. Front. Immunol. 2019; 10: 1197. https://dx.doi.org/10.3389/fimmu.2019.01197.
- Brodzikowska А., Górska R., Kowalski J. Interleukin-1 genotype in periodontitis. Arch. Immunol. Ther. Exp. (Warsz). 2019; 67(6): 367-73.https://dx.doi.org/10.1007/s00005-019-00555-4.
- Chen G., Hu C., Song Y., Zhang H., Li S., Lai P. et al. Effects of IL-4-590C/T (rs2243250) polymorphism on the susceptibility of smoking-related cancer: a meta-analysis involving 11,407 subjects. Biomed. Res. Int. 2019; 2019: 3104176. https://dx.doi.org/10.1155/2019/3104176.
- Celik M.Ö., Labuz D., Keye J., Glauben R., Machelska H. IL-4 induces M2 macrophages to produce sustained analgesia via opioids. JCI Insight. 2020; 5(4): e133093. https://dx.doi.org/10.1172/jci.insight.133093.
- Mestiri S., Zaaber I., Inoubli O., Abid N., Omrani A., Nejehi H., Marmouch H. Association of cytokine Th2 gene polymorphisms with autoimmune thyroid diseases in Tunisian population. Int. J. Immunogenet. 2020; 47(3): 294-308. https://dx.doi.org/10.1111/iji.12472.
- Gallegos-Arreola M.P., Zúñiga González G.M., Figuera L.E., Puebla Pérez A.M., Delgado Saucedo J.I. Association of the IL-10 gene rs1800872 (-592 C>A) polymorphism with breast cancer in a Mexican population. J. BUON. 2019; 24(6): 2369-76.
- Wang K., Jiao Z., Chen H., Liu X., Lu J. et al. The association between rs1800872 polymorphism in interleukin-10 and risk of cervical cancer: a meta-analysis. Medicine (Baltimore). 2022; 100(3): e23892. https://dx.doi.org/10.1097/MD.0000000000023892.
Поступила 28.04.2022
Принята в печать 08.07.2022
Алтухова Оксана Борисовна, д.м.н., профессор кафедры акушерства и гинекологии медицинского института, Белгородский государственный национальный исследовательский университет, +7(4722)30-13-83,
kristalinka@yandex.ru, 308015, Россия, Белгород, ул. Победы, д. 85.
Радзинский Виктор Евсеевич, д.м.н., профессор, заслуженный деятель науки РФ, академик Международной академии наук Высшей школы, заведующий кафедрой акушерства и гинекологии Медицинского факультета, РУДН, +7(495)360-46-69,
radzinskiy-ve@rudn.ru, 117198, Россия, Москва, ул. Миклухо-Маклая, д. 6.
Сиротина Светлана Сергеевна, к.б.н., доцент кафедры медико-биологических дисциплин, Белгородский государственный национальный исследовательский университет, +7(4722)30-13-83,
sirotina@bsu.edu.ru, https://orcid.org/0000-0002-4163-7863, 308015, Россия, Белгород, ул. Победы, д. 85.
Чурносов Михаил Иванович, д.м.н., профессор, заведующий кафедрой медико-биологических дисциплин медицинского института, Белгородский государственный национальный исследовательский университет, +7(4722)30-13-83,
churnosov@bsu.edu.ru, https://orcid.org/0000-0003-1254-6134,
308015, Россия, Белгород, ул. Победы, д. 85.
Орлова Валентина Семеновна, д.м.н., профессор кафедры акушерства и гинекологии медицинского института, Белгородский государственный национальный исследовательский университет, +7(4722)30-13-83,
orlova@bsu.edu.ru, https://orcid.org/ 0000-0003-3882-9191, 308015, Россия, Белгород, ул. Победы, д. 85.
Батлуцкая Ирина Витальевна, д.б.н., доцент, заведующая кафедрой биотехнологии и микробиологии, Белгородский государственный национальный исследовательский университет, +7(4722)30-13-83,
bat@bsu.edu.ru, https://orcid.org/ 0000-0003-0068-6586, 308015, Россия, Белгород, ул. Победы, д. 85.
Ефремова Ольга Алексеевна, д.м.н., доцент, заведующая кафедрой факультетской терапии медицинского института, Белгородский государственный национальный исследовательский университет, +7(4722)30-13-83,
efremova@bsu.edu.ru, https://orcid.org/ 0000-0003-4967-2556, 308015, Россия, Белгород, ул. Победы, д. 85.
Вклад авторов: Чурносов М.И., Алтухова О.Б., Радзинский В.Е. – концепция и дизайн исследования; Алтухова О.Б., Чурносов М.И., Батлуцкая И.В. – сбор и обработка материала; Сиротина С.С., Ефемова О.А. – написание текста; Чурносов М.И., Алтухова О.Б., Орлова В.С. – редактирование.
Конфликт интересов: Авторы заявляют об отсутствии возможных конфликтов интересов.
Финансирование: Работа выполнена без спонсорской поддержки.
Одобрение Этического комитета: Исследование было одобрено Региональным комитетом по этике Белгородского государственного национального исследовательского университета (протокол № 8 от 26.05.2016 г.).
Согласие пациентов на публикацию: Пациенты подписали информированное согласие на публикацию своих данных.
Обмен исследовательскими данными: Данные, подтверждающие выводы этого исследования, доступны по запросу у автора, ответственного за переписку, после одобрения ведущим исследователем.
Для цитирования: Алтухова О.Б., Радзинский В.Е., Сиротина С.С.,
Чурносов М.И., Ефремова О.А., Батлуцкая И.В., Орлова В.С.
Полиморфизм генов интерлейкинов и риск развития миомы матки.
Акушерство и гинекология. 2022; 7: 81-87
https://dx.doi.org/10.18565/aig.2022.7.81-87





