Кардиальная патология является ведущей причиной материнской смертности во время беременности и в послеродовом периоде, составляя 2,24 на 100 тыс. родивших женщин; при этом более половины летальных исходов наступает вследствие ишемической болезни сердца, перипартальной кардиомиопатии (ПКМП) и расслаивающей аневризмы аорты [1]. ПКМП — это идиопатическая форма кардиомиопатии, проявляющаяся острой или медленно прогрессирующей сердечной недостаточностью (СН), обусловленной дисфункцией левого желудочка со снижением фракции выброса менее 45%, возникающая на поздних сроках беременности и в течение первых нескольких месяцев послеродового периода, при исключении любых органических заболеваний сердца [2]. Зачастую диагноз ПКМП является запоздалым, поскольку ее симптомы поначалу имитируют физиологические изменения на поздних сроках беременности и в послеродовом периоде, что приводит к значительной материнской смертности [3]. В последнее время частота выявления ПКМП растет, что связано, в том числе, с большей осведомленностью о данной патологии [2]. Распространенность ПКМП варьирует в зависимости от географического региона и установленных в нем критериев диагностики, в США составляя 1 случай на 1000-4000 беременностей [4], в ЮАР — 1:100, в Японии — 1:2000 [5].
Этиология и патогенез ПКМП до сих пор до конца неизвестны. К наиболее часто встречающимся факторам риска ее возникновения относят преэклампсию, возраст более 35 лет и подростковый возраст, ожирение, многоплодную беременность, гестационный сахарный диабет [6, 7].
Несмотря на тот факт, что функция левого желудочка восстанавливается у большей части родильниц, нередки и неблагоприятные исходы: формирование стойкой дисфункции левого желудочка, появление опасных для жизни предсердных и желудочковых аритмий, тромбоэмболические осложнения и внезапная сердечная смерть [8]. Материнская смертность вследствие ПКМП, по данным Kerpen et al. (2019), составляет 9%, с более высокими показателями в развивающихся странах (14%), по сравнению с развитыми странами (4%) [9].
В связи с высоким уровнем материнской летальности и развития сердечно-сосудистых осложнений Европейским кардиологическим обществом был создан регистр пациенток с ПКМП на основании данных из 49 стран, включающий 739 пациенток за 2012-2018 гг. [10]. В данный момент НМИЦ им. В.А. Алмазова также занимается разработкой Российского регистра ПКМП, что достаточно сложно вследствие отсутствия единой базы медицинских данных в нашей стране.
Вопрос тактики ведения пациенток с ПКМП как до родов, так и в послеродовом периоде остается открытым ввиду отсутствия принятых клинических рекомендаций для акушеров-гинекологов [11], поэтому особенно актуальным является обобщение опыта по ведению пациенток с такой редкой и сложной в диагностическом плане патологией.
Цель исследования: оценить клиническую характеристику группы пациенток с установленным диагнозом ПКМП, показания, сроки и способы их родоразрешения.
Материалы и методы
Проанализировано 36 случаев беременных пациенток и родильниц, поступивших с подозрением на ПКМП; в данный анализ включено 16 историй пациенток с подтвержденным в НМИЦ им. В.А. Алмазова диагнозом ПКМП с дебютом до (л=10) и после родоразрешения (л=6), что потребовало дополнительного анализа отдельно по группам в зависимости от срока манифестации.
Проведен ретроспективный анализ методов объективного, инструментального и лабораторного обследования беременных, родильниц и состояния плодов, выполненных с целью подтверждения диагноза, дифференциальной диагностики и оценки степени тяжести ПКМП. В структуру лабораторных методов обследования входили хемилюминесцентный иммуноанализ на микрочастицах с целью определения уровня тропонина I и электрохемилюминесцентный иммуноанализ на микрочастицах для определения уровня N-концевого пропептида натрийуретического гормона В-типа (NT-proBNP). В структуру инструментальных методов исследования входили трансторакальная эхокардиография с помощью ультразвукового сканера Philips iU22 xMatrix, магнитно-резонансная томография сердца с гадолинием, а также кардиотокография и допплерометрия сосудов системы мать-плацента-плод.
Исследование было одобрено Этическим комитетом организации (НМИЦ им. В.А. Алмазова Министерства здравоохранения РФ).
Статистический анализ
Описательные статистики получены с помощью пакета программ IBM SPSS Statistics (версия 28.0.0.0) и представлены как медиана и интерквартильный интервал в формате Me (Q1;Q3) вследствие того, что большинство их распределений отличны от нормального (тест Колмогорова-Смирнова). Риски, относительные риски (ОР) и доверительные интервалы (ДИ) к ним были рассчитаны для основной группы пациенток относительно группы всех рожениц центра за рассматриваемый период, а также группы всех рожениц с соматическими заболеваниями [12, 13]. За критический уровень значимости для точного критерия Фишера была принята величина p=0,05.
Результаты
Возраст пациенток варьировал от 19 до 46 лет, медиана возраста составила 34 года (23,5;39). Две пациентки (2/16; 12,5%) перенесли ПКМП в предыдущую беременность. Подавляющая часть пациенток были повторно беременными (12/16; 75%), 4/16 (25%) — первобеременными; при этом 7/16 (43,75%) пациенток были первородящими, 9/16 (56,25%) — повторнородящими. При анализе значимых фоновых состояний обнаружено, что ожирение имелось у 7/16 пациенток (43,75%), анемия тяжелой степени — у 2/16 пациенток (12,5%), в одном из случаев — аутоиммунного генеза, преэклампсия — у 6/16 пациенток (37,5%), в том числе тяжелая — в 1/16 случаев (6,25%).
Абсолютный риск развития ПКМП в общем количестве родов, принятых в перинатальном центре НМИЦ им. В.А. Алмазова за период с 2012 по 2021 гг., составил 0,068%, в группе рожениц с соматической патологией — 0,074%, в группе рожениц с болезнями системы кровообращения — 0,156%. Риск развития преэклампсии (в том числе — тяжелой) составил (таблица) в структуре общего количества родов — 12,7% (1,60%), в группе рожениц с соматической патологией — 13,8% (1,74%), в группе женщин с болезнями системы кровообращения — 29,1% (3,68%). Риск развития преэклампсии в группе ПКМП составил 37,5%. ОР развития преэклампсии в группе ПКМП по отношению ко всем родам оказался статистически значимым: ОР=2,954, 95% ДИ [1,568;5,566], так же, как и относительно группы пациенток с соматическими заболеваниями: ОР=2,717; 95% ДИ 1,442-5,120. По отношению к группе женщин с болезнями системы кровообращения ОР=1,287; 95% ДИ 0,683-2,425 и оказался статистически не значимым. ОР развития тяжелой формы преэклампсии в группе больных ПКМП незначимо отличался от 1 относительно этих двух групп рожениц.
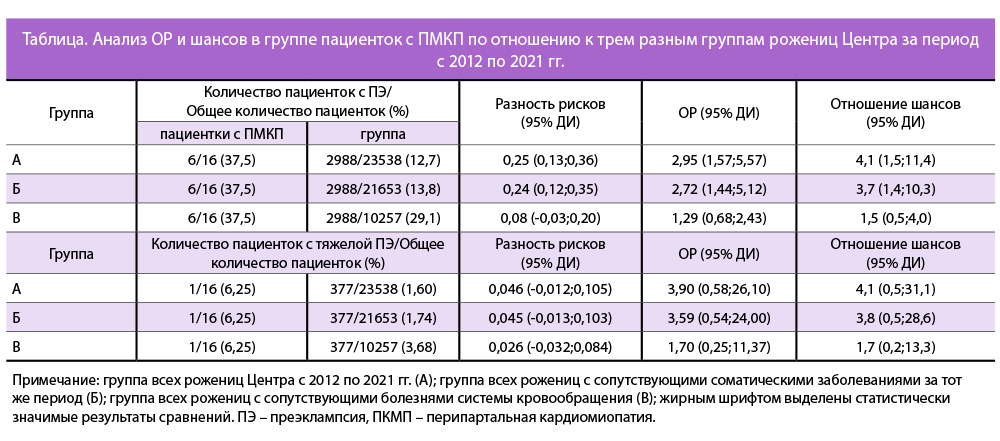
У 10/16 (62,5%) пациенток ПКМП манифестировала до родов, у 6/16 (37,5%) — в послеродовом периоде (рис. 1).
При анализе манифестной клинической симптоматики обнаружено, что наиболее частыми проявлениями ПКМП послужили симптомы левожелудочковой СН: одышка смешанного характера — в 10/16 (62,5%) случаев, ощущение сердцебиения — у 9/16 (56,25%), сухой кашель — у 3/16 (18,75%). В 6/16 случаях (37,5%) имело место острое начало ПКМП с появлением одышки в покое.
В соответствии с классификацией Европейского общества кардиологов (ЕОК, 2019) [14], в 3/16 случаях (18,75%) ПКМП соответствовала легкой степени тяжести, в 5/16 (31,25%) — средней, еще в 8/16 (50%) — тяжелой степени.
7/16 пациенток (43,75%) были госпитализированы в плановом порядке в отделение патологии беременности, 4/16 (25%) поступили в отделение анестезиологии-реанимации взрослых перинатального центра, 2/16 пациентки (12,5%) поступили с регулярной родовой деятельностью в родильное отделение; 3/16 пациентки (18,75%) поступили в отделение реанимации главного клинического корпуса переводом из других родильных домов.
При динамической оценке объективных показателей состояния пациенток сатурация выше 95% наблюдалась у 13/16 пациенток (81,25%), 3/16 пациентки (18,75%) потребовали респираторной поддержки.
При динамической оценке состояния плода у большинства пациенток размеры плода соответствовали сроку гестации (14/16; 87,5%). Синдром задержки развития плода 1 ст. диагностирован у 2/16 (12,5%) пациенток, нарушение плодовоплацентарного кровотока 1А ст. — в 1/16 (6,25%) случае, нарушение маточно-плацентарного кровотока 3 ст. — у 1/16 (6,25%) пациентки с повторно установленным диагнозом ПКМП и тяжелой преэклампсией.
На момент манифестации первых симптомов заболевания фракция выброса левого желудочка (ФВ ЛЖ) варьировала от 19 до 45%, медиана составила 38,5% (24,75; 40). Самое низкое значение ФВ ЛЖ составило 11% у пациентки, чей случай потребовал выполнения трансплантации.
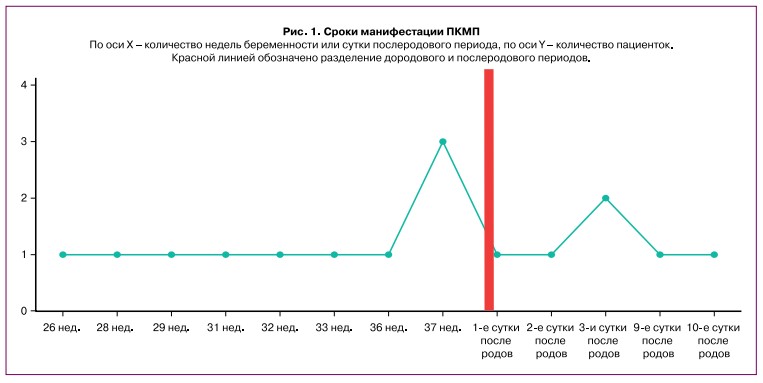
Медиана длительности пролонгирования беременности (рис. 2) с момента появления симптомов ПКМП у пациенток с манифестацией ПКМП до родов (и=10) составила 18 дней (2;49,5). Продолжительность пролонгирования беременности с момента поступления в стационар до родов у пациенток с манифестацией ПКМП, родоразрешенных по кардиологическим показаниям, варьировала от 0 до 7 дней, медиана — 2 суток (2;6).
По данным трансторакальной эхокардиографии у 7/16 (43,75%) пациенток была отмечена легочная гипертензия с повышением систолического давления в легочной артерии до 47-62 мм рт. ст. При проведении магнитно-резонансной томографии сердца с гадолинием у 16/16 (100%) пациенток наблюдалась дилатация левых камер сердца со снижением сократительной способности левого желудочка и ФВ ЛЖ менее 45%.
При оценке биохимических показателей, характеризующих функцию миокарда, обнаружено, что уровень NT-proBNP на момент постановки диагноза варьировал от 23,4 до >35 000 пг/мл, медиана составила 591 пг/мл (109,8175; 1912,25); значения тропонина I колебались от 0 до 0,39 нг/мл, медиана составила 0,02 нг/мл (0,0035;0,06).
Пациентки с манифестацией ПКМП до родов (и=10) в 100% случаев были родоразрешены путем операции кесарева сечения; в 7/10 (70%) случаев — на доношенном сроке беременности, в 3/10 (30%) — досрочно. 3 пациентки были родоразрешены по акушерским показаниям, среди которых: экстренное родоразрешение вследствие переднетеменного асин- клитизма головки плода II степени (1/10; 10%), а также плановое родоразрешение (2/10; 20%) вследствие наличия дихориальной диамниотической двойни в сочетании с рубцом на матке у пациентки Г. и полного предлежания плаценты у пациентки Ш. По кардиологическим показаниям была родоразрешена большая часть пациенток (7/10; 70%); при этом значимое снижение ФВ ЛЖ с явлениями декомпенсации СН послужило основанием для неотложного родоразрешения в 6/10 (60%) случаях, в т.ч. досрочного — в 3/10 (30%) случаях; в плановом порядке была родоразрешена 1 пациентка (10%) вследствие отсутствия экстренных показаний и стабильной гемодинамики на фоне сниженной ФВ ЛЖ (39%).
Среди пациенток с манифестацией ПКМП в послеродовом периоде (n=6) 2/6 (33,3%) пациентки были родоразрешены через естественные родовые пути, 3/6 (50%) — путем операции кесарева сечения в экстренном порядке, 1/6 (16,7%) — путем операции кесарева сечения в плановом порядке; во всех случаях оперативное родоразрешение проведено по акушерским показаниям. Одна из пациенток была родоразрешена досрочно вследствие краевой отслойки плаценты при наличии множественной миомы матки и регулярной родовой деятельности; 5/6 (83,3%) пациенток были родоразрешены на доношенном сроке. Обращают на себя внимание развитие у 1 (16,7%) из пациенток этой группы преждевременной отслойки нормально расположенной плаценты и антенатальная гибель плода вне лечебного учреждения.
В общей группе пациенток с ПКМП в 2/16 (12,5%) случаях была проведена экстирпация матки. У 1 (6,25%) пациентки развилось интраоперационное кровотечение в объеме 3700 мл. У второй пациентки во время операции произошла остановка кровообращения, потребовавшая выполнения сердечно-легочной реанимации; на этом фоне развилось интраоперационное кровотечение в объеме 800 мл и была произведена перевязка восходящей ветви маточной артерии с достижением устойчивого гемостаза. В это же время пациентке была имплантирована система экстракорпоральной мембранной оксигенации (ЭКМО) с неизбежным назначением гепарина, что привело к возобновлению кровотечения и выполнению экстирпации матки с маточными трубами; общая кровопотеря составила 1500 мл.
Оперативное абдоминальное родоразрешение проводилось в условиях регионарной анестезии (в 7/16 случаев — эпидуральная анестезия (43,75%), в 1/16 — спинальная (6,25%)) с сохраненным сознанием и спонтанным дыханием. При 5 (31,25%) операциях применяли общую комбинированную анестезию по эндотрахеальной методике. Во всех случаях использовали инвазивный мониторинг гемодинамики, включавший прямое измерение артериального давления и центрального венозного давления. У 2/16 (12,5%) пациенток в легочную артерию был установлен катетер Свана—Ганца, что позволяло измерять давление в легочной артерии и сердечный выброс.
В группе пациенток с ПКМП с манифестацией до родов (n=10) в 5/10 (50%) случаях оценка по шкале Апгар составила 8/9 баллов, в 4/10 (40%) — 7/8 баллов, в 1/10 (10%) — 6/7 баллов. В группе пациенток с ПКМП, развившейся в послеродовом периоде (n=6), в 2/6 (33,3%) случаях оценка по шкале Апгар составила 8/9 баллов, в 1/6 (16,7%) — 8/8 баллов, в 2/6 (33,3%) — 7/8 баллов, в 1/16 (16,7%) — 0/0 баллов вследствие антенатальной гибели плода вне лечебного учреждения у пациентки с преждевременной отслойкой нормально расположенной плаценты.
В послеоперационном периоде продолжали инвазивный мониторинг гемодинамики, у 5/16 (31,25%) пациенток использовали инотропные и вазоактивные препараты (дофамин, добутамин, эпинефрин, норэпинефрин). В 5/16 (31,25%) случаях в соответствии с рекомендациями ЕОК (2018) была проведена инфузия левосимендана (Симдакс, Орион, Финляндия). Медиана продолжительности пребывания в отделении реанимации и интенсивной терапии составила 6 (1;9) суток.
Большинство (14/16; 87,5%) случаев закончились благоприятным исходом с восстановлением ФВ ЛЖ до значений более 45% через год; у 1 из пациенток (6,25%) ФВ ЛЖ оценивалась через 3 месяца после дебюта ПКМП и на данный момент составляет 18%; скончалась 1 пациентка. Таким образом, летальность составила 6,25%. В 2/16 (12,5%) случаях у пациенток с манифестацией ПКМП до родов по жизненным показаниям в послеродовом периоде потребовалась установка систем механической поддержки кровообращения (ЭКМО по вено-артериальному контуру), длительность использования ЭКМО составила 19 и 54 дня; 1 (6,25%) пациентке была проведена ортотопическая трансплантация сердца.
В 7/16 (43,75%) случаях пациентки были выписаны из перинатального центра под амбулаторное наблюдение, в 8/10 (50%) — переведены в кардиологическое отделение с последующей выпиской в удовлетворительном состоянии.
Обсуждение
Вопрос об элективном родоразрешении у пациенток с ПКМП возникает во всех случаях развития такой редкой и сложной патологии во время беременности в связи с тяжестью и высокой летальностью ПКМП. Дифференциальная диагностика и своевременная установка диагноза ПКМП являются важными и решающими этапами на подступах к лечению и определению тактики ведения [14], что, в свою очередь, и определяет срок родоразрешения. Наиболее часто ПКМП манифестирует в послеродовом периоде [14]; однако, по данным популяционного исследования, проведенного в Южной Корее [6], ПКМП до родов была диагностирована у 48%; по данным Европейского регистра [10] ПКМП на дородовом этапе развилась у 34% пациенток. По результатам нашего исследования ПКМП манифестировала до родов у 62,5%, что, согласно рекомендациям по ведению пациенток с ПКМП [14], требует особенной настороженности акушера-гинеколога.
Ввиду того, что основными проявлениями ПКМП являются симптомы СН, врач акушер-гинеколог может не обратить должного внимания на жалобы пациентки (одышку при физической нагрузке, ощущение сердцебиения), поскольку эти симптомы поначалу имитируют физиологические изменения во время беременности (усталость, одышку при ходьбе и физической нагрузке, прибавку массы тела) [2], особенно на поздних ее сроках вследствие гиперволемии и увеличения высоты стояния дна матки — как раз в те сроки, когда может манифестировать ПКМП. Пароксизмы ортопноэ и ночной одышки указывают на развитие дисфункции левого желудочка, что требует обязательного дообследования.
По данным литературы [2, 10], чаще всего ПКМП манифестирует и диагностируется при наличии проявлений тяжелой СН III—IV функционального
класса по NYHA, что коррелирует с полученными нами данными, и это, вероятно, свидетельствует о том, что пациенткам с изначально более легкими ее проявлениями диагноз устанавливается только при прогрессировании СН. Поэтому исследовательской группой Sliwa K. [2] был предложен наглядный диагностический алгоритм для постановки диагноза ПКМП, определяющего дальнейшую тактику ведения таких пациенток (рис. 3).

Следует отметить, что несмотря на указание о развитии ПКМП именно в конце беременности и в послеродовом периоде [15], у одной из пациенток нашей группы 19 лет манифестация ПКМП имела место во II триместре беременности; в данном случае ПКМП была диагностирована во время двух предшествующих беременностей, и этот же случай закончился летальным исходом. Важно отметить, что наличие ПКМП в анамнезе у женщины (в особенности нескольких эпизодов) затрудняет последующее планирование беременности: согласно модифицированной классификации ВОЗ по материнским сердечно-сосудистым рискам [16], в случае перенесенной ПКМП и восстановленной ФВ ЛЖ остается значительный риск материнской смертности и высокий риск осложнений (ВОЗ III) в случае сохраняющегося снижения ФВ ЛЖ, что и имело место у указанной пациентки, беременность противопоказана вследствие чрезвычайно высокого риска материнской смертности или тяжелых осложнений, вероятность сердечно-сосудистых событий достигает 40-100%.
По данным Sliwa K. et al. (2021), среднее значение ФВ ЛЖ на момент постановки диагноза составляет 31% [2, 10]; в случае нашего исследования медиана ФВ ЛЖ составила 38,5%, что, вероятно, достигнуто широкими диагностическими возможностями нашего центра и более ранней диагностикой ПКМП. МРТ сердца с гадолинием, рекомендованная для дифференциальной диагностики ПКМП [3], в первую очередь с заболеваниями воспалительного и ишемического генеза, была проведена всем нашим пациенткам (100%) и выявила признаки дисфункции миокарда левых камер сердца, характерные для ПКМП. Данное исследование выполнялось в послеродовом периоде с учетом того, что гадолиний практически не проникает в грудное молоко.
Несмотря на тот факт, что ни один из лабораторных биомаркеров не может изолированно использоваться для подтверждения диагноза ПКМП, не являясь патогномоничным, в качестве дополнения к диагностике рекомендовано определение NT-proBNP и тропонина I [14, 17], что и было проведено нашим пациенткам: в 75% случаев уровень NT-proBNP превышал референсные значения, однако уровень тропонина I был повышен лишь в 1 (6,25%) случае до 0,39 нг/мл, что подтверждает его малую значимость для изолированной диагностики ПКМП и важность для дифференциальной диагностики с воспалительными и ишемическими заболеваниями миокарда. Перспективным направлением в настоящее время представляется определение уровня 16 кДа пролактина, микро-РНК146а и FMS-подобной тирозинкина- зы в крови пациенток, однако требуется проведение большего количества исследований [2].
Следует отметить несомненный вклад преэклампсии как фактора риска развития ПКМП [18]. В случае нашей исследуемой группы ОР развития преэклампсии у пациенток с ПКМП оказался статистически значимым (ОР=2,954), что коррелирует с опытом зарубежных коллег: по данным метаанализа Bello N. et al. (2013), частота преэклампсии у пациенток с ПКМП превышает популяционную более чем в 4 раза [19], что подтверждает тесную патогенетическую связь данных заболеваний.
Решение о пролонгировании беременности, сроках и способах родоразрешения должно приниматься совместно врачами-кардиологами и акушерами-гинекологами [20]. В случае исследуемой нами группы у пациенток с манифестацией ПКМП до родов пролонгирование беременности определялось стабильностью гемодинамики матери и отсутствием кардиологических показаний для досрочного или экстренного родоразрешения. Проводились оценка гемодинамики с помощью мониторинга сатурации, артериального давления и пульса, эхокардиографии с измерением ФВ ЛЖ каждые 3 дня, а также оценка ответа на лечение, которое включало в себя диуретическую терапию, применение селективных бета- 1-адреноблокаторов, профилактику тромбоэмболических осложнений, магнезиальную и антигипертензивную терапию в соответствии с существующими рекомендациями [4, 5, 16, 21].
ПКМП ассоциирована со значимо большей частотой преждевременного родоразрешения, чем группа контроля, по данным Dhesi S. et al. (2017) [22], — 25,4% против 8,6%. В нашем случае максимальное пролонгирование беременности у пациенток с ПКМП на фоне проводимого лечения в условиях стационара составило 7 суток; однако, учитывая дестабилизацию гемодинамики и явления декомпенсации, по кардиологическим показаниям досрочно были родоразрешены 30% пациенток, 40% — после 37 недель беременности.
Таким образом, если на фоне проводимой терапии отмечалось увеличение функционального класса СН, прогрессивное снижение ФВ ЛЖ, ухудшение лабораторных показателей (в том числе повышение NT-proBNP, нарушение электролитного баланса), а также нестабильность гемодинамики и необходимость в инотропной поддержке, пациентка родо- разрешалась вне зависимости от срока гестации, что коррелирует с опытом зарубежных специалистов [23].
Российским кардиологическим обществом (2018) родоразрешение путем операции кесарева сечения не было обозначено методом выбора при отсутствии акушерских показаний [21]; у пациенток со стабильной гемодинамикой роды предпочтительнее вести через естественные родовые пути с использованием эпидуральной анестезии и постоянным мониторированием гемодинамики. Кроме того, по данным наблюдательного исследования Ruys T.P. et al. (2015), для пациенток с кардиальной патологией плановое кесарево сечение не является более безопасным способом родоразрешения, чем запланированные роды через естественные родовые пути [24]. В нашем исследовании подавляющая часть пациенток имела нестабильную гемодинамику с декомпенсацией явлений СН и ухудшением состояния беременной; у некоторых пациенток имелись акушерские показания к оперативному родоразрешению. Поэтому 100% пациенток с манифестацией ПКМП до родов были родоразрешены путем операции кесарева сечения. В свою очередь, по данным Sliwa K. et al. (2020) [10], родоразрешение пациенток с развитием ПКМП до родов чаще проводится путем операции кесарева сечения вследствие нестабильной гемодинамики, как и в случае нашего исследования.
Тем не менее при определении способа родораз- решения следует учитывать, что оперативное родо- разрешение пациенток с ПКМП ассоциировано с более высокими рисками развития кровотечения, инфекционных и тромбоэмболических осложнений [4]. Кроме того, нет данных о связи элективного кесарева сечения или индукции родов с улучшением перинатальных исходов и полным устранением клинических проявлений ПКМП [25], что коррелирует с данными нашего исследования, т.к. 20% пациенток с манифестацией ПКМП до родов в послеродовом периоде потребовали имплантации системы ЭКМО. Нет достоверных данных и о том, что досрочное родоразрешение останавливает прогрессирование СН или улучшает ФВ ЛЖ [8], не обязательно снижая связанные с этим материнские риски [23]. После родоразрешения, независимо от его срока и способа, происходят гемодинамические изменения в виде аутотрансфузии около 500 мл крови из маточно-плацентарного ложа в системный кровоток матери, что увеличивает преднагрузку и сердечный выброс [23]. Кроме того, увеличивается венозный
возврат вследствие устранения компрессии системы нижней полой вены беременной маткой, а также усиленной мобилизации и резорбции жидкости, что также следует учитывать в отношении развития отека легких в послеродовом периоде, контроля водного баланса и возможного назначения диуретической терапии [4, 8].
При динамической оценке состояния плода на себя обращал внимание парадоксальный факт: несмотря на нарастание явлений СН у матери, нестабильность гемодинамики и низкую ФВ ЛЖ, только в 2 случаях обнаружены нарушения маточно-плацентарно-плодового кровотока и синдром задержки развития плода. По данным Maheu-Cadotte M.A. et al. (2019) [26], тяжесть состояния матери не влияет напрямую на исходы для плода и новорожденного. Тем не менее ПКМП ассоциирована с увеличением неблагоприятных исходов у новорожденных, включая повышенный риск рождения ребенка, маловесного к сроку гестации, и более низкие баллы по шкале Апгар как на 1-й, так и на 5-й минутах [3, 23, 25]. Однако в нашей исследуемой группе с манифестацией ПКМП до родов лишь в 1 случае оценка по шкале Апгар составила 6/7 баллов у пациентки с повторно диагностированной ПКМП и тяжелой преэклампсией, родоразрешенной на сроке 266/7 недель.
В послеродовом периоде большинством авторов рекомендуется проводить тщательный гемодинамический мониторинг и мониторинг диуреза в течение 12-24 ч, предпочтительно в отделении интенсивной терапии [14, 23], что также проводилось у 100% наших пациенток с манифестацией ПКМП до родов. В 31,25% случаев в послеродовом периоде проводилась инфузия левосимендана. По данным рандомизированного клинического исследования с участием 24 женщин с ППКМ, проведенного Biteker M. et al. (2011), не было обнаружено положительного влияния левосимендана на восстановление ФВ ЛЖ при добавлении к стандартному протоколу лечения СН [27]. Однако в более новом исследовании Labbene I. et al. (2017) применение левосимендана приводило к значимому быстрому улучшению систолической функции и стабилизации гемодинамики у пациенток с ПКМП [28]; кроме того, по данным Европейского кардиологического общества, левосимендан является предпочтительным препаратом для инотропной поддержки у пациенток с ПКМП [16].
Женщины с ПКМП имеют более благоприятный прогноз в отношении восстановления ФВ ЛЖ, нежели пациентки с другими формами дилатационной кардиомиопатии [3]. Частота полного восстановления ФВ ЛЖ варьирует, в зависимости от географического региона, из которого поступают данные, и от принятых в нем значений «восстановленной» ФВ (40, 45, 50%): от 28% — в Гаити до 43% — в Израиле; 48% — в Турции, 47% — в Германии, 55% — в Южной Африке, 63% — в Японии и 67% — в Дании; от 23 до 72% — в США [3]. В нашем исследовании ФВ ЛЖ восстановилась до значений более 45% у 87,5% пациенток. Вероятно, такой высокий показатель объясняется комплексным подходом и участием мультидисциплинарной команды в лечении пациенток с ПКМП, а также динамическим наблюдением в послеродовом периоде. Время, в течение которого происходит восстановление функции левого желудочка, также варьирует в разных странах [15], свидетельствуя о важности последующего амбулаторного ведения пациенток, которое имело место в 93,75% случаев нашего исследования.
По данным регистра США (2004-2011), пациенткам с ПКМП механическая поддержка кровообращения требуется в 1,5% случаев, трансплантация сердца — в 0,5% [3]. По данным Rasmusson K. et al. (2012), у пациенток с ПКМП отмечается более высокая частота отторжения трансплантата по сравнению с группой контроля [29]; в то же время, по результатам исследования, проведенного Bouabdallaoui N. et al. (2018), достоверных различий в отношении частоты развития осложнений, связанных с трансплантацией сердца, обнаружено не было [30]. В нашем исследовании лишь 1 пациентке была проведена ортотопическая трансплантация сердца по бикавальной методике, осложнившаяся развитием оппортунистической инфекции; 2 пациенткам потребовалась имплантация системы ЭКМО. Обе эти пациентки имели высокие значения уровня NT-proBNP, тяжелую степень ПКМП с ФВ ЛЖ менее 25% до родоразрешения и декомпенсацией СН с кардиогенным отеком легких; у 1 из этих пациенток имела место массивная кровопотеря (1500 мл) во время операции кесарева сечения, у другой — тяжелая преэклампсия с плохим ответом на проводимую антигипертензивную терапию.
Заключение
ПКМП является редкой патологией с высокой частотой осложнений и материнской смертностью. На основании анализа клинических случаев ПКМП в НМИЦ им. В.А. Алмазова проведена оценка показаний к родоразрешению, в 70% случаев выявлены кардиологические показания вследствие декомпенсации явлений СН, несмотря на проводимую терапию. Тяжесть состояния женщины определялась именно течением ПКМП; кроме того, в 37,5% случаев несомненный вклад вносила преэклампсия. Вопрос о тактике ведения и родоразрешении пациенток с ПКМП решается индивидуально, поэтому обобщение опыта, основанного на клинических случаях 16 пациенток, имеет огромное значение для дальнейшей разработки акушерских клинических протоколов.



