Врожденные пороки легких – это группа аномалий, включающая врожденную кистозно-аденоматозную мальформацию легких (КАМЛ), легочные секвестры (ЛС), бронхолегочные кисты, врожденную лобарную эмфизему, агенезию и гипоплазию легкого [1, 2]. Встречаются они достаточно редко – 30–42 случая на 100 000 человек, составляя 5–18% всех врожденных пороков [3].
КАМЛ – это участок легочной ткани, в котором из-за фокальной дисплазии происходит пролиферация терминальных бронхиальных структур и образуются множественные мелкие или крупные кисты, выстланные респираторным эпителием [3, 4]. Участки КАМЛ сообщаются с бронхиальным деревом и кровоснабжаются из ветвей легочной артерии [4, 5].
ЛС представляет собой участок нефункционирующей легочной ткани, не сообщающийся с бронхиальным деревом и получающий центральное кровоснабжение от ветвей аорты [3, 6]. Секвестры делят на интралобарные (внутрилегочные) и экстралобарные (внелегочные) [1, 7]. Интралобарные ЛС (75%) расположены внутри доли легкого и не имеют собственной плевры, а экстралобарные секвестры (25%) полностью отделены от нормального легкого и покрыты собственной висцеральной плеврой [5, 6, 8]. КАМЛ и ЛС – наиболее часто встречающиеся врожденные пороки легких; причем примерно в 25% случаев имеется их сочетание (так называемое «гибридное» поражение легких) [1, 2, 5, 9].
Врожденные пороки легких в большинстве случаев диагностируют антенатально при ультразвуковом исследовании (УЗИ) плода [10]. Клинические проявления постнатально варьируют: от полностью бессимптомного течения и спонтанного регрессирования до кашля, рецидивирующих пневмоний, кровохарканья, гемо- и пневмоторакса [2, 3, 5, 9]. Редко заболевание манифестирует в неонатальном периоде явлениями респираторных нарушений, сердечной недостаточности и легочной гипертензией [11, 12].
Клиническое наблюдение
Представляем вниманию данные из истории развития мальчика Ф., рожденного у матери 34 лет с отягощенным акушерским анамнезом (внематочная беременность, тубэктомия), от IV беременности после ЭКО, протекавшей на фоне угрозы прерывания в I триместре. Впервые признаки врожденного порока легких выявлены по месту проживания женщины по данным антенатального УЗИ на сроке 20 недель гестации в виде значительного увеличения размеров и повышения эхогенности ткани левого легкого плода, смещения органов средостения вправо и выраженной компрессии сердца и правого легкого. Для определения тактики ведения проведена консультация по каналу телемедицинской связи со специалистами Центра, принято решение о пролонгировании беременности, определены сроки повторных УЗИ и назначена дата очного консилиума в Центре. При контрольном УЗИ в Центре данных за врожденные пороки легких и смещение органов средостения не получено, рекомендовано родоразрешение с последующим обследованием новорожденного для исключения аномалии развития легких.
Роды II, своевременные физиологические, 8/9 баллов по Апгар; после рождения дыхание ребенка самостоятельное, признаки дыхательной недостаточности отсутствовали. По данным лабораторного обследования – лейкоцитоз 31,2 тыс./мкл со сдвигом лейкоцитарной формулы влево; по результатам обзорной рентгенографии органов грудной клетки в прямой проекции – зона неоднородной пневматизации легочной ткани в проекции нижней доли левого легкого без смещения средостения (рис. 1а); по данным УЗИ плевральных полостей – слева в ткани легкого определяется участок повышенной эхогенности размерами 30×25×28 мм с единичными локусами газа, визуализируется дополнительный крупный сосуд 2,8 мм с артериальным типом кровотока (рис. 2). По данным эхокардиографии (ЭхоКГ) в возрасте 2 ч жизни картина соответствовала возрасту – правый желудочек преобладал в размере относительно левого, функционировали артериальный проток диаметром 5,8 мм и межпредсердное сообщение размером 4,5 мм с перекрестным сбросом крови. С конца первых суток жизни у ребенка отмечали постепенное нарастание частоты дыхания до 60–70 в минуту, более выраженное при беспокойстве и физической нагрузке, к 6-м суткам жизни наблюдалось подключение к акту дыхания вспомогательной мускулатуры.
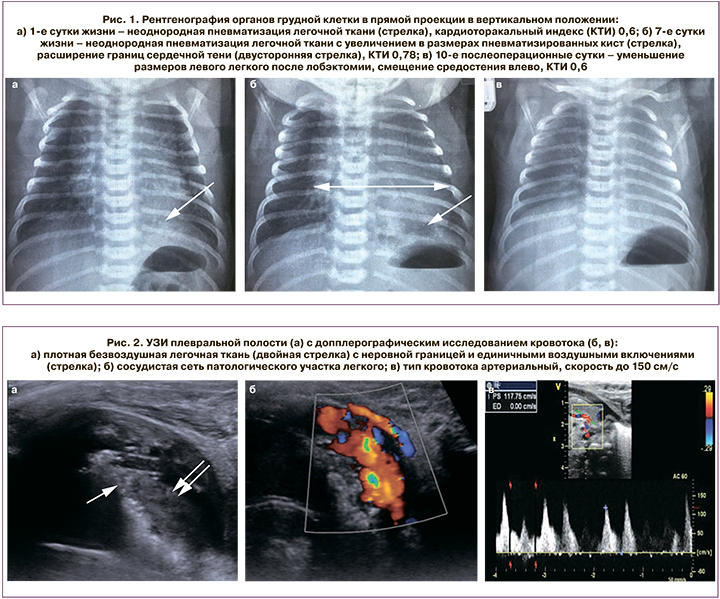
На 6-е сутки жизни выполнена мультиспиральная компьютерная томография (МСКТ) органов грудной клетки с контрастированием: в нижней доле левого легкого расположена зона измененной ткани, представленная мягкотканным компонентом в IX и X сегментах, с неровными нечеткими контурами, по периферии которого, с распространением на VII и VIII сегменты, имеются участки повышенной пневматизации с множественными мелкими воздушными кистами. При контрастировании определяются два аномальных питающих сосуда из нижнегрудного отдела аорты; дренирование крови осуществляется частично по аномальной вене в верхнюю полую вену и правое предсердие, частично по легочным венам в левое предсердие. Остальные отделы правого и левого легких структурно не изменены. Данные изменения соответствуют комбинации интралобарного секвестра и врожденной кистозно-аденоматозной мальформации нижней доли левого легкого (рис. 3).
При ЭхоКГ на 7-е сутки жизни впервые выявлены расширение правых и левых отделов сердца, появление признаков легочной гипертензии, недостаточности митрального и трикуспидального клапанов. При сравнении данных обзорной рентгенографии грудной клетки на 1-е и 7-е сутки жизни выявлено нарастание КТИ с 0,6 до 0,78 (рис. 1б). С учетом сохраняющегося лейкоцитоза заподозрена манифестация инфекционного процесса, начат курс антибактериальной терапии, однако существенной динамики в состоянии ребенка не отмечено. По данным ЭхоКГ на 8-е сутки жизни – отрицательная динамика – нарастание право- и левожелудочковой сердечной недостаточности, легочной гипертензии, митральной и трикуспидальной недостаточности. При клиническом наблюдении сохраняется одышка, снижается темп диуреза. Совместно с детским кардиологом и реаниматологом проведен анализ имеющихся клинических и инструментальных данных – учитывая отсутствие структурных изменений сердца по данным ЭхоКГ и МСКТ, нарастание признаков сердечной недостаточности, вероятно, связано с гемодинамическими особенностями порока развития легкого – массивным шунтированием крови слева-направо и слева-налево через аномальные сосуды секвестра легкого.
Оптимальным решением проблемы является операция по прекращению сброса крови и восстановлению нормальной сердечно-легочной гемодинамики. Однако для получения адекватного результата оперативного вмешательства, минимизации интра- и послеоперационных осложнений требовалось купирование явлений сердечной недостаточности и легочной гипертензии. Разработана схема консервативной терапии с исключением физических нагрузок (зондовое питание), диуретической, инотропной терапии и целевой терапии легочной гипертензии. Учитывая патогенез нарастания давления в системе легочных сосудов по причине формирования дополнительного аномального круга кровообращения, для проведения целевой терапии легочной гипертензии был выбран неселективный антагонист эндотелиновых рецепторов типа ЕТА и ЕТВ (Бозентан). На фоне терапии состояние ребенка с положительной динамикой, отмечен регресс явлений сердечной недостаточности, компенсация кислотно-основного состояния и газового состава крови. Оксигенация поддерживалась дотацией диффузного кислорода через лицевую маску 1–2 л/мин. По данным ЭхоКГ в динамике – уменьшение размеров обоих желудочков сердца, снижение степени легочной гипертензии. Лабораторные данные – без признаков нарастания инфекционного процесса.
По достижении стабилизации состояния ребенка на 12-е сутки жизни выполнено оперативное лечение мини-инвазивным торакоскопическим доступом в объеме нижней лобэктомии слева с перевязкой аномальных сосудов (рис. 4). При ревизии выявлены четыре крупных питающих сосуда из нижнегрудного отдела аорты диаметрами 2 мм, два по 4 мм и 3,5 мм, а также отводящая вена в системный кровоток диаметром 5 мм. Лобэктомия выполнена в связи с поражением около 2/3 объема нижней доли левого легкого комбинированным пороком развития. Течение анестезии гладкое. Течение послеоперационного периода гладкое.
По результатам клинического наблюдения (купирование одышки, нормальные размеры печени), динамических Эхо-КГ (нормализация давления в правых отделах сердца и сокращения до нормальных размеров сердечных камер, отсутствие недостаточности на атриовентрикулярных клапанах), рентгенологических данных (нормализация КТИ) и в соответствии с рекомендациями кардиолога из терапии постепенно исключены инотропный препарат, диуретические и вазоактивные средства. При осмотре перед выпиской домой дыхание равномерно проводится во все отделы грудной клетки, хрипов нет, данных за дыхательную и сердечную недостаточность нет. По результатам УЗИ и рентгенографии легкие воздушны, признаков пневмоторакса и гидроторакса нет (рис. 1в). Ребенок выписан домой на 11-е послеоперационные сутки в удовлетворительном состоянии, спокойно перенес длительный авиаперелет из столицы в отдаленный регион страны. Катамнез в настоящее время составляет 4 месяца, отклонений в состоянии здоровья при наблюдении профильных специалистов и по данным инструментальных исследований нет.
Обсуждение
Диагностика врожденных пороков легких возможна при УЗИ плода начиная с 18–20-й недели гестации [2, 3, 10]. При этом в грудной полости выявляют микро- или макрокисты неправильной формы, солидные образования повышенной эхогенности с четкими контурами или смешанные кистозно-солидные образования [3, 10]. КАМЛ и ЛС внутриутробно имеют сходную ультразвуковую картину, что затрудняет их дифференциальную диагностику [3]. В сложных случаях, помимо УЗИ, рекомендуется проведение магнитно-резонансной томографии (МРТ) плода для выявления особенностей кровоснабжения обнаруженного патологического образования и других сопутствующих аномалий развития [2].
После рождения пациентам с антенатально выявленными пороками легких традиционно проводят рентгенографию грудной клетки, однако в данном случае метод имеет низкую чувствительность и не всегда может исключить наличие или подтвердить КАМЛ и ЛС [2, 3, 10, 13].
Ведущим дифференциальным признаком ЛС является обнаружение аномального добавочного (аберрантного) питающего сосуда, отходящего от аорты, при допплерографическом исследовании кровотока [11]. Тщательное обследование всех венозных отводящих сосудов может обнаружить добавочные сосуды с венозным типом кровотока, а также расширение нормальных вен, в которые происходит дренирование крови [11].
МСКТ с контрастированием считается золотым стандартом для диагностики ЛС, КАМЛ и гибридных поражений легких, поскольку позволяет точно определить размер и анатомическую характеристику образования, его васкуляризацию, а также обнаружить сопутствующие аномалии развития грудной клетки [2, 3, 8, 10, 14]. Контрастное исследование обязательно выполняется для оценки питающего и отводящего сосудов при планировании хирургического вмешательства [13, 14]. В последние годы все чаще альтернативу МСКТ грудной клетки в диагностике пороков развития легких стала составлять МРТ с контрастированием [2, 9, 10]. МРТ не несет лучевой нагрузки на пациента и обладает высокой информативностью при оценке мягкотканных и жидкостных образований, коими являются кистозные образования и ЛС, а также при оценке сосудистой анатомии [9]. Однако МРТ менее чувствительна, чем МСКТ, в оценке тонкостенных кист и участков эмфиземы легочной ткани, а также требует для проведения исследования больше времени и седации пациента [9, 10].
Большинство пациентов с КАМЛ и ЛС в неонатальном периоде не имеют клинических проявлений [2]. В ряде случаев описано спонтанное регрессирование образований легких, выявленных антенатально, вероятно, в результате апоптоза и прекращения кровоснабжения [2, 3]. У пациентов с пороками легких, подтвержденными при постнатальном исследовании, впоследствии могут появиться кашель, инфекции дыхательных путей (рецидивирующие пневмонии), кровохарканье, пневмо- и гемоторакс [2, 3, 6]. Помимо этого, существует риск малигнизации КАМЛ и ЛС – описаны случаи развития у таких пациентов бронхоальвеолярной карциномы, миксосаркомы, плевропульмонарной бластомы и рабдомиосаркомы [2, 3, 7]. Редко гибридные поражения легких и ЛС манифестируют сразу после рождения клиническими проявлениями сердечной недостаточности и редкой формы легочной гипертензии при значительном шунтировании крови через аномальные сосуды [6, 11, 12, 15].
Участки КАМЛ кровоснабжаются так же, как и нормальная ткань легкого, – получают венозную кровь из ветвей легочной артерии и дренируют ее в легочные вены, в то время как кровоснабжение ЛС имеет принципиальные отличия. Оба типа ЛС (интра- и экстралобарные) получают артериальную кровь из системных артерий – в подавляющем большинстве случаев из добавочных ветвей нисходящей части грудной аорты (в 73% случаев), реже – от брюшного отдела аорты, брыжеечной или селезеночной артерии (21% случаев), очень редко – из легочной артерии [6, 8]. В 79,1% наблюдений, по данным Y. Wei et al., кровоснабжение ЛС осуществлялось по одной артерии, в 16% – по двум, в 4,9% – более чем по двум артериям [8]. Дренирование венозной крови от интралобарных ЛС происходит в легочные вены, в то время как от экстралобарных ЛС в большинстве случаев – в системные вены [6, 8]. При дренировании крови от ЛС через легочные вены в левое предсердие происходит уникальное «лево-левое» шунтирование и увеличение левых отделов сердца в результате объемной перегрузки [6, 11, 12]. При дренировании крови в вены большого круга кровообращения (межреберные, парную и непарную, верхнюю или нижнюю полые вены) происходит «лево-правое» шунтирование с увеличением правых отделов сердца. Встречается и смешанное дренирование венозной крови от ЛС в системные и легочные вены [6]. В литературе описаны единичные случаи манифестации ЛС у новорожденных с клинической картины сердечной недостаточности и легочной гипертензии [11, 12, 15]. Сердечная недостаточность у новорожденных, как правило, является результатом значительного «лево-правого» шунтирования крови через септальные дефекты или открытый артериальный проток. При наличии у ребенка ЛС большого объема или при большом диаметре питающего его добавочного артериального сосуда создается значительный экстракардиальный шунт с последующей перегрузкой камер объемом, что при отсутствии лечения приводит к развитию застойной сердечной недостаточности и легочной гипертензии [6, 11, 12, 15]. Инволюция ЛС с хорошо развитым артериальным системным кровоснабжением маловероятна, что требует его раннего хирургического удаления во избежание осложнений.
Тактика ведения пациентов с КАМЛ и ЛС без клинических проявлений до сих пор является предметом обсуждений – некоторые исследователи предлагают вести таких пациентов консервативно, но большинство авторов рекомендуют проводить хирургическую резекцию из-за риска развития инфекции дыхательных путей, кровотечений и малигнизации [1, 2, 3]. В отношении пациентов с клиническими проявлениями мнения специалистов едины – им рекомендуется проводить резекцию путем секвестрэктомии или лобэктомии [1, 3]. Если клинические проявления или осложнения появляются сразу после рождения, состояние пациента в первую очередь следует стабилизировать и затем как можно скорее провести хирургическое вмешательство [1, 2].
Заключение
«Гибридное» поражение легких – сочетание КАМЛ и легочной секвестрации – редко встречающийся порок развития легких, который, как правило, диагностируется антенатально при УЗИ плода. После рождения такому пациенту рекомендуется проведение УЗИ легких, плевральных полостей, сердца и крупных сосудов с допплерографической оценкой кровотока, МСКТ и/или МРТ грудной клетки с контрастированием для уточнения диагноза. Из-за уникальных особенностей кровоснабжения ЛС в редких случаях порок может манифестировать в неонатальном периоде проявлениями сердечной недостаточности и легочной гипертензии, что требует проведения срочного хирургического вмешательства после стабилизации состояния ребенка.



