Нормальное течение послеродового периода во многом определяется процессами обратного развития матки, а также регенерацией ее раневой поверхности. Замедление процессов инволюции матки, особенно в первую неделю послеродового периода, создает угрозу развития септических осложнений. При недостаточной ретракции матки, особенно ее нижнего сегмента, облегчается доступ микроорганизмов в ее полость из влагалища и создаются условия для развития послеродового эндометрита. Факторы инфекционного риска, действующие на прегравидарном этапе, во время беременности создают определенные условия, так называемый «преморбидный фон», который становится основой реализации последующих воспалительных процессов. Множество исследований посвящено изучению вопросов состояния эндометрия в послеродовом периоде, в том числе при уже реализовавшемся воспалительном процессе [1–6]. Анализ литературы показал, что наименее изученной частью матки является миометрий. Это связано с тем, что проводить морфологическое исследование данной ткани во время беременности и в родах не представляется возможным. Изучению вопросов изменения гемодинамики, толщины миометрия посвящено множество работ [3, 7], но в плане изучения морфологии миометрия исследователи делают акцент на такие проблемы, как процессы приращения плаценты, преэклампсия, послеродовые кровотечения [8–10].
Целью исследования было изучение структуры нижнего сегмента миометрия у родильниц группы инфекционного риска с использованием морфологических и иммуногистохимических исследований.
Материалы и методы
Для реализации данной цели было набрано 18 образцов ткани миометрия нижнего сегмента матки.
В основную группу инфекционного риска (n=10) вошли беременные с острыми и хроническими очагами экстрагенитальной и генитальной инфекции, наличием обострения инфекционного процесса во время беременности и с отягощенным акушерским анамнезом: выкидыши, неразвивающиеся беременности, преждевременные роды, послеродовый эндометрит, сепсис в предыдущих беременностях.
Группу контроля (n=8) составили здоровые первобеременные пациентки с благоприятным течением беременности.
Все пациентки, включенные в исследование, родоразрешались путем операции кесарева сечения в плановом порядке. Показаниями для абдоминального родоразрешения в основной группе были: задержка роста плода, хроническая гипоксия плода. В группе контроля показанием для кесарева сечения явились: крупный плод, тазовое предлежание плода. Лапаротомия проводилась поперечным надлобковым разрезом. Кесарево сечение выполнялось в нижнем маточном сегменте поперечным разрезом. После извлечения плода по центру разреза из нижнего сегмента матки осуществлялся забор операционного материала – участок ткани миометрия размером 10×5 мм.
Исключением для данного исследования было наличие рубца на матке после предыдущей операции кесарева сечения, наличие острого воспалительного процесса любой локализации.
Полученный материал фиксировался по общепринятой методике: выдерживался в 10% нейтральном растворе формалина, затем промывался водой, обезвоживался спиртами и заливался в парафин. Для морфологического анализа использовали серийные срезы толщиной до 7 мкм, окрашенные гематоксилином и эозином.
В ходе иммуногистохимического анализа проводили верификацию и изучение распределения в ткани миометрия белков CD3 (Т-лимфоциты), CD20 (В-лимфоциты), CD68 (макрофаги) и актина. Использовались: моноклональные антитела к макрофагам CD68, CD3, CD20 (Dako), набор моноклональных антител к гладкомышечному актину (Actin, Skeletal Muscle Ab-2. Clone: ’5C5.F8.C7; alpha-Sr-1), антитела мышиные моноклональные к СD3 (Mouse anti CD3; пептид CD3egd/CD3w; Clone: F7.2.38; изотип: IgG1, разведение 1:30), антитела мышиные моноклональные к СД20 (Mouse anti CD20; BALB/C; Clone: L26; изотип: IgG2a, Kappa), антитела мышиные моноклональные к СD68 (Mouse anti CD68, macrophage; Clone: KP1; изотип: IgG1).
Результаты оценивали количественным методом. С этой целью применялась система компьютерного анализа микроскопических изображений, включающая микроскоп Nikon Eclipse E400, цифровую камеру Nikon DXM1200, персональный компьютер на базе Intel Pentium 6, программного обеспечения АСТ-1, версия 2.12, и «Видеотест-Морфология 5.0». Выбирали пять наиболее представительных полей зрения и производили фотосъемку при увеличении 400× (окуляр 10×, объектив 40×).
Статистический анализ
Статистический анализ полученных данных проводился с применением интегральной системы для комплексного статистического анализа данных STATISTICA 6.0. Рассчитывали основные статистические показатели (средняя, медиана, стандартное отклонение, верхний и нижний квартили, минимальное и максимальное значения) и проверяли вариационные ряды на характер распределения. Было установлено, что целесообразно использовать непараметрические критерии. Для сравнения групп по непрерывным количественным признакам использовали критерий Колмогорова–Смирнова. Для всех сравнений нулевая гипотеза отвергалась, а альтернативная принималась при p<0,05. Данные представлены в формате Me (Q1;Q3), где Me – медиана; квартили Q1 и Q3.
Результаты
Гистологическое исследование препаратов основной группы, окрашенных гематоксилином-эозином, показало, что в миометрии нижнего сегмента у родильниц инфекционного риска часто встречались зоны выраженного полнокровия сосудов, не типичные для родильниц группы контроля, а также разрастание соединительной ткани.
В образцах миометрия пациенток сравниваемых групп признаков острого воспаления с инфильтрацией мышечной ткани лейкоцитами и лимфоцитами не было выявлено. Отмечались лишь незначительные периваскулярные скопления этих клеток.
Морфометрический анализ проведен с помощью программы ImageJ 1.46 на дискриминированных масках изображения ядер разной формы. Сравнительный анализ всех препаратов в основной группе и группе контроля (по 50 полей зрения) с определением центральной тенденции (медиана) показал, что численная плотность ядер в миометрии нижнего сегмента матки сравниваемых групп статистически значимо не различалась (табл. 1).

Таким образом, в ходе обзорного и морфометрического гистологического исследования выявлена структурная сохранность миометрия нижнего сегмента у родильниц сравниваемых групп, различия выявлены по содержанию крови в сосудах и признакам разрастания соединительной ткани.
В ходе иммуногистохимического анализа проводили верификацию и изучение распределения в миометрии CD3-позитивных (Т-лимфоциты), CD20 (В-лимфоциты), CD68 (макрофаги) клеток и актина.
Установлено, что CD3-позитивные структуры выявлялись во всех образцах миометрия. Распределение и количество меченых Т-лимфоцитов у пациентов сравниваемых групп отличались. В миометрии нижнего сегмента основной группы пациенток CD3 клеток было больше, и они часто располагались группами между и внутри пластов миометрия.
Большая часть Т-лимфоцитов выявлялась вблизи крупных или мелких сосудов – периваскулярно, в виде одиночных клеток или инфильтрата. Инфильтратоподобные скопления Т-лимфоцитов чаще выявлялись в миометрии родильниц инфекционного риска.
Морфометрический анализ иммуногистохимических препаратов проводили с помощью программы ImageJ 1.46. На 8-битовых изображениях выделяли пороги гистограммы, соответствующие маркированным клеткам (рис. 1).
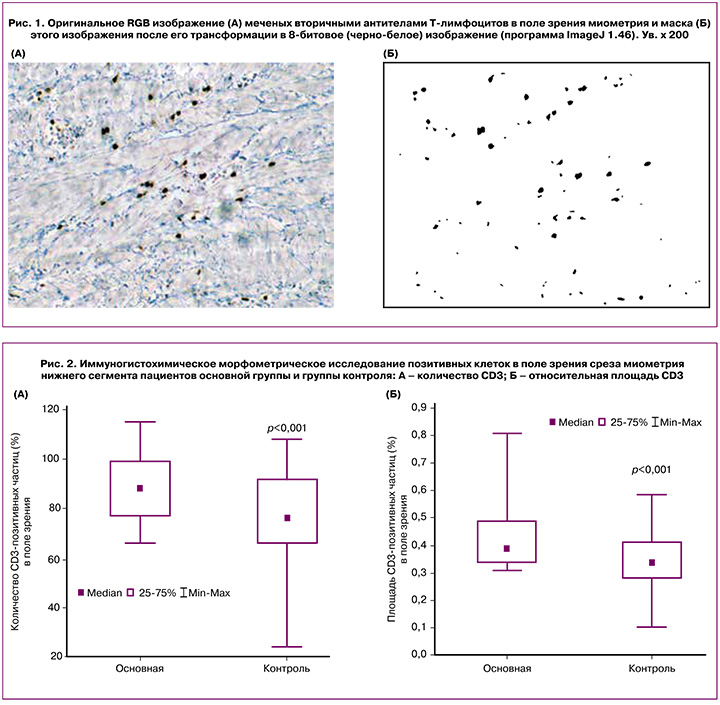
Дальнейший анализ проводили уже на полученных таким образом черно-белых изображениях. В каждой группе анализировалось по 70 полей зрения при увеличении ×10 (объектив), матрица цифровой камеры DCM500: 2592×1944 = 5.040.000 пикселей, размер пикселя – 2,2 мкм. Датчик изображения 1/2.2” КМОП.
С помощью инструментов программы ImageJ 1.46 определяли количество и относительную площадь частиц (%) в поле зрения. Подобный подход позволял провести морфометрический анализ очень точно.
Количество CD3-позитивных клеток в поле зрения среза нижнего сегмента миометрия у пациентов основной группы было на 17,0% выше, чем у пациентов группы контроля (рис. 2). Этот показатель отражает численную плотность CD3-позитивных клеток в единице площади среза. Однако необходимо отметить, что часть клеток имеет сложную форму, обусловленную наложением клеток друг на друга (рис. 2А). Это несколько снижало показатель плотности клеток.
Наиболее надежным для сравнения является показатель относительной площади (%) частиц, который полностью соответствует площади Т-лимфоцитов. Относительная площадь (%) CD3-позитивных клеток (Т-лимфоциты) в поле зрения среза миометрия нижнего сегмента у пациентов основной группы была на 21,0% выше, чем у пациентов группы контроля (рис. 2Б).
CD68 (макрофаги). Белок экспрессирован на моноцитах крови и тканевых макрофагах. Кроме этого, присутствует на лимфоцитах, фибробластах и эндотелиальных клетках. Макрофаги в тканях (гистиоциты), в отличие от Т-лимфоцитов, больше, имеют более сложную форму и выраженные отростки. Это приводит к тому, что их прокрашенные при проведении иммуногистохимической реакции отростки проникают между волокон миометрия. В сосудах выявлялись округлые CD68-позитивные клетки (вероятно, моноциты и лимфоциты).
В нижнем сегменте миометрия родильниц основной группы визуально выявлялось существенно меньше меток CD68 (рис. 3). Более точное представление о распределении CD68-позитивных клеток дало морфометрическое исследование с помощью программы ImageJ 1.46.

Как и при изучении CD68, в каждой группе анализировали по 70 полей зрения при увеличении ×10 (объектив), матрица цифровой камеры DCM500: 2592×1944=5.040.000 пикселей, размер пикселя – 2,2 мкм. Однако в отличие от круглых Т-лимфоцитов использовались иные вводные условия. Учитывались все частицы. Это позволило оценить площадь не только CD68-позитивных тел, но и отростков клеток (макрофагов).
В ходе анализа установлено, что относительная площадь (%) CD68-позитивных клеток (макрофаги) и их отростков в поле зрения среза нижнего сегмента миометрия у пациентов основной группы была на 19,9% ниже, чем у родильниц контрольной группы.
CD20 (В-лимфоциты). Лиганд рецептора CD20 неизвестен, белок участвует в обеспечении оптимального В-лимфоцитарного иммунного ответа, в частности, против T-лимфоцит-независимых антигенов. Регулирует активацию и пролиферацию В-лимфоцитов, экспрессирован на В-лимфоцитах. По данным нашего исследования, В-лимфоциты выявлялись преимущественно в сосудах в незначительном количестве. Морфометрический анализ не определил статистически значимых различий между группами ни по количеству, ни по площади CD20-позитивного материала.
Таким образом, по данным иммуногистохимического морфометрического анализа, структурно-функциональное состояние популяции CD3- и CD68-позитивных клеток в миометрии нижнего сегмента матки пациенток сравниваемых групп статистически значимо различались. Неблагоприятный анамнез у пациенток группы инфекционного риска сопровождается активацией Т-лимфоцитов и снижением активности тканевых макрофагов. Это свидетельствует о том, что после родоразрешения будут различаться и условия восстановления циркулярного миометрия нижнего сегмента матки. У женщин группы инфекционного риска снижается неспецифическая реакция (макрофагальный дифферон) на повреждение и происходит усиление клеточной иммунологической реактивности. Материальная основа гуморального иммунитета (В-лимфоциты), вероятно, не изменяется.
Иммуногистохимическое исследование актина позволило точно верифицировать и локализовать основной компонент сократительного аппарата гладкомышечных волокон миометрия и отделить эти волокна от окружающей соединительной ткани и сосудов (рис. 4А).
С помощью инструментов программы ImageJ 1.46 удалось четко разграничить актин-позитивные и актин-негативные структуры (зоны) миометрия (рис. 4Б), а также определить их относительную площадь.
Установлено, что в основной группе показатель площади актин-позитивных структур в различных полях зрения и у разных пациенток существенно варьирует (Min-Max) – от 15 до 82%; в группе контроля – от 50 до 80%. Центральные тенденции (медиана) этого показателя незначительно (на 5,5%), но статистически значимо (p<0,05) различались. Все это свидетельствовало о том, что у пациенток инфекционного риска структурно-функциональная основа сократительной функции циркулярного миометрия нижнего сегмента матки страдает. На единицу площади/объема миометрия у этой группы выявлялось меньше актина, чем у группы контроля. Особенно различались крайние варианты вариационных рядов (на 37%).
Таким образом, данные иммуногистохимического морфометрического анализа распределения и количества актина в поле зрения также не подтверждают нулевую статистическую гипотезу (принадлежность к одной и той же генеральной совокупности). Это может быть обусловлено либо увеличением содержания в миометрии нижнего сегмента соединительной ткани, которая является актин-негативной, либо изменением качества самого актина.
Определение качественных изменений актина (комплекса актин–меченые вторичные антитела) на иммуногистохимических препаратах мы проводили путем анализа гистограмм пиксельного состава изображений в различных зонах скопления актина (программы ImageJ 1.46). Для начала проведено сравнение различных зон актин-позитивных структур (мышечные волокна) на тестируемом поле зрения в основной группе, что не опровергло нулевую статистическую гипотезу – зоны идентичны, актин-позитивные структуры по степени связывания с антителами принадлежат одной и той же генеральной совокупности. На препаратах из группы контроля получены аналогичные данные. Это свидетельствует об однородности миометрия в различных частях нижнего сегмента у пациенток.
При сравнении гистограмм небольших участков миометрия нижнего сегмента на препаратах из разных групп выявлено некоторое видимое различие их формы. Однако сравнение количественных показателей пиксельного состава гистограмм различных зон миометрия у пациенток основной группы и группы сравнения не выявило статистически значимых различий между ними (близкие моды и средние). Это свидетельствует об идентичности свойств (связывание антител) миометрия у пациенток сравниваемых групп (табл. 2).
При сравнении целых полей зрения, а не отдельных фрагментов ткани нижнего сегмента миометрия выявлялись статистически значимые различия по содержанию светлых/темных пикселей. У пациенток группы контроля больше темных пикселей (мода – 100), соответствующих актин-позитивной мышечной ткани. По цветовому составу пиксели изображения не различались (табл. 2). Следовательно, у этих пациентов в циркулярном миометрии была меньше доля соединительной ткани (светлые пиксели ближе к 255 оттенку).
Сопоставление двух типов морфометрического исследования показало, что статистически значимые различия между группами пациентов обусловлены разным содержанием CD3-позитивных клеток (Т-лимфоциты) (табл. 3). Эти данные свидетельствуют о различии реакции лейкоцитарного и лимфоцитарного дифферонов крови у пациентов с благоприятным и неблагоприятным анамнезом.
Анализ гистограмм распределения пикселей в зонах мышечной ткани на препаратах, окрашенных гематоксилином и эозином, показал практически полную идентичность показателей (среднее, мода) для градаций серого и основных цветов (RGB) у пациенток основной группы и группы контроля. Полученные данные подтверждают данные анализа иммуногистохимических препаратов и свидетельствуют об одинаковых тинкториальных свойствах циркулярных мышечных волокон в сравниваемых группах.
Обсуждение
Воспалительные осложнения послеродового периода является основной причиной 11% материнской смертности. Беременные, имеющие очаги хронической генитальной и экстрагенитальной инфекции, входят в группу инфекционного риска по реализации осложнений гестационного периода. При беременности в организме возникают изменения, направленные на подавление провоспалительных иммунных реакций, что необходимо для снижения риска отторжения плодного яйца, но при этом одновременно создаются благоприятные условия для активации инфекционных процессов [11]. Поэтому сочетание инфекции и беременности является особо неблагоприятным [12].
Легкая, персистирующая и бессимптомная инфекция у беременной может привести к тяжелым осложнениям беременности (самопроизвольные выкидыши, неразвивающаяся беременность, преждевременные роды, аномалии прикрепления плаценты, синдром задержки роста плода) и родов (несвоевременное излитие околоплодных вод, слабость родовой деятельности, гипотония матки, кровотечения и послеродовые гнойно-септические осложнения) [13–15].
Особое значение имеют острые и обострение хронических инфекционных заболеваний во время беременности, большое число (высокий индекс) перенесенных воспалительных процессов, их повторность, длительность и тяжесть течения.
Развитие воспалительного процесса в послеродовой матке зависит от множества факторов. На происходящие в матке в послеродовом периоде инволютивные и провоспалительные процессы могут повлиять множество факторов. Имеют значение контаминация микроорганизмами, состояние макроорганизма, особенности течения беременности и самих родов, полноценность стенки матки. Состояние слизистой оболочки матки при наличии инфекционного процесса изучено достаточно широко [1–6], в то время как вопросы структуры миометрия изучены недостаточно. В литературе имеются единичные экспериментальные исследования гисто- и цитоструктуры миометрия послеродовой матки у животных [16]. В данных работах проводилось изучение состояния клеток миометрия с помощью электронной микроскопии, но не изучались клеточный состав и состояние основного контрактильного белка актина. В исследовании Ivanisevic M., проведенном в 2010 г., иммуногистохимически оценивалась панель антител, специфичных для Т-клеток, моноцитов, натуральных киллеров, В-клеток; однако сравнивались показатели беременных и небеременных пациенток, без оценки предрасположенности к воспалительным осложнениям послеродового периода [17].
В нашем исследовании проведена попытка оценить структуры миометрия матки в аспекте возможности реализации воспалительного процесса у родильниц инфекционного риска.
Полученные данные морфометрического анализа гистологических и иммуногистохимических препаратов пациенток группы инфекционного риска и группы контроля свидетельствовали о наличии статистически значимых различий по содержанию Т-лимфоцитов, макрофагов, площади соединительной ткани и мышечных волокон. У пациенток группы инфекционного риска чаще выявлялись небольшие очаги скопления Т-лимфоцитов. Признаков воспаления в сравниваемых группах выявлено не было. Все это свидетельствовало о том, что на момент взятия участка миометрия (во время операции кесарева сечения) структурно-функциональное состояние нижнего сегмента миометрия и его реактивность у пациенток обоих групп статистически значимо различались. У пациенток инфекционного риска относительная площадь CD3-позитивных структур в ткани была на 21% выше, чем в группе контроля на фоне снижения защитной функции тканевых макрофагов (относительная площадь CD68-позитивных структур была на 19,9% меньше, чем в группе контроля). Установлено, что в основной группе показатель площади актин-позитивных структур в циркулярном миометрии нижнего сегмента на 5,5% (p<0,05) был меньше, чем в группе контроля. Уменьшение структурно-функциональной основы сократительной функции миоцитов у родильниц группы инфекционного риска в послеродовом периоде может приводить к снижению контрактильной способности миометрия нижнего сегмента и, следовательно, к замедлению иволютивных процессов.
Проведенное исследование свидетельствовало о том, что у пациенток инфекционного риска страдает структурно-функциональная основа сократительной функции миометрия. Нарушение иволютивных процессов миометрия в пуэрперии создает благоприятные условия для восходящего проникновения возбудителей в полость матки и развития послеродового эндометрита.
Заключение
В ткани миометрия нижнего сегмента матки у беременных группы инфекционного риска, в сравнении с группой контроля, отмечается значимое (p<0,05) увеличение количества Т-лимфоцитов (CD3) на фоне снижения защитной функции тканевых макрофагов (CD68), а также снижение количества сократительного белка актина в гладкомышечных клетках на 5,5% (p<0,05), что в послеродовом периоде может приводить к снижению контрактильных свойств матки и к развитию послеродового эндометрита.



