Гипертензивные расстройства во время беременности (хроническая и гестационная гипертензия, преэклампсия) представляют собой уникальную проблему, поскольку данная патология и ее терапевтическое лечение одновременно влияют на мать и плод, иногда ставя их благополучие под угрозу. В частности, преэклампсия (ПЭ) – это специфичный для беременности синдром, являющийся основной причиной материнской и перинатальной заболеваемости и смертности, а также недоношенности новорожденных [1, 2]. На долю гипертензивных расстройств приходится около 10% беременностей, среди которых частота ПЭ может достигать 6–8% [3]. Наиболее важными клиническими параметрами для диагностики ПЭ являются наличие артериальной гипертензии и протеинурии после 20-й недели беременности. Однако ПЭ также может протекать под «маской» других заболеваний и осложнений, таких как плацентарная недостаточность, задержка роста плода, неврологические или гематологические нарушения, печеночная и почечная недостаточность и др., возникающих в отсутствие общепринятой клинической картины, что в значительной мере затрудняет ее диагностику [4–6].
ПЭ часто называют «болезнью теорий». Ее концепция на протяжении многих десятилетий трансформировалась из заболевания, специфичного для почек, ведущего к хроническому нефриту, в состояние токсемии, вызванное циркулирующими токсинами. С тех пор понимание патогенеза этого расстройства значительно расширилось. Выдвинуты теории о связи ПЭ с генетически обусловленными нарушениями, гормональными расстройствами, повреждением ворсин, патологией эндотелия, дисбалансом ангиогенных и антиангиогенных факторов, изменением коагуляционных свойств крови, волемическими и метаболическими нарушениями [7–10]. Несмотря на многообразие существующих теорий, большинство ученых сходятся на том, что в основе патогенетической составляющей ПЭ лежит усиление системной воспалительной реакции, которая может быть результатом эндогенной активации клеток врожденного иммунитета, таких как моноциты и гранулоциты, а также чрезмерной продукции провоспалительных цитокинов [7, 11–14].
Известно, что плацента является ключевым фактором в этиологии ПЭ, поскольку ее удаление необходимо для регресса симптомов данного осложнения. Немногочисленные работы указывают на то, что именно плацента принимает участие в активации клеток моноцитарно-макрофагального ряда. Моноциты крови выполняют важные иммунологические функции, такие как фагоцитоз, презентация антигена, секреция цитокинов и управление врожденным и адаптивным иммунным ответом [15–17]. Ранее мы показали, что во время беременности моноциты крови вызывают апоптоз полуаллогенного трофобласта с появлением фетальной ДНК в крови матери, причем данный процесс был более выражен в наблюдениях ПЭ [11, 18–20]. Это может являться ключевым фактором в реализации ПЭ, однако остается вопрос о механизмах активации моноцитов, приводящих в конечном счете к поражению плаценты при данном осложнении беременности. Можно предположить два варианта развития событий: в первом случае моноциты активируются непосредственно в кровотоке под воздействием антигенов плода и провоспалительных факторов плаценты, во втором случае необходим контакт моноцитов и антигенов на поверхности клеток плаценты [7, 11, 14, 21].
В данной работе нами была предпринята попытка подтвердить предположение о том, что моноциты могут активироваться при взаимодействии с клетками плаценты. Для этого было определено содержание клеток моноцитарно-макрофагального звена в плаценте при ПЭ различной степени тяжести.
Цель исследования: определить особенности содержания клеток моноцитарно-макрофагального звена в плаценте при ПЭ различной степени тяжести.
Материалы и методы
В исследование вошли 52 пациентки. Были сформированы две группы: основная – беременные с ПЭ (n=26) и группа сравнения – физиологически протекающая беременность (n=26). Основная группа была разделена на две подгруппы согласно тяжести ПЭ: умеренная – УПЭ (n=12) и тяжелая – ТПЭ (n=14) [11].
Данное исследование одобрено локальным Этическим комитетом. Все женщины были ознакомлены с целью, задачами исследования и подписали информированное согласие на участие в нем.
Критерии включения в исследование: одноплодная беременность в сроке от 22 до 40 недель гестации, возраст от 18 до 45 лет, отсутствие тяжелой экстрагенитальной патологии, наличие УПЭ или ТПЭ (для основной группы). Критерии исключения: многоплодная беременность, острые инфекционные, аутоиммунные и онкологические заболевания, беременность, наступившая в результате вспомогательных репродуктивных технологий, тяжелая экстрагенитальная патология [11, 21].
Проведены макро- и микроскопическая оценки 52 последов, а именно: плодных оболочек, пуповины и плаценты с целью верификации диагноза ПЭ, полученного в результате клинико-лабораторного обследования. С этой целью использовались образцы плацент, полученные не позднее 5–10 минут после родоразрешения. Исследовали небольшие фрагменты ткани плаценты (размерами 1,5×1,0×0,3 см) из парацентральной зоны (включающей ворсинчатый хорион, базальную и хориальную пластинки). Полученные кусочки фиксировали в 10% растворе забуференного нейтрального формалина (Biovitrum, Россия) в течение 24 ч, затем заключали в парафин, согласно стандартной методике, и в дальнейшем изготавливали срезы толщиной 4 мкм на ротационном микротоме Accu-Cut SRM 200 фирмы Sakura (Япония). Отдельно для проведения иммуногистохимического исследования полученные гистологические срезы наносили на высокоадгезивные стекла и высушивали вертикально в термостате при температуре 55–56°С в течение 10 ч. Депарафинизацию, восстановление антигенной активности и все этапы иммуногистохимической реакции, а также докраску гематоксилином проводили в иммуногистостейнере закрытого типа VENTANA BenchMark ULTRA фирмы Roche (Швейцария). Реактивы, используемые при окраске в иммуностейнере: Prep Concentrate (×10); раствор для депарафинизации EZ Prep, концентрат ×10; ULTRA LCS жидкое покровное стекло высокотемпературное; SSC раствор для денатурации, концентрат ×10; Reaction buffer Concentrat (×10) реакционный буфер, концентрат ×10; ULTRA CC1 (TRIS/Борат/ЭДТА буфер (CC1) для демаскировки антигена, разведенный; Hematoxylin II (гистологический краситель гематоксилин II ≤ 60%), диспенсер на 250 тестов или эквивалент; Bluing Reagent (реагент для придания окраске синего цвета). В качестве системы детекции первичных антител была использована ultraView Universal DAB Detectio». Для определения моноцитов в ворсинах плаценты использовали моноклональные кроличьи антитела против маркера моноцитов/макрофагов CD68 (Abcam, USA). Для этого проводили подсчет клеток по 10 полям зрения с каждого среза. Рассчитывали содержание CD68+ клеток в ворсинах плацент в процентах от общего количества клеток ворсин с использованием программы ImageJ (USA) [11, 19, 21].
Для подтверждения результатов иммуногистохимии использован метод вестерн-блот, состоящий из гель-электрофореза для разделения денатурированных белков по длине полипептида с последующим электрофоретическим переносом на мембрану (PVDF), процедуры иммуноокрашивания для визуализации исследуемого белка на мембране блоттинга. Перед электрофорезом образцы белка нагревали, чтобы денатурировать присутствующие белки. Это обеспечило разделение белков по размеру и предотвратило деградацию образцов протеазами. После электрофоретического разделения белки переносили на мембрану, где они блокировались молоком для предотвращения неспецифического связывания антител, а затем окрашивали антителами против белка CD68. Далее мембрана окрашивалась вторичным антителом, которое распознает первое окрашивание антителом, которое затем было использовано для обнаружения. В работе использованы антитела против CD68 (Abcam, USA) [11, 19, 21].
Статистический анализ
Результаты представлены в виде медианы, верхнего и нижнего квартиля Me (Q1;Q3). Рисунки представлены в виде диаграммы размаха (5%; Q1; Me; Q3; 95%). Статистическая значимость различий определялась с помощью непараметрического критерия Манна–Уитни. Для сравнения трех независимых групп использовали ранговый анализ вариаций по Краскелу–Уоллису. Сравнение групп по качественным признакам проводилось с помощью точного критерия Фишера. Различия считали статистически значимыми при p<0,05. При сравнении 3 групп применялась поправка на множественные сравнения. Для статистической обработки результатов и построения графиков использовались программы Attestat (Россия), Statistica 10 и OriginPro 8.5 (USA) [11, 19, 21].
Результаты
При анализе возраста беременных в группе с ТПЭ достоверно чаще встречались женщины более старшей возрастной группы (p=0,012) относительно группы сравнения. Индекс массы тела (ИМТ) пациенток был выше в группе с ТПЭ – 28,2 (24,9;31,2) относительно физиологической беременности – 25,1 (24,5;27,3) (р<0,001). В структуре соматической и гинекологической заболеваемости статистически значимых различий выявить не удалось. Срок родоразрешения беременных с УПЭ и ТПЭ был статистически значимо ниже по сравнению с контрольной группой (p<0,001), что, вероятно, обусловлено ухудшением состояния беременной и/или плода при ПЭ. Также при сравнительном анализе была установлена более высокая частота абдоминального родоразрешения в группах с ПЭ, однако статистически значимых различий выявить не удалось. Клиническая характеристика обследованных беременных представлена в таблице.
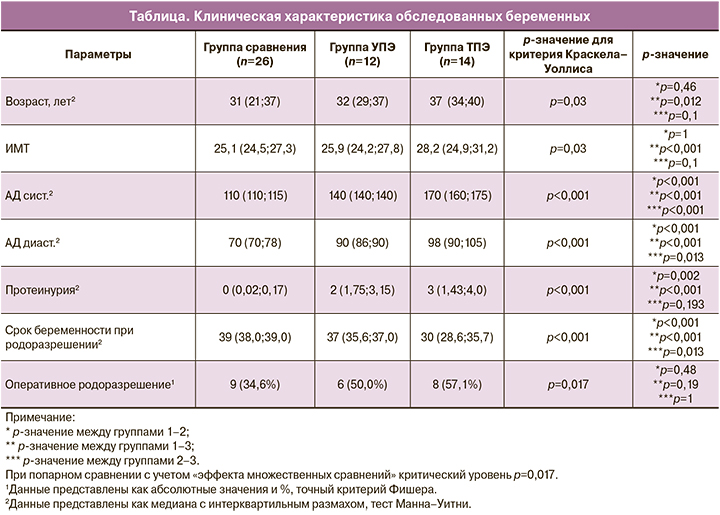
С применением иммуногистохимического метода изучено содержание CD68+ клеток в ворсинах плацент. На рисунках 1–3 представлены окрашенные CD68+ клетки внутри ворсин плаценты.
При сравнительном анализе содержания CD68+ клеток внутри ворсин в группах УПЭ и ТПЭ относительно физиологической беременности были получены статистически значимые различия между группами (p<0,001 в обоих случаях). Содержание CD68+ клеток при УПЭ составило 7,5% (5,6;8,3), при ТПЭ – 9,1% (6,5;10,8), в группе сравнения – 5,1% (2,5;5,3). Данные представлены на рисунке 4.
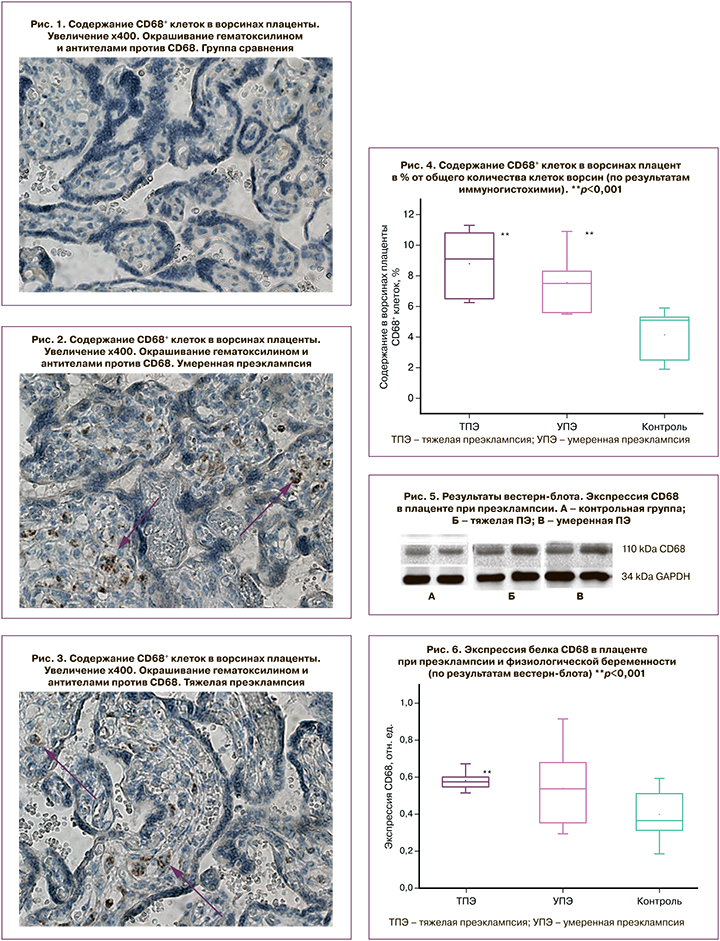
Результаты, полученные при иммуногистохимии, были подтверждены методом вестерн-блот. Данные представлены на рисунке 5.
При сравнительном анализе основной группы с физиологической беременностью удалось установить статистически значимые различия в уровне экспрессии белка CD68 при ТПЭ (p<0,001) и близкие к статистически значимым при УПЭ (p=0,056). Относительный уровень экспрессии белка CD68 в группе с УПЭ составил 0,52 (0,35–0,67) отн. ед., в группе ТПЭ – 0,57 (0,55–0,60) отн. ед., в группе сравнения – 0,36 (0,30–0,50) отн. ед. Данные представлены на рисунке 6.
Таким образом, было показано, что по мере прогрессирования степени тяжести ПЭ количество CD68+ клеток внутри ворсин плаценты увеличивается. Полученные результаты могут свидетельствовать о потенциальной роли плаценты как фактора активации клеток моноцитарно-макрофагального ряда.
Обсуждение
Кластер дифференцировки 68 (CD68) – гликопротеин из семейства LAMP, который экспрессируется на поверхности моноцитов и макрофагов и используется в качестве их маркера [20]. В проведенном исследовании по результатам иммуногистохимического анализа были получены данные, указывающие на повышение количества CD68+ клеток в ворсинах плаценты по мере прогрессирования степени тяжести ПЭ. Также достоверность полученных результатов была подтверждена методом вестерн-блот, при котором удалось выявить статистически значимые различия в экспрессии белка CD68 между исследуемыми группами с ПЭ и контрольной группой.
При анализе современной литературы обращает на себя внимание неоднозначность полученных результатов. Так, M.R. Bürk at al. [22] было отмечено снижение CD68+ клеток в плаценте. В работе Kim at al. [23] авторам не удалось обнаружить изменений при изучении состава данных клеток в плаценте. В то же время коллегами C.J. Lockwood at al. [24] и L.A Al-Khafaji at al. [25] было описано увеличение количества CD68+ клеток в ворсинах плаценты, что согласуется с нашими результатами.
Полученные в данной работе результаты позволяют предположить, что при ПЭ на территории хориона присутствуют моноциты крови матери в большем количестве, чем при нормальной беременности [26, 27]. Известно, что на территории плаценты также присутствуют CD68+ резидентные макрофаги (клетки Хофбауэра) [15, 17]. Однако наиболее вероятно, что при ПЭ происходит увеличение CD68+ клеток за счет материнских моноцитов, которые внедряются в ворсины плаценты, так как отличительным признаком ПЭ является повышенный апоптоз ворсин плаценты [18], а клетки Хофбауэра имеют фетальное происхождение и, являясь иммунотолерантными к плодовой части плаценты, не участвуют в повреждении ворсин. В данном исследовании удалось обнаружить корреляционную зависимость между количеством CD68+ клеток в ворсинах плаценты и тяжестью ПЭ. Известно, что с тяжестью ПЭ взаимосвязаны нарушения структуры и апоптоз клеток ворсин плаценты, а также уровень цитотоксических маркеров моноцитов материнской крови [11, 18, 20, 28, 29]. Эти результаты тоже косвенно подтверждают наше предположение, что моноциты материнской крови способны активироваться непосредственно на территории самой плаценты.
Заключение
Таким образом, при изучении CD68+ клеток в ворсинах плаценты была выявлена корреляционная зависимость между увеличением их содержания и тяжестью ПЭ, что может указывать на потенциальную роль плаценты в патогенезе ПЭ как активирующего цитотоксические свойства агента у моноцитов материнской крови.



