Применение полностью резорбируемых биологических протезов становится все более частым выбором хирургов при герниопластических операциях и укреплении мягких тканей дна малого таза [1]. Несмотря на высокую стоимость, биологические протезы на основе децеллюляризированных тканей животных (Пермакол) и человека (Alloderm) все чаще применяются, в особенности, в педиатрической практике, например, при диафрагмальных грыжах новорожденных, в связи с тем, что протез постепенно замещается собственными тканями и может «расти» вместе с тканями ребенка [2]. Полная резорбция протеза и замещение его собственными тканями должны устранить возможные причины большинства mesh-ассоциированных осложнений по принципу «нет протеза – нет осложнений» [3].
К сожалению, частота рецидивов при пластике биологическими протезами не отличается от операций с применением синтетических протезов [4], а в некоторых исследованиях даже превышает их [5]. Это может быть связано с тем, что скорость резорбции протеза превышает скорость замещения его собственными тканями, что приводит к непрочной краевой интеграции протеза [4]. Существует два основных подхода к решению данной проблемы. Первый – это использование более длительно резорбируемых синтетических материалов для производства протезов. Среди длительно резорбируемых полимеров для разработки хирургических протезов и скаффолдов для тканевой инженерии внимание исследователей привлекают поликапролактон [6], полидиоксанон [3], триметиленкарбонат [7, 8] и поли-4- гидроксибутират [9].
Второй подход заключается в добавлении к материалу протеза биологически активных веществ, которые обеспечивают ускорение замещения материала протеза собственными тканями. Экспериментально и клинически апробированы технологии импрегнации рекомбинантных факторов роста (например, FGF, BMP, VEGF и др.), релизинг которых стимулирует ангиогенез и регенерацию в области трансплантации [10, 11]. Перспективным способом, стимулирующим регенерацию, является добавление в структуру протеза мультипотентных стромальных клеток (МСК), которые являются клеточным субстратом для замещения области трансплантации соединительной тканью, за счет паракринных факторов стимулируют ангиогенез и регенерацию, а, кроме того, должны повышать биосовместимость протезов, подавляя реакцию на инородное тело [12]. В данной работе мы изучили влияние МСК на биосовместимость и функциональные свойства сетчатого протеза на основе полидиоксанона на экспериментальной модели полнослойного дефекта передней брюшной стенки у крыс.
Материалы и методы
Экспериментальные образцы сетчатых протезов
Образцы сетчатых протезов были изготовлены на основе монофиламентых полидиоксаноновых (PDO) нитей 3-0 (USP). Пористость сеток определяли методом низкотемпературной адсорбции азота с использованием анализатора удельной поверхности SA 3100 (Beckman Coulter) по стандартной методике. Микротвердость нитей измеряли на атомно-силовом микроскопе ICON (Bruker) до и после гидролитической деструкции в растворе Na2HPO4×2H2O (рН=7,32) в течение 30 суток.
Культура МСК
В качестве клеточного компонента тканеинженерной конструкции (ТИК) использовали МСК пупочного канатика крысы. Первичные культуры выделяли из интерваскулярной стромы пуповины методом эксплантатов. Принадлежность клеток к МСК подтверждали, оценивая их способность к клоногенному росту на поверхности необработанной культуральной подложки, экспрессию специфических поверхностных антигенов и возможность ответа на действие индукторов дифференцировки в адипогенном, остеогенном и хондрогенном направлениях [13].
Создание ТИК на основе сетчатого PDO-носителя и МСК пупочного канатика
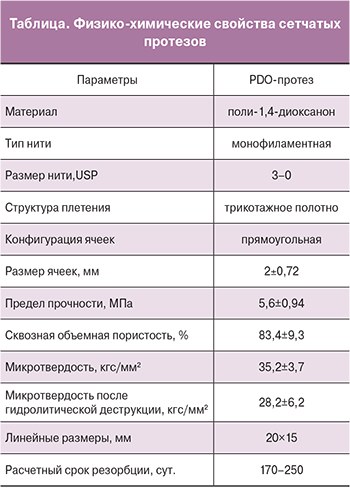
МСК пупочного канатика крысы метили витальным трейсером PKH26 Red Fluorescent Cell Linker Kit (Sigma-Aldrich), дважды отмывали 0,9% раствором хлорида натрия и ресуспендировали в культуральной среде до конечной концентрации 0,5×106 кл/мл. Сетчатый носитель переносили в пробирку-биореактор (SPL Lifesciences) и добавляли 5 мл клеточной суспензии. Заселение носителя проводили ротационным методом с помощью орбитального шейкера OS-20 (Biosan) (режим вращения платформы 75 об/мин) при стандартных культуральных условиях в течение 24 часов. Эффективность заселения носителя клетками оценивали с помощью флуоресцентной микроскопии.
 Сканирующая электронная микроскопия
Сканирующая электронная микроскопия
Образцы фиксировали 2,5% глутаровым альдегидом (Sigma-Aldrich), инкубировали в 1% растворе осмия (Sigma-Aldrich) и обезвоживали в восходящих спиртах. После высушивания на воздухе в течение 24 часов образцы покрывали слоем золота с помощью вакуумной напылительной установки (Eiko), приклеивали к столику электропроводящим серебряным клеем Dotite (Fujikura Kasei) и исследовали с помощью СЭМ S-500 (Hitachi).
Экспериментальная модель дефекта передней брюшной стенки
При постановке эксперимента руководствовались «Правилами проведения работ с использованием экспериментальных животных» в соответствии с приказами МЗ СССР № 755 и № 701 и «Правилами лабораторной практики в РФ». В исследовании использовали 120 половозрелых самцов беспородных крыс массой 250–320 г. Животных в случайном порядке разделяли на следующие группы: трансплантировали протез из PDO (n=24); трансплантировали протез из PDO, заселенный культурой МСК (n=24); и трансплантировали протез из Permacol (5001–100, Covidien) – контрольная группа (n=24).
Крыс наркотизировали золетилом (20 мг/кг) и рометаром (5 мг/кг). Разрез кожи длиной 4 см делали по срединной линии живота. Острым путем с помощью ножниц иссекали полнослойный (с проникновением в брюшную полость) дефект прямоугольной формы, длиной 2 см и шириной 1,5 см, ровно в середине передней брюшной стенки, ориентируясь на белую линию живота. Затем к краям дефекта подшивали протез, располагая ткани передней брюшной стенки над его краями. Рану ушивали и обрабатывали антисептиком. Послеоперационное обезболивание проводили однократно путем внутримышечного введения Баралгина М (10 мг/кг).
Животных выводили из эксперимента на 3, 10, 30, 60 и 180 сутки после операции путем передозировки эфирного наркоза. Изъятые ткани от каждого экспериментального животного разделяли на 3 части и помещали в 1) 10% забуференный раствор формалина для приготовления парафиновых срезов; 2) жидкий азот для приготовления криосрезов и проведения вестерн-блота; 3) 70° этиловый спирт для проведения биомеханических тестов.
Макроскопическое исследование области трансплантации
Проводили регулярный клинический осмотр операционных ран животных. При выявлении несостоятельности кожных швов, деформации брюшной стенки, эвентрации протеза или органов животное исключали из эксперимента. После эвтаназии и вскрытия брюшной полости тщательно изучали область трансплантации на предмет образования гематом, сером, абсцессов и спаек. Спаечный процесс оценивали по балльной системе [14].
Тензиометрическое исследование
Для тензиометрии использовали универсальную электромеханическую испытательную установку Scg-1kNa (Shimadzu). Образцы помещали в зажимы, устанавливая расстояние между браншами 10 мм. Испытание проводили при скорости 5мм/мин. Оценивали предел прочности образца.
Гистологическое исследование
После стандартной гистологической проводки материал заливали в парафин, готовили срезы толщиной̆ 5–7 мкм и окрашивали гематоксилином и эозином. Морфометрическое исследование проводили с помощью микроскопа Leica DM 2500 и программного обеспечения ImageScope M (Leica Biosystems) на микрофотографиях препаратов при увеличении ×400 не менее 100 полей зрения на точку наблюдения.
Иммуногистохимическое исследование
Криосрезы окрашивали с антителами к маркеру макрофагов CD68 (ab125212, Abcam), маркеру М2 активированных макрофагов CD206 (sc-34577, Santa Cruz Biotechnology), коллагену I и III типов (Имтек), гладкомышечному актину альфа (αSMA) (ab5694, Abcam), фактору фон Виллебранда — маркеру эндотелиальных клеток (vwF) (ab6994, Abcam), маркеру пролиферации клеточных популяций Ki-67 (ab15580, Abcam), маркеру скелетных мышц тропонину I (sc-15368, Santa Cruz Biotechnology) в соответствии с рекомендациями производителя. Морфометрическое исследование проводили с помощью микроскопа Leica DM 4000 B и программного обеспечения LAS AF v.3.1.0 build 8587 (Leica Microsystems) на микрофотографиях препаратов при увеличении ×400. Оценивали доли положительно окрашенных клеток в области трансплантации минимум на 100 полях зрения для каждой точки наблюдения.
Статистический анализ
Данные представляли в виде средних значений и стандартных ошибок среднего. Для множественных сравнений в случае нормального распределения данных использовали однофакторный дисперсионный анализ (one-way ANOVA), при отличном от нормального распределения данных использовали ранговый дисперсионный анализ (ANOVA on ranks). Различия считали достоверными при 5% уровне значимости. Данные были проанализированы с помощью программы Sigma Stat 3.5 (Systat Software).
Результаты и обсуждение
Экспериментальные образцы сетчатых протезов
Внешний вид экспериментальных образцов представлен на рисунке 1А. Характеристики образцов приведены в таблице. Отсутствие цитотоксичности полидиоксанона и сетчатых протезов на его основе было продемонстрировано нами в предыдущем исследовании [15]. При статическом заселении PKH26-меченные клетки равномерно адгезировали к поверхности материала протеза, обеспечивая конфлюэнтность 86±12,3% поверхности материала (рис. 1Б).
Макроскопическое исследование
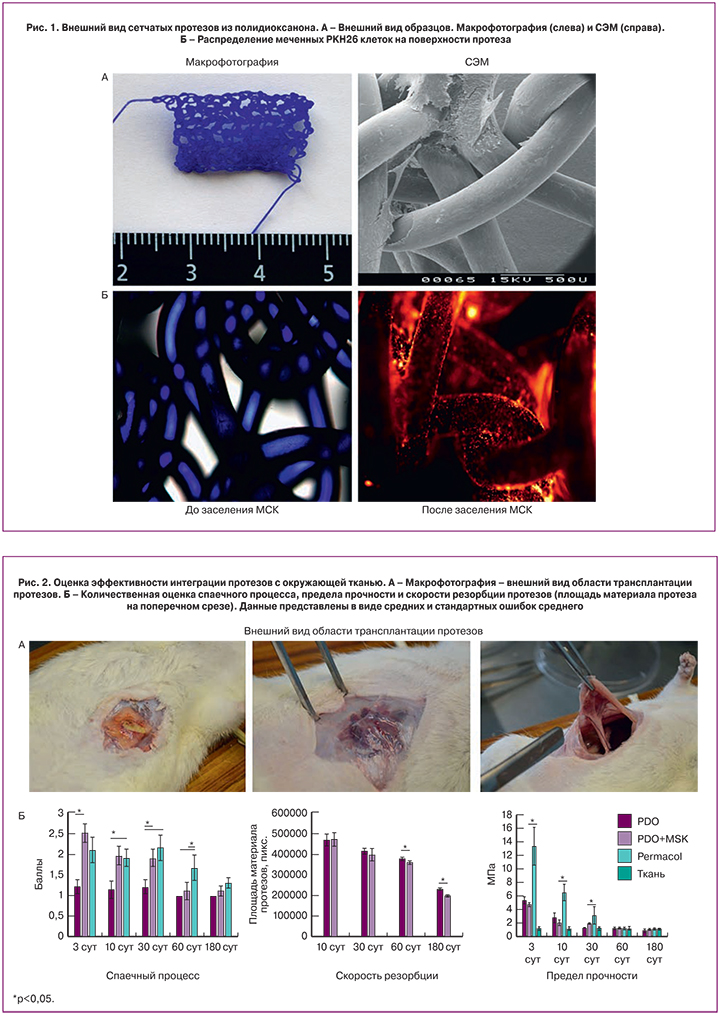
Все животные удовлетворительно переносили оперативное вмешательство, 100% животных выжило в ранние и отдаленные сроки после операции. Ни у одного животного не было выявлено признаков формирования сером и абсцессов. На ранних сроках в области трансплантации, даже при макроскопическом исследовании можно было видеть прорастание новообразованных кровеносных сосудов, иногда гематом. В группах PDO и PDO-МСК наблюдали прорастание ячеек сеток собственной соединительной тканью (рис. 2А). Такую же интеграцию наблюдали в группе с Permacol, но только на 30 сутки, на более ранних сроках протез интегрировался с окружающими тканями только в области швов (рис. 2А).
Образование спаек разной степени выраженности наблюдали во всех группах и на всех сроках наблюдения (рис. 2А,Б). У ряда животных в спаечный процесс вовлекались не только большой сальник, но и петли тонкого и толстого кишечника. Достоверно более выраженный спаечный процесс наблюдали при трансплантации PDO+МСК, но только до 30 суток, в дальнейшем на 60 сутки в группах с сетчатыми протезами спаек было меньше, чем в группе Permacol, а на 180 сутки различий между группами выявлено не было (рис. 2Б). В группе Permacol спаек было больше, но следует отметить, что площадь контакта материала с тканями брюшной полости в этом случае была существенно выше, так как Permacol представляет собой пластину с перфорациями. В группе PDO+МСК высокая выраженность спаечного процесса обусловлена заселенными клетками, которые способствовали адгезии тканей к трансплантату. В связи с этим, целесообразно размещать разработанный протез не интраперитонеально, а между мышечными и фасциальными листками (sublay).
Определение биомеханических свойств протезов после трансплантации
Для исследования биомеханических свойств нативных тканей мы провели тензиометрическое исследование полнослойно вырезанного участка передней брюшной стенки крысы. Предел прочности при растяжении передней брюшной стенки крысы равнялся 1,24±0,26 МПа. Предел прочности при растяжении тканей области трансплантации значительно менялся по мере резорбции материала протеза (рис. 2Б). Максимальный предел прочности отмечали при трансплантации Permacol на 3 и 10 сутки. На 30 сутки этот показатель сравнивался во всех группах и не отличался от нативных тканей. Через 60 и 180 суток после трансплантации этот показатель не менялся во всех группах. То есть можно утверждать, что баланс между скоростью резорбции материала протеза и скорости его замещения собственной соединительной тканью обеспечивал биомеханические свойства тканей области трансплантации, сравнимые с нативными тканями. Однако, в ряде клинических случаев, например, при тяжелых формах дисплазии соединительной ткани, когда биомеханические свойства собственной соединительной ткани способствуют формированию грыж, все же более эффективно и безопасно применять нерезорбируемые протезы с повышенной прочностью.
Скорость резорбции протеза
Скорость резорбции протеза оценивали по динамике изменения площади структурных элементов протеза. В группах трансплантации протезов на основе PDO измеряли площадь поперечно срезанной толстой мононити. Оба варианта протеза равномерно подвергались резорбции и к 180 суткам уменьшались на 52,3±8,1% и 58,1±9,7%, различия не были достоверны (рис. 2Б). Таким образом, можно утверждать, что добавление в состав протеза культуры МСК не ускоряет и не замедляет резорбцию материала протеза.
Исследование скорости замещения протеза собственными тканями
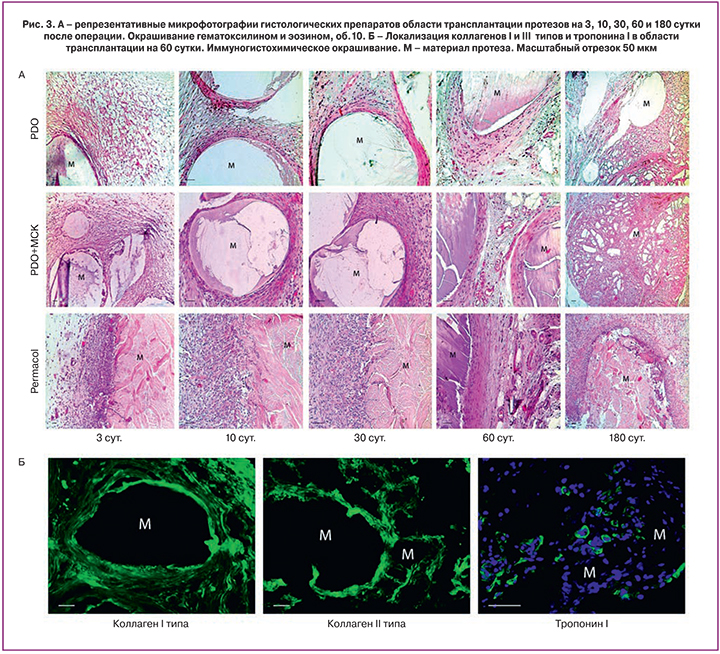
На всех сроках область трансплантации была представлена рыхлой волокнистой соединительной тканью разной степени зрелости с последующим замещением на плотную неоформленную соединительную ткань (рис. 3А). Существенных качественных различий по клеточному составу и структуре экстрацеллюлярного матрикса в разных исследуемых группах выявлено не было. Вокруг материала протезов формировалась соединительнотканная капсула. Выраженной воспалительной инфильтрации не наблюдали, но при этом инфильтрат сохранялся преимущественно в зоне контакта с материалом протеза и был представлен преимущественно макрофагами и единичными гигантскими клетками инородных тел и клетками Пирогова-Лангханса (рис. 4Г). Обращала на себя внимание более выраженная инфильтрация воспалительными клетками, прежде всего нейтрофилами, в группе Permacol, которая сохранялась в течение всех сроков наблюдения. На 180 сутки после трансплантации наблюдали остаточные фрагменты материалов протеза, окруженные плотной неоформленной соединительной тканью, которая полноценно, без какой-либо границы переходила в окружающие трансплантат ткани. Признаков гранулематозного воспаления на этих сроках выявлено не было. На поздних сроках наблюдения среди новообразованной соединительной ткани можно было выявить клетки положительно окрашивающиеся антителами к тропонину I (маркер скелетных мышц) (рис. 3Б). При этом такие скопления образовывались не в краевой зоне трансплантата, а в толще его, т.е. de novo, возможно, за счет мигрирующих миосателлитных клеток.
Косвенным показателем скорости замещения собственными тканями можно считать скорость образования и ремоделирования коллагеновых волокон, как основных структурных элементов экстрацеллюлярного матрикса, которые определяют биомеханические прочностные характеристики новообразованной ткани. Ремоделирование и созревание волокнистого матрикса можно оценивать как соотношение коллагенов I и III типов: чем больше коллагена I типа, формирующего более толстые и плотные пучки коллагеновых волокон, тем более зрелым является экстрацеллюлярный матрикс. Синтез коллагена I типа отмечался уже на 3 сутки, а на 10 четко определялся в составе фиброзной капсулы и окружающей соединительной ткани (рис. 3Б). Толщина коллагеновых волокон и их пучков по мере созревания соединительной ткани увеличивалась.
Судьба трансплантированных МСК в составе протеза
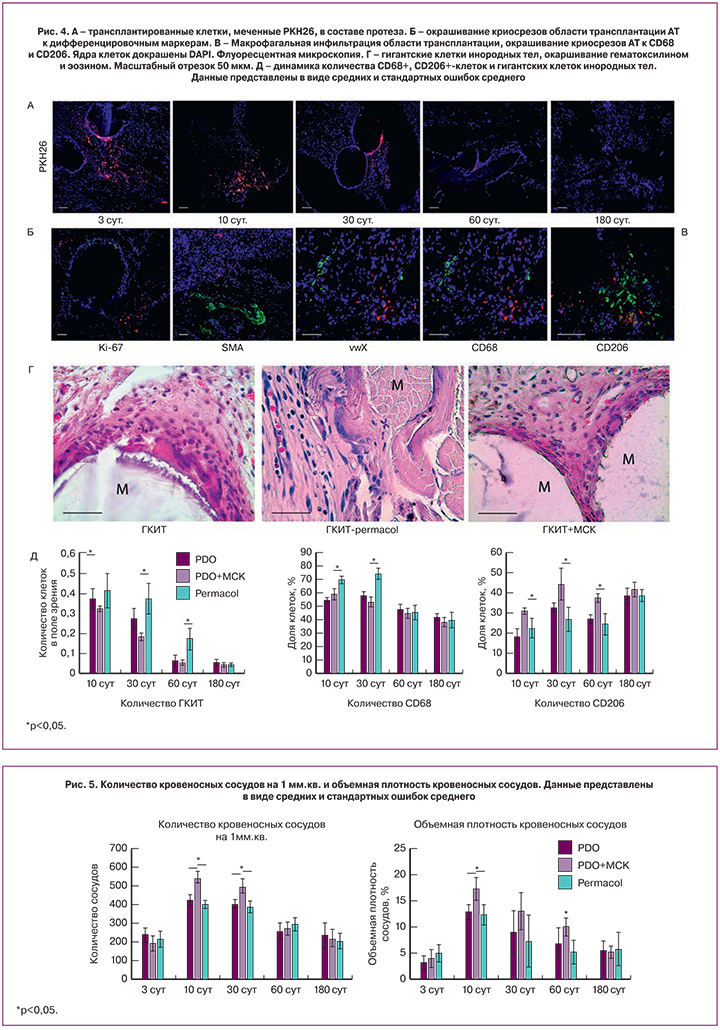
Для исследования выживаемости, локализации и направления дифференцировки трансплантированных клеток перед введением, культуру МСК метили мембранным флуоресцентным красителем PKH26. Трансплантированные клетки выявляли на всех сроках наблюдения, но количество их заметно уменьшалось в динамике, и на 180 сутки можно было выявить только единичные клетки (рис. 4А). При этом клетки всегда располагались вблизи поверхности материала протеза, имели фибробластоподобную морфологию и не выглядели поврежденными. Кроме того, о жизнеспособности свидетельствовала их миграция на незначительное расстояние от поверхности протеза. Уменьшение количества меченых клеток связано с несколькими причинами: их гибелью и элиминацией клетками хозяина и выцветанием метки.
Для оценки направления дифференцировки трансплантированных клеток гистологические препараты (криосрезы) окрашивали антителами к фактору фон Виллебранда (vwF, маркер эндотелиальных клеток), к гладкомышечному актину (αSMA, маркер гладких миоцитов и миофибробластов) (рис. 4Б). Трансплантированные меченые клетки не дифференцировались в клетки кровеносных сосудов – ни в эндотелий интимы, ни в гладкие миоциты средней стенки. Вероятно, трансплантированные клетки дифференцировались в фибробласты и синтезировали компоненты межклеточного вещества. Однако ни на одном из сроков не было выявлено пролиферирующих меченых клеток, положительно окрашенных Ki67 (рис. 4Б).
Для оценки элиминации трансплантированных аллогенных клеток собственными макрофагами криосрезы с мечеными клетками были окрашены антителами к CD68. На всех сроках наблюдения были выявлены РКН26+ клетки, которые локализовались преимущественно в капсуле вокруг материала протеза. При этом часть меченых клеток, имеющих такую же локализацию, положительно окрашивались АТ к маркеру макрофагов CD68 (рис. 4В), при этом их доля увеличивалась на более поздних сроках. Это свидетельствует об активной элиминации живых трансплантированных клеток или о фагоцитозе мембранных структур погибших меченых клеток. Количество CD68+ меченых клеток увеличивалось в динамике и к 60 и 180 суткам составляло почти 100%. Тотальная элиминация трансплантированных аллогенных клеток согласуется с данными, полученными нами в других экспериментальных моделях [16]. По современным представлениям терапевтические (противовоспалительный, ангиогенный, репаративный и др.) эффекты МСК реализуются за счет паракринного механизма. В нашем эксперименте трансплантированные клетки не дифференцировались в клетки кровеносных сосудов, в лучшем случае в фибробласты, и активно элиминировались макрофагальной системой реципиента, по-видимому, все выявленные терапевтические эффекты были обусловлены паракринными факторами.
Реакция на инородное тело
Для характеристики выраженности реакции на инородное тело мы подсчитали количество макрофагов общей популяции (CD68+) и М2-макрофагов (CD206+). Последние являются прорегенераторными, противовоспалительным макрофагами, которые активируются в продуктивную фазу воспаления и регулируют синтез экстрацеллюлярного матрикса и ангиогенез [17]. Количество CD68+ клеток снижалось, начиная с 60 суток наблюдения, и не отличалось между группами. На ранних сроках (10 и 30 суток) макрофагов (общей популяции) было значимо больше после трансплантации Permacol.
М2-макрофаги (CD206+клетки) локализовались также преимущественно в капсуле вокруг материала протеза, количество их было заметно меньше, чем CD68+ клеток, но на 180 сутки их количество в окружающей протез соединительной ткани возрастало во всех группах (рис. 4В). В группах PDO и Permacol их количество было достоверно меньшим уже на 10 сутки, что свидетельствует о поляризации макрофагов в М2 направлении при трансплантации МСК в составе протеза и переключении альтеративной стадии воспаления в продуктивную (Рис. 4Д).
Таким образом, можно утверждать, что независимо от природы материала протеза, его трансплантация вызывает выраженную макрофагальную инфильтрацию, которая сохраняется длительное время, вплоть до 180 суток. Это свидетельствует о продолжающемся хроническом воспалении в ответ на введение инородного тела. Однако степень выраженности и характер такого воспаления отличались между группами, что позволяет выбрать протез с минимальными провоспалительными свойствами. Использование МСК, как клеточного компонента комбинированного протеза является целесообразным, так как приводит к поляризации макрофагов в противовоспалительные, проангиогенные и прорегенераторные клетки, что приводит к уменьшению воспаления и ускорению регенерации.
Другим характерным морфологическим признаком реакции на инородное тело является гранулематозное воспаление или образование гранулем инородного тела. В случае имплантации больших по размеру (относительно размера клеток) инородных тел и при их неопределенных антигенных свойствах (отсутствие специфических рецепторов на поверхности иммунокомпетентных клеток) происходит активация клеток врожденного иммунитета, прежде всего, макрофагов. Последние активно мигрируют к инородному телу, пролиферируют и сливаются в гигантские клетки инородных тел (многоядерный симпласт с центральным расположением ядер) или клетки Пирогова-Лангханса (с периферическим расположением ядер). Эти клетки, наряду с мононуклеарными лейкоцитами могут аккумулироваться вокруг инородного тела с формированием неиммунных (неспецифических) грануле. В последующем такие гранулемы инкапсулируются и замещаются фиброзной тканью, но в случае сохранения материала инородного тела (нерезорбируемые протезы), такие гранулемы могут сохраняться в течение всей жизни реципиента как очаг хронического воспаления.
В нашем эксперименте клетки гранулематозного воспаления (как гигантские клетки инородных тел, так и клетки Пирогова-Лангханса) обнаруживали во всех группах (Рис. 4Г). При этом клетки не образовывали гранулемы, а располагались диффузно, преимущественно в составе формирующейся фиброзной капсулы, но также их можно было обнаружить и на некотором расстоянии от материала протеза. Количество таких клеток отличалось между группами (рис. 4Д). Гранулематозное воспаление в области трансплантации было более выраженным в группе Permacol на 30 и 60 сутки. На 30 сутки количество многоядерных макрофагов достоверно меньше было в группе PDO+МСК.
Ангиогенез области имплантации протеза
Количество кровеносных сосудов и их объемная плотность была выше в группе PDO+МСК на 10 и 30 сутки после трансплантации (рис. 5). Можно утверждать, что вариант хирургического протеза, который включает в себя культуру МСК, обеспечивает более интенсивное образование кровеносных сосудов в области трансплантации, что должно обеспечивать более интенсивное замещение собственными тканями и ремоделирование экстрацеллюлярного матрикса. По-видимому, проангиогенный эффект аллогеных МСК реализуется за счет паракринных механизмов – продукцией ангиогенных факторов и поляризации М2-макрофагов.
Заключение
Целью проведенного экспериментального исследования являлось изучение безопасности и эффективности трансплантации разработанного комбинированного протеза при сравнении с использованием только сетчатой конструкции из PDO и с уже зарегистрированным и широко применяемым натуральным полностью резорбируемым хирургическим протезом Permacol. Благодаря добавлению в состав протеза культуры МСК удалось существенно снизить степень выраженности воспалительной реакции отторжения инородного тела, стимулировать ангиогенез и скорость замещения собственными тканями реципиента.



