Плодные оболочки обладают избирательной проницаемостью для различных молекул, участвуют в обмене околоплодной жидкости и имеют сложное гистологическое строение. Амниотический эпителий контактирует с околоплодными водами. Компактный слой состоит из соединительнотканных элементов и является наиболее прочным. Глубже расположен слой цитотрофобласта (называемый гладким хорионом, в противовес хориону ворсин плаценты), далее лежит слой децидуальных клеток, контактирующих с полостью матки [1, 2].
Термин «преждевременные роды» (ПР) используют для обозначения родов, наступающих при сроке беременности от 22 до 37 недель и массе плода более 500 г [3]. ПР – это полиэтиологическая группа. Наиболее изученной причиной ПР является преждевременный разрыв плодных оболочек, связанный с их воспалительными изменениями (мембранитами), которые в большинстве случаев ассоциированы с микробными агентами [1–4, 5]. Считается, что каждый третий недоношенный ребенок рождается у матерей с внутриамниотической инфекцией, однако патогенез ПР в отсутствие острой восходящей амниотической инфекции не до конца изучен. Кроме того, не выявлена четкая зависимость между степенью воспалительной инфильтрации плодных оболочек и наступлением ПР [6–8].
Цель исследования – изучить структурные изменения плодных оболочек при ПР в отсутствии их воспалительных изменений.
Материалы и методы
Проанализированы плодные оболочки последов от 25 женщин. В основную группу вошли 14 женщин, родоразрешенных через естественные родовые пути в связи со спонтанным началом родовой деятельности на сроке беременности 28–36 недель. Группы сравнения: 7 женщин с неосложненным течением доношенной беременности (нормальная беременность – НБ), а также 4 пациентки, родоразрешенные путем экстренного кесарева сечения (КС) в сроки 27–32 недели (ранний контроль – РК) в связи с гипоксией плода, преждевременной отслойкой нормально расположенной плаценты, нарушениями функционального состояния плода.
Критериями исключения из исследования явились признаки воспалительных изменений плодных оболочек (по данным гистологического исследования – обнаружение нейтрофилов, плазмоцитов, наличие лимфо-макрофагальной инфильтрации плодных оболочек) [1, 9].
При макроскопическом исследовании плодные оболочки захватывали корнцангом со стороны места разрыва (отступ 3 см) и скручивали в виде ролла, через который затем производился срез острым ножом или скальпелем, толщиной 0,3–0,4 см [2]. Вырезанные фрагменты ткани фиксировали в 10% нейтральном формалине. На серийных парафиновых срезах толщиной 4 мкм проводили гистологическое (окраска гематоксилином и эозином) и иммуногистохимическое исследования с использованием первичных моноклональных антител к маркеру мезенхимных клеток виментину (клон SP20, готовый к использованию; Spring bioscience), к маркеру ангиогенеза CD34 (клон QBenD, готовый к использованию; Spring bioscience), к маркеру макрофагов CD68 (клон SP251, готовый к использованию; Spring bioscience), а также к рецептору врожденного иммунитета NOD-1 (nucleotide-binding oligomerization domain-containing protein-1) (1:100, Invitrogen). Иммуногистохимическое исследование выполняли посредством иммуностейнера закрытого типа Ventana (Roche, UK) с закрытым набором для детекции. Протокол автоматизированного окрашивания образцов включал все этапы стандартной процедуры иммуногистохимии: депарафинацию срезов, их демаскировку, блокирование эндогенной пероксидазы, инкубацию с первичными и вторичными антителами. Система визуализации – Ultra View Universal DAB, Detection Kit. Продукты реакции выявляли в виде коричневого окрашивания мембраны и цитоплазмы клеток. Для проведения отрицательного контроля образцы исследуемых срезов подвергали стандартной иммуногистохимической процедуре без инкубации с первичными антителами. Положительный контроль для каждого антитела выбирали в соответствии со спецификациями фирмы-производителя.
Результаты
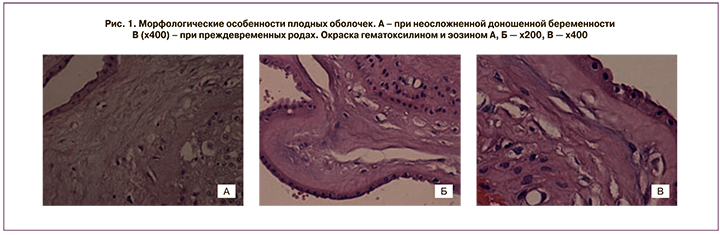
При гистологическом исследовании образцов плодных оболочек группы ПР и группы доношенной беременности отмечался отек, проявлявшийся в виде участков разрежения, преимущественно компактного слоя, а также визуализировались отдельные макрофаги (рис. 1, А–В). При ПР в плодных оболочках отмечались наиболее выраженные морфологические изменения: компактный слой был с участками сетчатого или ячеистого вида за счет множественных тесно расположенных капилляроподобных структур или «стромальных каналов» (по аналогии с ворсинчатым деревом плаценты), нередко с множественными микро- и макроразрывами от 1 мм до нескольких десятков миллиметров. Часто наблюдались десквамация амниотического эпителия и расслоение плодных оболочек. Кроме того, присутствовали дистрофические изменения, а также очаги некрозов компактного слоя и децидуальной пластинки. При исследовании образцов группы РК отек был незначителен, макрофаги единичными или отсутствовали.
В результате иммуногистохимического исследования в компактном слое плодных оболочек группы РК выявлены виментин + мезенхимные клетки, преимущественно веретеновидной формы, контактирующие друг с другом длинными отростками, тем самым образуя непрерывную цепочку; некоторые клетки были слабо CD34+. Капилляры децидуальной пластинки или компактного слоя единичны или отсутствовали. Наряду с этим, в группе НБ и ПР обнаружены капилляроподобные структуры, состовшие из звездчатых фибробластоподобных клеток с длинными тонкими отростками, как бы ограничивающие пространство формирующегося сосуда (рис. 2, А, Б) [2], в центре которого присутствовал CD68+ макрофаг (рис. 2, В, Г). По строению данные структуры сходны с так называемыми стромальными каналами, являющимися проявлением раннего ангиогенеза ворсинчатого дерева плаценты [2]. По аналогии с ворсинами плаценты, мезенхимные клетк, образующие «стромальные каналы» плодных оболочек, были интенсивно окрашены виментином и слабо CD34+. Эндотелий кровеносных сосудов и капилляров децидуальной пластинки был выраженно CD34+ (рис. 3, А–Е).
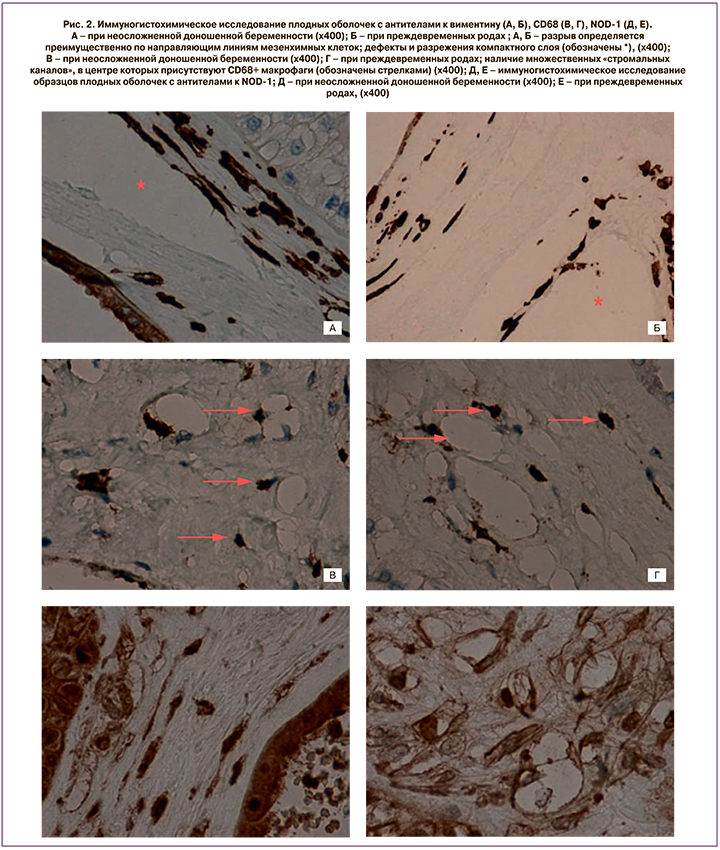
Наряду с этим, количество кровеносных сосудов в децидуальной пластинке было увеличено, что также ослабляло механическую прочность плодных оболочек. Максимальное количество сосудов присутствовало в децидуальной пластинке при ПР (более 5 в поле зрения (×200)). В некоторых наблюдениях группы ПР количество сосудов было значительно увеличено, по сравнению с группой РК и НБ, вплоть до развития кистозной трансформации децидуальной пластинки [2]. При доношенной беременности количество сосудов составляло 4–5 в поле зрения (×200), что было сопоставимо с группой ПР (р>0,05). В группе РК они были единичными и меньшего диаметра (р<0,05).
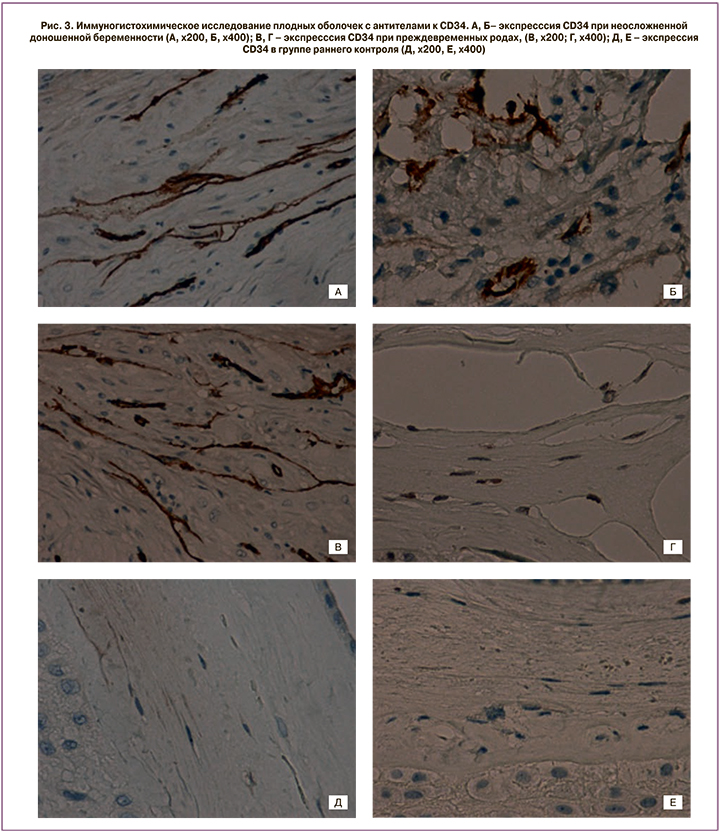
Необходимо подчеркнуть, что при ПР и к концу доношенной беременности микроразрывы в компактном слое плодных оболочек образовывались не за счет отека или некрозов, как часто принято считать [1], а преимущественно вдоль капилляроподобных структур и «стромальных каналов» (рис. 2, А, Б, рис. 3, А, Б) [1, 2]. Важно отметить, что при гистологическом исследовании вышеописанные капилляроподобные структуры, или «стромальные каналы», при окрашивании гематоксилином и эозином маскируются как проявления отека или как артифициальные изменения, которые нередко связывают с нарушением технологии фиксации материала или техническими сложностями в работе микротома при изготовлении гистологических срезов (рис. 1). Кроме того, при окрашивании антителами к рецептору врожденного иммунитета NOD-1 определялось коричневое окрашивание как макрофагов, так и клеток стромы (рис. 2, Д, Е), что четко показывало, что макрофаги находились внутри просвета так называемых «стромальных каналов». В то же время при окрашивании с антителами к CD68 выявлялись только макрофаги, клетки стромы были преимущественно негативны [10]. Проведенный анализ микропрепаратов, окрашенных с антителами к NOD-1, позволил визуализировать мезенхимальные клетки и их отростки, образующие «стромальные каналы», а также макрофаги, находящиеся в их просвете. Указанные изменения, по нашему мнению, сходны с аналогичными изменениями ворсинчатого дерева плаценты и являются проявлениями раннего ангиогенеза [1, 11]
Обсуждение
Согласно данным литературы, одной из наиболее изученных причин развития ПР являются воспалительные изменения плодных оболочек [1]. Однако только в 50% наблюдений имеют место гистологические признаки амнионита и хориоамнионита [12]. В то же время на недоношенном сроке беременности при преждевременном разрыве плодных оболочек роды могут наступить и в отсутствие воспалительной реакции в плаценте и в плодных оболочках, например, у пациенток с недифференцированной дисплазией соединительной ткани, когда нарушается синтез коллагена, снижается «прочность» плодного пузыря, что и обусловливает его разрыв [6, 8, 13–16]. Полученные нами данные свидетельствуют о том, что на доношенном сроке беременности происходит повышение васкуляризации плодных оболочек, приводящее к разрыву плодного пузыря и к началу родов. Развитие этих изменений на более ранних сроках беременности может являться причиной ПР. Вероятно, по аналогии с тем, как бумага или почтовая марка легко отрывается при наличии мелких микроперфораций, так и плодные оболочки стремятся к разрыву за счет усиления ангиогенеза и появления «стромальных каналов», являющихся как бы направляющими «лесами» или канвой, по которым осуществляется разрыв.
Полученные результаты имеют важное значение в понимании патогенеза ПР. Так, в настоящее время одним из способов прогнозирования ПР является тест на определение плацентарного альфамикроглобулина. Концентрация этого белка в околоплодных водах высокая, однако во влагалищном содержимом он не определяется. Появление лабораторно определяемых уровней данного белка во влагалищном содержимом при отсутствии клинических проявлений разрыва плодных оболочек свидетельствует о поступлении микропорций околоплодных вод через микроперфорационные отверстия (микроразрывы) оболочек и о возможном преждевременном разрыве плодных оболочек и/или ПР в ближайшее время [17].
Заключение
Таким образом, результаты исследования указывают, что ПР обусловлены сочетанием определенных факторов, приводящих к снижению механической прочности плодных оболочек, в том числе повышением ангиогенеза компактного слоя и децидуальной пластинки, а также множественными микродефектами и разрывами.



