Одной из значимых причин неудач имплантации в программе экстракорпорального оплодотворения (ЭКО) при переносе морфологически качественных эмбрионов является нарушение рецептивности эндометрия [1]. В результате повреждающего действия инфекционного, дисгормонального, а также сочетанных первичных этиологических факторов в эндометрии формируются патологические изменения, сопровождающиеся нарушением его рецепторного аппарата [2]. В то же время отсутствие органической патологии эндометрия не исключает его функциональную неполноценность, которая в ряде случаев является причиной бесплодия неясного генеза, повторных неудач имплантации (ПНИ), самопроизвольных выкидышей [3, 4].
По готовности принять внедряющуюся бластоцисту выделяют три качественных состояния эндометрия, таких как нейтральная, рецептивная и рефрактерная, или нерецептивная фазы. В период «окна имплантации» для восприятия эмбриона эндометрий имеет характерное морфологическое и функциональное (рецептивное) состояние, инициированное стероидными гормонами, которые, в свою очередь, регулируют экспрессию локально действующих цитокинов, хемокинов, факторов роста и транскрипции [5].
Учитывая ключевое значение морфофункционального состояния эндометрия для успешной имплантации эмбриона, перед проведением программы ЭКО необходима комплексная оценка состояния эндометрия для определения патогенетического лечения и тактики предгравидарной подготовки.
В течение многих десятилетий «золотым стандартом» для определения нарушений секреторной трансформации эндометрия являлись критерии временных гистологических изменений, происходящих в его функциональном слое на протяжении 28-дневного менструального цикла [6]. По критериям R.W. Noyes эндометрий характеризуется как «вне фазы» при несоответствии дню менструального цикла более чем на два дня. Однако в настоящее время значения гистологической структуры эндометрия в установлении причин неудач имплантации недостаточно, оно должно дополняться другими методами исследования [7]. Благодаря достижениям в области молекулярной биологии для поиска оптимальных критериев готовности эндометрия к имплантации на сегодняшний день используются новые высокоинформативные методы молекулярной диагностики.
На данном этапе развития фундаментальной медицины интерес исследователей сконцентрирован на изучении широкого спектра молекулярных факторов, формирующих рецептивность эндометрия [1, 3, 8, 9]. Важная роль отводится семейству молекул клеточной адгезии, цитокинам семейства интерлейкина-6 (IL-6), генам гомеобокса, фактору роста сосудистого эндотелия (VEGF-А), матриксным металлопротеиназам (MMPs) и др. Однако значение ряда потенциальных молекулярно-биологических маркеров в процессе имплантации у женщин изучено мало ввиду морально-этических и технических причин, а большинство исследований в этом направлении выполнены на грызунах и других видах животных [10]. Кроме того, имеющиеся работы до сих пор не нашли клинической интерпретации и ни один из исследованных генов рецептивности не используется в рутинной практике при обследовании и лечении пациенток в программе ЭКО/ИКСИ [8].
Неудачи имплантации по-прежнему остаются приоритетной задачей для ученых в области репродуктивной медицины, решение которой позволит повысить эффективность программы ЭКО, что обосновывает проведение дальнейших исследований в этом направлении.
Целью настоящего исследования стало изучение профиля экспрессии мРНК генов, участвующих в процессах имплантации, в эндометрии пациенток в цикле, предшествующем проведению программы ЭКО.
Материал и методы исследования
Для достижения поставленной цели на базе ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России было проведено когортное проспективное исследование, в которое была включена 121 женщина репродуктивного возраста с трубно-перитонеальным фактором бесплодия, проходившая лечение методом ЭКО в отделении вспомогательных технологий в лечении бесплодия.
Критериями включения в исследование были: возраст от 18 до 42 лет, регулярный менструальный цикл, трубно-перитонеальный фактор бесплодия, сохраненный овариальный резерв (по данным гормонального исследования и ультразвукового исследования органов малого таза (УЗИ), отсутствие патологии эндометрия по данным УЗИ, фертильная или субфертильная сперма супругов. Критериями исключения были: бесплодие, обусловленное иммунологическим фактором (наличие антиспермальных антител), миома матки любых размеров, острые воспалительные заболевания органов малого таза, олигоастенотератозооспермия III и IV степени (по нормативам ВОЗ, 2010 г.),
пороки развития внутренних половых органов, cоматические и психические заболевания, являющиеся противопоказанием для вынашивания беременности и родов. У всех обследованных женщин получено информирование согласие на участие в исследовании.
Всем пациенткам в цикле, предшествующем стимуляции функции яичников, произведена пайпель-биопсия эндометрия с помощью аспирационной кюретки Pipelle de Cornier (Laboratorie C.C.D., Франция). Биопсию эндометрия проводили в амбулаторных условиях в день менструального цикла ЛГ+7, который определяли с помощью мочевого теста Clear Blue (Unipath Ltd, Великобритания), основанного на определении увеличения уровня ЛГ в моче. Проводили стандартное морфологическое исследование полученного соскоба.

Для молекулярно-генетического исследования биоптат помещали в пробирки со средой для стабилизации РНК (лизирующий раствор из системы для выделения нуклеиновых кислот «ПРОБА-НК», «ДНК-Технология», Россия). Была проанализирована экспрессия мРНК 36 генов, включающих цитокины (IL-1b, IL-12A, IL-2, IL-6, IL-8, IL-10, IL-15, IL-18, LIF, LIFR, OsM, TNF-α, TGF-β), ростовые факторы (HB-EGF, IGFBP1, IGFBP2, IGFBP4, AREG, IGF2, VEGF-A (общий и изоформа 189)), матриксные металлопротеиназы (MMP-2, MMP-8, MMP-9, MMP-7, MMP-11), иммунные маркеры (CD45, CD56, CD68), маркеры апоптоза (BAX, BCL2), онкомаркеры (Cox-2, PTEN), рецептор эстрогена ESR1 и прогестерона PGR, гомеобокс-содержащие гены (MSX-1/HOX-7, HOXA-10, HOXA-11).
Оценку уровня экспрессии мРНК проводили с помощью количественной полимеразной цепной реакции с предварительной стадией обратной транскрипции (ОТ-ПЦР) в режиме реального времени коммерческими тест-системами («ДНК-Технология», Россия), согласно инструкции. Реакция амплификации проводилась с помощью детектирующего амплификата ДТ-96 («ДНК-Технология», Россия). Нормировка уровня экспрессии генов выполнена с использованием метода сравнения индикаторных циклов (метод ∆Cq) по четырем референсным генам HPRT1, TBP, B2M, GUSB. В качестве меры центральной тенденции количественных признаков выбрана медиана (Me), а в качестве интервальной оценки – верхний (0,75) и нижний квартили (0,25). Результаты представлены в виде Ме (0,25–0,75). Для оценки значимости межгрупповых различий применялся U-критерий Манна–Уитни для несвязанных совокупностей.
Стимуляция функции яичников проводилась препаратами рекомбинантного фолликулостимулирующего гормона в сочетании с антагонистами гонадотропин-рилизинг гормона. Всем женщинам был произведен перенос эмбрионов хорошего качества, которое оценивалось согласно морфологическим критериям по классификации Гарднера. Успех имплантации оценивали по наступлению биохимической беременности. Биохимическая беременность диагностировалась при уровне β-субъединицы хорионического гонадотропина более 20 МЕ/л (HCG STAT, Cobas) через 14 дней после переноса эмбриона в полость матки.
Для диагностики клинической беременности через 21 день после переноса эмбрионов проводилось УЗИ с целью оценки наличия одного или двух плодных яиц в полости матки, после чего через 10 дней оценивали наличие эмбриона с определяемым сердцебиением.
Результаты исследования
Возраст обследованных женщин составлял от 24 до 42 лет (в среднем составил 33,1±3,9 года), продолжительность бесплодия – 1 – 20 лет (в среднем 5,6±3,6 года). Первичное бесплодие выявлено у 54 женщин (44,6%), вторичное – у 67 пациенток (55,4%). Всем женщинам ранее было произведено от 1 до 7 попыток ЭКО (в среднем 2,0±1,1). Все пациентки имели регулярный менструальный цикл и сохраненный овариальный резерв по данным гормонального и ультразвукового исследования.
На основании результатов морфологического исследования были выделены две группы:
I группа – женщины, с диагностированной ранней стадией секреции (n=55) и II группа – средней стадией секреции (n=62). У 4 женщин выявлена поздняя стадия фазы пролиферации, и они были исключены из дальнейшего анализа в связи с малочисленностью группы.
Средний возраст женщин в I группе составил 32,6±3,7, во II группе – 33,6±4,0. Первичное бесплодие было выявлено у 25 женщин (45,5%) в I группе и у 25 (40,3%) во II группе, вторичное – у 30 (54,5%) I и у 37 (59,7%) II группы. Длительность бесплодия достоверно не различалось между исследуемыми группами и была в I группе 5,9±3,7 года, во II – 5,3±3,6 года; среднее количество неудачных циклов ЭКО также достоверно не различалось и составило 2,2±1,1 и 2,0±1,2 соответственно. Частота имплантации в группах статистически значимо не различалась и составила 42 и 45% соответственно.
При анализе профиля экспрессии генов установлена статистически значимая разница в зависимости от стадии фазы секреции по 21 из 36 изученных генов (табл. 1), в связи с чем дальнейший анализ проводили раздельно по фазам.
В зависимости от успеха имплантации в цикле ЭКО были сформированы две подгруппы: подгруппа А – пациентки с биохимической беременностью (n=51) и подгруппа В – пациентки с отрицательным результатом ЭКО (n=66). Раздельно анализировали пациенток, у которых в предшествующем менструальном цикле была диагностирована ранняя (I группа) и средняя фазы секреции (II группа) по результатам морфологического исследования.
Примечательно, что несмотря на отсутствие статистически значимых различий в частоте имплантации наблюдалась статистически значимая разница в вероятности реализации биохимической беременности в клиническую между пациентками I и II групп (96 и 79% соответственно, р=0,0048).
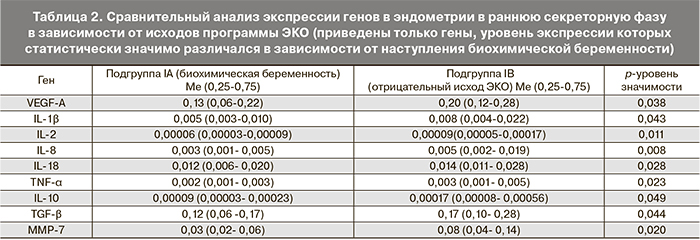
У пациенток, у которых в цикле ЭКО наступила биохимическая беременность, в раннюю стадию фазы секреции выявлены достоверные различия в экспрессии генов, кодирующих матриксную металлопротеиназу-7 (MMP-7), VEGF-A, цитокины (IL-1b, IL-2, IL-8, IL-10, IL-18, фактор некроза опухоли-α (TNF-α), трансформирующий фактор роста-β (TGF-β) по сравнению с женщинами с отрицательным исходом программы ЭКО (табл. 2). Благоприятным прогностическим критерием было снижение уровня экспрессии следующих генов: MMP-7 в 2,6 раз, VEGF-А в 1,5 раза, IL-1B в 1,6 раза, IL-2 в 1,5 раза, IL-8 в 1,6 раза, IL-10 в 1,8 раза, IL-18 в 1,1 раза, TNF-α в 1,5 раза, TGF-β в 1,4 раза.
С целью прогнозирования наступления беременности был выполнен регрессионный анализ методом бинарной логистической регрессии.
Вероятность (Р) имплантации рассчитывалась по формуле:
Р=1/(1+е-F) (1),
где F – классифицирующая функция, рассчитываемая по формуле 2:
F=-3,714*[MMP-11] -1,728*[VEGF-A]-2,306*[IL-15]+0,338 (2),
где F – классифицирующая функция; [MMP-11] – уровень экспрессии гена MMP-11; [VEGF-A] – уровень экспрессии гена VEGF-A; [IL-15] – уровень экспрессии гена IL-15.
Для оценки диагностической возможности предложенной модели был выполнен ROC-анализ. Площадь под ROC-кривой составила 0,64 (0,51–0,77). Чувствительность и специфичность данной модели в области порогового значения составила 69 и 57% соответственно. Данное значение свидетельствует о низкой предсказательной способности предложенной модели. Учитывая, что на наступление беременности потенциально могут оказывать влияние ряд дополнительных факторов, в том числе качество эмбриона, для повышения предсказательной способности необходимо создание комплексной модели, учитывающей, помимо рецепторного статуса эндометрия, другие факторы.
Среди пациенток, у которых по данным морфологического исследования эндометрий соответствовал средней стадии фазы секреции, нами были выявлены достоверные различия только в экспрессии мРНК гена инсулиноподобного фактора роста, связывающего протеин-2 (IGFBP2). Уровень экспрессии данного гена повышен в 1,7 раза (р=0,020) у женщин, у которых в дальнейшем наступила биохимическая беременность, по сравнению с пациентками с отрицательным результатом (медиана составила 0,09 (0,07–0,16) против 0,15 (0,12–0,20) соответственно).
Обсуждение
При анализе профиля ряда молекулярно-биологических маркеров, участвующих в процессе имплантации, согласно полученным нами данным, выявлена диагностическая значимость трех маркеров в раннюю фазу секреции, позволяющая косвенно оценить состояние эндометрия: IL-15, VEGF-А, MMP-11.
Согласно исследованиям последних лет, процесс имплантации эмбриона сопровождается различными морфологическими, клеточными и молекулярными изменениями в эндометрии, подобными воспалительной реакции, в ходе которой преобладает экспрессия провоспалительных цитокинов (Th1), стимулирующих клеточное звено иммунитета [11]. Очевидно, рецептивность эндометрия тесно связана с воспалительным ответом и продукцией провоспалительных цитокинов и иммунокомпетентных клеток.
IL-15 – провоспалительный цитокин, основной функцией которого является индукция активации и пролиферации естественных эндометриальных киллерных клеток (uNK-клеток), играющих важную роль в имплантации бластоцисты [12, 13]. Уровень экспрессии мРНК IL-15 в эндометрии повышается в лютеиновую фазу, достигая пика в «окно имплантации». В работе N. Mariee и соавт. выявлено повышение экспрессии IL-15 в строме эндометрия в «окно имплантации» (ЛГ+7-9) у женщин с ПНИ по сравнению с фертильными [3]. Увеличение экcпрессии IL-15 коррелирует с повышением числа uNK-клеток, избыток которых приводит к бесплодию, ПНИ, привычному невынашиванию беременности [4].
Важный процесс, необходимый для формирования состояния рецептивности – ангиогенез. Адекватное развитие сосудов обеспечивает функциональную подготовку эндометрия и его готовность к имплантации. Наряду с IL-15 в предложенную нами модель был включен ген VEGF-А.
VEGF-A является ключевым ангиогенным фактором и модулятором роста и трансформации сосудов [14]. Одним из механизмов, регулирующих экспрессию VEGF-A, является гипоксия [15]. В эндометрии VEGF-A преимущественно экспрессируется в железистых эпителиальных клетках и диффузно – в строме, причем пик экспрессии приходится на середину секреторной фазы, что соответствует периоду максимальной активности эндометриальных клеток. В работе B.C. Jee и соавт. выявлено снижение экспрессии VEGF-A в среднюю фазу секреции у пациенток с ПНИ после ЭКО без органической патологии эндометрия [9]. Нарушение процесса ангиогенеза в эндометрии, о котором можно судить на основании снижения экспрессии VEGF-А, может приводить к неадекватной циклической трансформации в эндометрии и нарушению процесса имплантации.
Процесс инвазии трофобласта связан с ремоделированием тканей экстрацеллюлярного матрикса, находящегося под контролем MMPs . MMPs представляют собой семейство цинк-зависимых эндопептидаз, функция которых связана с обменом белков межклеточного матрикса [16, 17]. Максимальная экспрессия MMPs выявляется в течение пролиферативной и поздней секреторной фаз. MMPs являются основными ферментами, регулирующими инвазивную активность клеток трофобласта в децидуальную ткань.
Согласно полученным нами данным, в раннюю секреторную фазу снижение экспрессии профиля генов в эндометрии оказалось прогностически более благоприятным для наступления беременности. Предположительно, повышение синтеза молекулярных факторов в предшествующем естественном цикле приводит к их гиперэкспрессии в цикле стимуляции, что связано с изменением их биологической активности и, как следствие, с нарушением регуляции процесса имплантации. В то же время более низкая продукция генов в спонтанном цикле, достигая оптимальных значений в «окно имплантации» в цикле стимуляции, активирует восприимчивость эндометрия к бластоцисте, что приводит к наступлению беременности.
Существенной особенностью настоящего исследования является разобщенность во времени диагностической процедуры и проведения программы ЭКО. Тем не менее, полученные результаты свидетельствуют, что морфологическая оценка стадии созревания эндометрия, полученная в стандартные сроки предыдущего менструального цикла, имеет важное прогностическое значение. Наблюдаемое нами повышение частоты клинической беременности у женщин с выявленной ранней секреторной фазой, по-видимому, свидетельствует об изменении как морфологического развития эндометрия, так и временных границ «окна имплантации» в стимулированных циклах. В исследованиях, оценивающих воздействие стимуляции суперовуляции на рецептивность эндометрия в сравнении с естественным циклом, были выявлены преждевременная секреторная трансформация эндометрия, а также изменение уровней экспрессии генов рецептивности, что может приводить к нарушению синхронизации возникновения «окна имплантации» и времени переноса эмбриона [18]. В нашей работе у женщин, чей эндометрий соответствовал средней лютеиновой фазе в предшествующем естественном цикле, в циклах стимуляции суперовуляции, морфологическое опережение созревания эндометрия и более раннее временное смещение «окна имплантации» оказали негативное влияние на частоту наступления беременности. Полученные результаты позволяют предполагать наличие определенной запрограммированности сроков созревания эндометрия, возможно, имеющую генетически обусловленную природу.
У пациенток с выявленной ранней секреторной фазой в естественном цикле преждевременная секреторная трансформация эндометрия под действием высоких концентраций эстрадиола в стимулированном цикле привела к синхронному процессу созревания эндометрия и развития эмбриона и, соответственно, благополучному исходу программы ЭКО. Именно для этих пациенток нами выявлена прогностическая значимость молекулярно-генетических маркеров. «Закономерность» наступления беременности у данной группы пациенток косвенно подтверждается тем, что практически все они реализовались в клиническую беременность. Для пациенток, у которых в цикле, предшествующем программе ЭКО, эндометрий соответствовал средней фазе, профиль экспрессии генов может быть охарактеризован как неблагоприятный, если оценивать его по критериям ранней фазы. По-видимому, наступление биохимической беременности у этих пациенток имеет более случайный характер, поэтому попытка создания прогностической модели не увенчалась успехом. «Неоптимальность» условий имплантации в этой группе подтверждается существенно более низкой вероятностью конвертации биохимической беременности в клиническую в данной группе.
В периимплантационный период в эндометрии продуцируются сотни биологически активных молекул, моделирующих его рецептивность. Однако постоянное изменение их спектра и выраженности экспрессии затрудняют поиски ключевых молекулярно-биологических факторов, характеризующих ограниченный период восприимчивости эндометрия. Поэтому актуальна углубленная оценка состояния рецепторного аппарата эндометрия у пациенток с бесплодием для поиска наиболее информативных биомаркеров успешной имплантации.
Заключение
Проведение морфологической оценки степени зрелости эндометрия и экспрессионного профиля ряда генов в период предполагаемого «окна имплантации» в естественном цикле, предшествующем стимуляции суперовуляции, может иметь важное значение для прогноза эффективности последующей программы ЭКО. Благоприятным признаком является наличие у женщин ранней стадии фазы секреции при гистологическом исследовании эндометрия и снижение экспрессии генов MMP-7, VEGF-А, IL-1b, IL-2, IL-8, IL-10, IL-18, TNF-α, TGF-β.
Предложенная модель с использованием значений уровней экспрессии мРНК генов VEGF-А, IL-15, MMP-11 в дальнейшем может быть применена в качестве метода оценки морфофункционального состояния эндометрия перед проведением программы ЭКО.
Полученные данные позволяют предположить, что молекулярные механизмы, способствующие формированию рецептивности эндометрия, тесно связаны с процессами регуляции активности uNK-клеток, ангиогенезом и ремоделированием внеклеточного матрикса, контролируемыми вышеуказанными генами. Необходимо дальнейшее исследование предложенных кандидатных маркеров для более углубленного изучения их роли в процессе имплантации и влияния соотношения их баланса на исходы ЭКО.



