Инфекция, вызываемая вирусом папилломы человека (ВПЧ) высокого канцерогенного риска (ВКР), является обязательным фактором, определяющим риск развития облигатного предрака – тяжелых цервикальных интраэпителиальных неоплазий (CIN2-3) и рака шейки матки (РШМ). ВПЧ обнаруживается практически во всех случаях онкологической патологии шейки матки [1, 2]. Однако, менее 10% женщин, инфицированных ВПЧ, имеют персистенцию вируса, из которых только 2–3% в дальнейшем обнаруживают клинические проявления [3]. Для выявления женщин с повышенным риском развития цервикальной патологии необходим поиск дополнительных факторов прогрессии CIN. В качестве таких показателей, свидетельствующих о прогрессии, рассматриваются изменения в уровне экспрессии микро-РНК [4] и мРНК некоторых генов – потенциальных онкомаркеров [5], а также определение наиболее агрессивных вариантов ВПЧ. При таком подходе пациенткам, инфицированным этими вариантами, будет показано более частое наблюдение до развития CIN, а при CIN1 у женщин старше 35 лет – эксцизионное или деструктивное лечение без периода наблюдения в течение 18–24 месяцев, которое может быть предложено пациенткам с другими, менее агрессивными вариантами ВПЧ.
Все типы ВПЧ, ассоциированные с развитием облигатного предрака (CIN2-3) и РШМ, формируют единый род альфа папилломавирусов, внутри которого выделяют видовые группы α5, α6, α7, α9, различающиеся по распространенности среди популяции, риску персистенции и развития тяжелых CIN (патогенности). В последнее время все больше внимания уделяется исследованию последовательностей длинного контролирующего региона и генов Е6/Е7 ВПЧ, поскольку именно эти участки отвечают за регуляцию жизненного цикла вируса и определяют его онкогенный потенциал [6, 7]. Другими словами, изменчивость генома ВПЧ в этих регионах влияет на способность данного варианта вируса к персистенции, а также его трансформирующую способность. Подобные исследования, в свою очередь, способствуют раскрытию особенностей взаимодействия хозяина и вируса и механизма ВПЧ-ассоциированного канцерогенеза.
ВПЧ 16 типа значительно чаще обнаруживается в образцах с онкологической патологией, по сравнению с другими типами. Исследования, направленные на выявление генетического разнообразия внутри типа позволили выделить несколько линий: А (ранее называемую европейско-азиатской, включающую варианты A1, A2, A3 (европейские, EUR), и A4 (азиатский); линия В (африканская), линия С (Африканская 2) и D – североамериканская, включающую варианты D1, D2, D3 [8]. Исследования, направленные на выявление связи между вариантом ВПЧ 16 типа и риском развития злокачественного процесса, показали, в частности, что неевропейские линии значительно чаще встречаются в цервикальных образцах с диагнозом CIN2-3, чем европейские варианты [9, 10]. Изучение вариантов ВПЧ в Российской Федерации позволит выявить распространенность тех или иных мутаций по регионам, что важно для оценки и сравнения канцерогенного потенциала генотипов ВПЧ в стандартизированной форме, а также может иметь значение при разработке алгоритма обследования и наблюдения пациенток с сомнительными результатами цитологии.
Целью исследования явилось изучение распространенности генетических вариантов ВПЧ 16 типа на территории Российской Федерации, а также оценка взаимосвязи между вариантом ВПЧ 16 типа и вероятностью обнаружения злокачественной патологии шейки матки, для определения прогностически неблагоприятных вариантов ВПЧ 16 типа.
Материал и методы
Образцы. В исследование включены образцы соскобов эпителия цервикального канала 63 женщин из Москвы и Московской области, проходивших скрининговые исследования, а также с гистологическим диагнозом CIN 2+ (CIN2, CIN3, РШМ) из ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России. У всех пациенток было получено информированное согласие на обработку результатов исследований. Всем женщинам с признаками поражения была проведена расширенная кольпоскопия с определением площади и характера поражения. Взятие образцов осуществлялось в транспортную среду для жидкостной цитологии BD SurePath (BD Diagnostics, США). Приготовление и окрашивание цитологического препарата по Папаниколау проводилась в автоматическом режиме на автоматах BD PrepMate и BD PrepStain (Becton Dickinson, США). Цитологический диагноз формулировался с использованием терминологии Bethesda (2014). Диагноз CIN1 верифицировался в материале расширенной биопсии пораженного участка. Диагноз CIN2+устанавливался на основании гистологического исследования материала петлевой эксцизии или конизации. Контрольная группа образцов с диагнозом NILM (негативные по интраэпителиальному поражению) устанавливалась на основании повторных отрицательных цитологических исследований.
Выявление и типирование ДНК ВПЧ ВКР в образцах соскобов эпителия цервикального канала проводили с использованием наборов реагентов «АмплиСенс ВПЧ ВКР скрин-титр-14-FL» и «АмплиСенс ВПЧ ВКР генотип-титр-FL» (ЦНИИЭ Роспотребнадзора, Москва). В данное исследование включены образцы биологического материала, содержащие ВПЧ 16 типа.
Амплификация фрагмента генома ВПЧ 16 типа. Для определения варианта ВПЧ 16 типа был исследован длинный кодирующий регион (LCR), ген Е6 и фрагмент гена Е7. Длина исследованного фрагмента составила порядка 1700 нуклеотидов, в положении от 7050 до 780 нуклеотида (указано для референсной последовательности ВПЧ 16 типа, код доступа GenBank K02718). Амплификацию указанного участка проводили двумя перекрывающимися фрагментами с использованием праймеров: прямой 1: 5’-CTA CAA GCA GGA TTG AAG GC-3’, обратный 1: 5’-GAT TTC GGT TAC GCC CTT AG-3’, прямой 2: 5’-GGG TTA CAC ATT TAC AAG CAA C-3’, обратный 2: 5’-CAA AGT ACG AAT GTC TAC GTG T-3’. Программа амплификации: 950 – 15 минут; 950 – 10 секунд, 650 – 20 секунд, 720 – 20 секунд, 40 циклов; 720 – 2 минуты. Амплификацию проводили на приборе Терцик (ДНК-Технология, Россия).
Секвенирование регионов LCR, Е6, Е7 проводилось на секвенаторе AbiPrism (Applied Biosystems, США) с использованием указанных праймеров, с двукратным перекрытием исследуемой последовательности. В качестве референсных последовательностей использованы данные GenBank: K02718 (вариант A1), AF536179 (вариант A2), HQ644236 (вариант A3), AF534061 (вариант A4), AF536180 (вариант B1), HQ644298 (вариант B2), AF472509 (вариант C), HQ644257 (вариант D1), AY686579 (вариант D2), и AF402678 (вариант D3). Анализ последовательностей проводили с использованием ПО BioEdit 7 [11].
Филогенетический анализ проводился в программе MEGA 6 [12] методом максимального правдоподобия с 500-кратным бутстрапом.
Статистический анализ проводился с использованием ПО PASW Statistics18. Отношение шансов наличия гистологически подтвержденного диагноза CIN2+ и имеющегося варианта ВПЧ 16 типа с 95% доверительным интервалом рассчитывался методом точного теста Фишера. Для оценки корреляции вирусной нагрузки и возраста пациента с морфологическим диагнозом был использован односторонний ANOVA тест.
Результаты и обсуждение
В зависимости от морфологического диагноза образцы распределились следующим образом: дважды негативные по интраэпителиальному поражению (NILM) – 18 образцов; низкая степень плоскоклеточного поражения (CIN1) – 18 образцов, высокая степень плоскоклеточного поражения (CIN2,3) – 15 образцов; плоскоклеточный рак – 11 образцов, аденокарцинома – 1 образец. Возраст женщин составил от 21 до 65 лет (медиана возраста – 34 года), не различался для женщин с нормой и патологией шейки матки (p=0,12).
В 52% образцов (33 из 63) ВПЧ 16 типа был представлен в виде моноинфекции, в 48% (30 из 63) – в виде коинфекции с другими типами ВПЧ. Средняя вирусная нагрузка в образцах с диагнозом NILM и CIN1 составила 5,3±1,3 lg ДНК ВПЧ на 105 клеток человека, для образцов с диагнозом CIN2-3 и РШМ: 6,0±0,8 lg ДНК ВПЧ на 105 клеток человека, со статистически значимым различием между группами (р=0,02).
Результаты филогенетического анализа представлены на рис.1. Подавляющее большинство (62 из 63 образцов) принадлежали к линии А, только один образец, выделенный от пациентки с диагнозом CIN3, кластеризовался совместно с референсной последовательностью линии D. Вместе с этим, внутри линии А не обнаружено разделения между последовательностями, полученными из образцов с разным цитологическим диагнозом.
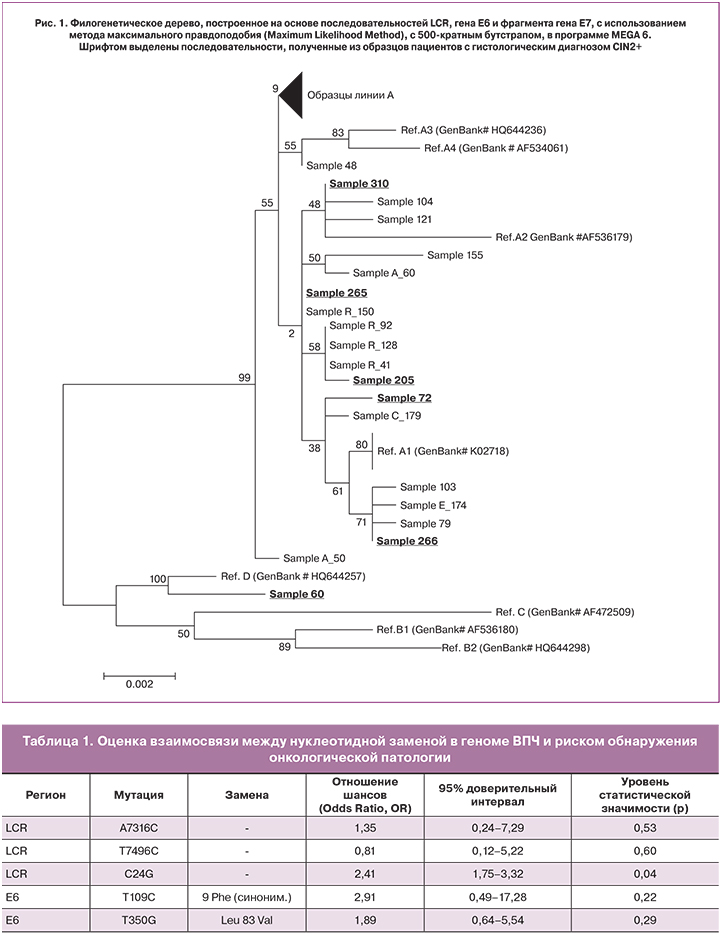
По имеющимся литературным данным, риск развития неопластической патологии шейки матки ниже при инфицировании европейскими вариантами ВПЧ, по сравнению с неевропейскими вариантами. В частности, секвенирование методом нового поколения более чем 3500 образцов из США показало значительное повышение риска развития аденокарциномы у лиц, инфицированных вариантом D2 c OR>100 [13], по сравнению с вариантами линии А. Также, в регионах, где значительно распространение неевропейских линий (в первую очередь, в Азии) была показана взаимосвязь наличия линий А4/As и D с прогрессией заболевания [14]. В странах Европы, где популяция ВПЧ моногенна и представлена европейскими вариантами, взаимосвязи обнаружить не удалось [15]. Таким образом, представленные данные полностью совпадают с результатами европейских исследований.
Замены в нуклеотидной последовательности исследуемых фрагментов, обнаруженные более чем в 3 образцах, представлены на рисунке 2. Чаще всего наблюдался полиморфизм в области LCR в положении 7193 (G/T) у 82,5% (52 из 63); 7521 (G/A) – у 87,3% (55 из 63), в гене Е6 в положении 350 (G/T) – у 63,5% (40 из 63), в положении 109 (Т/С) – у 12,7% (8 из 63). У трех образцов не удалось получить последовательность LCR, у одного – Е6/Е7. Так как обнаруженные нами замены не являются специфичными для какого-либо варианта внутри европейской линии и встречаются у всех представителей линии (А1, А2, А3) [6], провести разделение внутри линии до варианта не представлялось возможным.

Для оценки риска наличия онкологической патологии шейки матки в зависимости от наличия замены в исследованном фрагменте, рассчитывали величину отношения шансов (табл. 1).
Анализ полученных данных показал, что замена C24G, достоверно чаще встречалась в образцах с диагнозом CIN2+ (р=0,04). Сходные результаты для этой замены были обнаружены в исследовании, проведенном на Тайване [9].
Замена Т109С в данном исследовании также чаще обнаруживалась в образцах с диагнозом CIN2+ (OR=2,91), однако различия статистически недостоверны (p=0,22), что, вероятно, связано с небольшим количеством образцов. Эта замена редко встречается в публикациях, но, в описанных случаях – чаще в образцах с диагнозом CIN2+ [16, 17].
Наиболее часто в литературе встречается описание мутации в положении 350 гена Е6, ведущей к замене аминокислоты лейцин на валин в положении 83 белка Е6. В данной работе распространенность варианта 350G составила 63,5%, мутация несколько чаще встречалась в образцах с диагнозом CIN2+ (OR=1,89), однако различия статистически недостоверны (р=0,29), что также может быть связано с небольшим количеством наблюдений.
В работе Sichero et al. 2012 in vitro на первичных кератиноцитах человека вариант 350G показал более высокий онкогенный потенциал, чем вариант 350Т [18]. При этом, данные, полученные in vivo, не столь однозначны. Так, в одних исследованиях вариант 350G значительно чаще встречался в образцах с CIN2+ [19], тогда как в ряде других работах такой взаимосвязи выявить не удалось [17, 20]. Кроме того, в работе Cornet et al., 2013 [21] продемонстрировано повышение риска персистенции у варианта 350T, хотя различия в риске прогрессии также обнаружено не было.
Заключение
В данной работе была впервые в Российской Федерации изучена внутритиповая изменчивость ВПЧ 16 типа. Несколько обнаруженных мутаций (C24G, T109C и T350G) чаще встречаются в образцах с диагнозом CIN2-3 и РШМ, причем различия для замены C24G статистически достоверны, что свидетельствует о более агрессивном влиянии этого варианта на течение неопластического процесса. Практикующему врачу информация о наличии или отсутствии факторов риска возникновения и прогрессии CIN позволит выбирать адекватную тактику ведения, определить частоту наблюдения у пациенток с персистирующей инфекцией ВПЧ 16 типа и CIN1, избегая неоправданного лечения.
Изучение распространенности вариантов ВПЧ 16 типа показало, что популяция ВПЧ 16 типа достаточно моногенна и представлена европейской линией.
Для полномасштабного обоснования выводов необходимо провести исследование большего количества образцов, в том числе и из сопредельных с Российской Федерацией регионов, а также развернуть полногеномные исследования. Понимание генетической роли, обуславливающей онкогенный потенциал вариантов ВПЧ 16 типа, в том числе и в других регионах генома вируса, поможет раскрыть важные биологические и/или иммунологические механизмы взаимодействия между вирусом и хозяином, что внесет свой вклад в создание эффективных инструментов для контроля папилломавирусной инфекции и вызываемой ею злокачественной трансформации.



