Синдром поликистозных яичников (СПКЯ) среди подростков встречается в популяции в 2,2–7,5%, среди пациенток с нарушением менструального цикла и гирсутизмом – до 68% [1, 2]. В связи c тяжелыми репродуктивными и сердечно-сосудистыми осложнениями заболевания необходимы ранняя диагностика и коррекция симптомокомплекса при его манифестации в подростковом периоде до этапа развития выраженных клинических проявлений.
В настоящее время валидизированных диагностических критериев СПКЯ у подростков не существует, а имеющиеся рекомендации позволяют лишь заподозрить формирование СПКЯ [2, 3]. Рекомендации 2015 г. Американской ассоциации клинических эндокринологов (ААСЕ), Американского колледжа эндокринологии, Общества по избытку андрогенов и СПКЯ (AES), а также Европейского эндокринологического общества 2014 г. и Американского – 2013 г. разработаны в первую очередь для ведения взрослых пациенток и, как указывают сами авторы, требуют пересмотра и дополнения для пациенток в подростковом возрасте [3–5].
Клиническая картина СПКЯ крайне полиморфна. В подростковом возрасте симптомы СПКЯ могут походить на признаки, сопровождающие нормальное половое созревание [1, 2]. В первые годы после менархе физиологическими особенностями подростков являются нерегулярные ановуляторные циклы. Так, в первый год после менархе 85% циклов являются ановуляторными, для 59% циклов данная тенденция сохраняется и через 3 года [4, 6]. При этом в исследованиях с участием подростков показано, что интервалы между менструациями менее 20 дней или персистенция олигоменореи с интервалами более 45 дней спустя 2 года после менархе могут рассматриваться как признак олиго-ановуляции [5, уровень доказательности В].
В период полового созревания устанавливаются ритмы пульсирующего выброса гонадотропин-рилизинг-гормона, физиологическая гиперинсулинемия, функциональная гиперандрогения (ГА), включая гирсутизм и акне [3, 4]. Изолированная легкая степень гирсутизма и изолированное акне и/или алопеция в подростковом возрасте не могут рассматриваться как клиническое доказательство ГА [6, уровень доказательности В].
Вызывает сложности оценка гирсутизма у подростков, в том числе с использованием балльной системы Ферримана–Галлвея (1961 г.), которая не адаптирована для детей и не рекомендуется к использованию Обществом по гиперандрогении (AES) и Обществом по СПКЯ [6, 7].
Определение показателей гормонального профиля и биохимической ГА у подростков имеет свои трудности, поскольку нет референсных гормональных интервалов для девочек с нормально протекающим пубертатным периодом. В Российской Федерации используются референсные стандартизованные лабораторные нормативные показатели для девочек в возрасте 14,5–15,5, 15,5–16,5 и 16,6–17,5 лет (Фанченко Н.Д. и соавт., 1986) [8]. Однако в настоящее время референсные значения для здоровых современных подростков меняются и требуется пересмотр существующих значений, которые могли бы быть рекомендованы к применению.
Для оценки биохимической ГА как диагностического маркера СПКЯ одним из наиболее чувствительных и предпочтительных способов является подсчет индекса свободных андрогенов (ИСА) по соотношению общего тестостерона и глобулина, связывающего половые гормоны (ГСПГ) [2, 6]. Снижение уровня ГСПГ само по себе является одним из маркеров СПКЯ, взаимосвязанным с инсулинорезистентностью и ГА, в том числе в подростковом возрасте [7]. Рабочая группа AES обосновала определение уровня андростендиона для диагностики ГА, предшественника тестостерона, не связывающегося ГСПГ, методы измерения которого более специфичны и чувствительны в сравнении с таковыми для тестостерона [7, 9]. Однако определение ГА у подростков имеет свои трудности, поскольку показатели гормонов у девочек с СПКЯ зачастую находятся в пределах нормативных значений для взрослых, а методы анализа циркулирующего тестостерона в крови все еще существенно лимитированы по чувствительности [4].
Одним из общепринятых диагностических критериев СПКЯ является поликистозная морфология яичников по данным ультразвукового исследования (УЗИ) [5]. Наряду с этим, диагностика поликистозной морфологии яичников в подростковом возрасте вызывает сложности, в особенности при ожирении [10, 11]. В качестве неинвазивного скринингового теста в диагностике СПКЯ и в дополнение к УЗ-параметрам предлагается использовать уровень антимюллерова гормона (АМГ) [4, 10]. По данным анализа 2016 г., использование уровня АМГ ≥7,03 нг/мл дает 50,0% и 70,8% специфичности и чувствительности соответственно в диагностике СПКЯ у молодых пациенток [11].
Таким образом, несмотря на многочисленные исследования, отсутствуют единые критерии диагностики заболевания в подростковом возрасте и пороговые значения лабораторных и инструментальных методов.
Цель исследования – уточнение диагностических критериев и клинико-лабораторных особенностей СПКЯ у девочек в возрасте 15–17 лет.
Материалы и методы
В исследование включены 130 девочек с СПКЯ, согласно Роттердамским критериям диагностики, в возрасте от 15 до 17 лет включительно. Исследование было одобрено Комиссией по этике Центра. Критерии включения пациенток в исследование: возраст 15–17 лет (2–3 года после менархе); Роттердамские критерии диагностики СПКЯ при наличии двух из трех компонентов: олиго-/аменорея, клинические и/или биохимические признаки ГА и эхографические признаки поликистозных яичников, исключение всех других эндокринопатий, отсутствие приема лекарств за последние 3 месяца до начала исследования, в том числе комбинированных оральных контрацептивов (КОК), информированное согласие пациентки на включение в исследование. Критерии исключения: гиперпролактинемия, врожденная дисфункция коры надпочечников, нарушения щитовидной железы, синдром и болезнь Кушинга, опухоли органов малого таза, обострение хронических и острые соматические заболевания, генетические синдромы и пороки развития.
Группу сравнения составили 30 сверстниц с регулярными менструациями, отнесенные к 1-й группе здоровья, без гинекологической и эндокринной патологий.
Всем участницам исследования провели общеклиническое обследование, подробный сбор анамнеза, жалоб, оценку антропометрических показателей (рост, индекс массы тела (ИМТ), соотношение окружности талии и бедер (ОТ/ОБ)), гирсутизма и степени полового созревания.
У всех участниц исследования определяли биохимический и липидный профиль крови. Оценку проводили по основным показателям: общий холестерин, триглицериды (ТГ), липопротеины низкой плотности (ЛПНП), липопротеины высокой плотности (ЛПВП), высокочувствительный С-реактивный белок, лептин. Исследования проводили фотометрическим и турбидиметрическим методами на автоматических анализаторах BA-400, A-25 реагентами Biosystems (Испания). Двухчасовой пероральный глюкозотолерантный тест (ПГТТ) с нагрузкой 75 г глюкозы проводили спустя 12–16 ч после последнего приема пищи. Уровень глюкозы и иммунореактивного инсулина определяли в цельной венозной крови натощак, а также через 120 минут на фоне ПГТТ. Рассчитывали гомеостатический индекс инсулинорезистентности НОМА-ИР. Для косвенной оценки абдоминальной жировой ткани использован рекомендованный в широкой практике индекс висцерального ожирения (ИВО). ИВО рассчитывали по формуле (ОТ (см)/(36,58+(1,89×ИМТ (кг/м2))) × (ТГ (ммоль/л)/0,81) × (1,52/ЛПВП (ммоль/л)).
Всем пациенткам на 3–4-й день собственного менструального цикла или на фоне закономерной менструальноподобной реакции в ответ на пробу с гестагенами при длительной задержке менструаций определяли уровни лютеинизирующего гормона (ЛГ), тиреотропного гормона (ТТГ), фолликулостимулирующего гормона (ФСГ), дегидроэпиандростерона-сульфата (ДГА-С), андростендиона, пролактина (Прл), эстрадиола (Е2), кортизола, тестостерона (Т), ГСПГ, свободного тироксина (Т4). Определение концентраций гормонов проводилось электро- и иммунохемилюминесцентным методом на автоматических анализаторах Cobas е 411 («Ф. Хоффманн-Ла Рош», Швейцария), Immulite 2000, Immulite 1000 (Siemens, США) с использованием реагентов тех же фирм. Определение АМГ, 17-ОН-прогестерона, ГСПГ осуществлялось методом иммуноферментного анализа на анализаторах DYNEX DSX System и с использованием системы DPC (США) на приборе Immulite. Полученные в исследовании результаты гормональных показателей измерены на приведенном оборудовании, рекомендованном международным сообществом для получения в широкой практике доверительных результатов. Приведенные референсные значения валидированы для российских подростков в возрасте 15–17 лет.
Всем девочкам было проведено УЗИ органов малого таза, молочных и щитовидной желез на 3–5-й день цикла. Исследование выполнялось на ультразвуковом аппарате Vivid-q фирмы GE HEALTHCARE с использованием линейного и конвексного датчика частотой от 1,8–6,0 МГц. Исследование проводили при наполненном мочевом пузыре трансабдоминальным методом.
Яичниково-маточный индекс (ЯМИ) вычисляли по формуле (В.Н. Демидов, 1990): ЯМИ = 0,5 (0,5×Vпр. яичника+0,5×V лев. яичника)/толщина матки [12].
Статистическую обработку данных проводили с помощью программы Statistica 8 фирмы Statsoft Inc. Оценка категориальных переменных произведена с вычислением частот и долей, для сравнения различий использован χ²-тест. При нормальном виде распределения вычисляли среднее значение (М) и стандартное отклонение (SD). При ненормальном распределении вычисляли медиану (Ме) и интерквартильный размах. Для сравнения средних значений величин при нормальном распределении переменных в двух независимых выборках применяли параметрический t-критерий Стьюдента, при ненормальном распределении – U-критерий Манна–Уитни. Скорректированное отношение шансов (ОШ) развития СПКЯ под влиянием различных факторов риска оценивали с помощью методов логистической регрессии с 95% доверительным интервалом (ДИ). Оценку диагностической точности использования тестов проводили методами многофакторного анализа с построением ROC-кривых, вычислением площади под кривой и определением качества моделей.
Результаты
Значимыми анамнестическими факторами риска развития СПКЯ у девочек, по данным многофакторного анализа, явились: наличие у матери до беременности девочкой расстройств менструаций, СПКЯ и эндокринного бесплодия (р=0,0157, ОШкор=4,97; 95% ДИ 1,33–18,53); неврологические нарушения, в первую очередь внутричерепная гипертензия, нарушение мышечного тонуса в периоде новорожденности и первого года жизни (р=0,0391, ОШкор=8,95; 95% ДИ 1,09;–73,41); перенесенные травматические поражения в детском возрасте (р=0,0233, ОШкор=2,82; 95% ДИ 1,13–7,04); повторяющиеся задержки менструации на период более 90 дней с менархе (р=0,0092, ОШкор=2,98; 95% ДИ 1,28–6,91). Анамнестическими особенностями девочек-подростков с СПКЯ на фоне метаболических нарушений, в отличие от пациенток без таковых и «здоровых» девочек, явилось осложненное течение родов у их матерей (р=0,0220).
Остальные факторы риска – семейная отягощенность, соматические, инфекционные и аллергические заболевания в детстве не оказывали значимого влияния.
По данным объективного обследования, пациентки с СПКЯ, в сравнении с группой контроля, характеризовались более высокими показателями ИМТ (22,4 (19,9–27,2) против 20,2 (18,4–21,8), р=0,0002), ОТ (75,0 (69,0–85,0) против 66,0 (62,0–70,0), р=0,0003) и ОБ (98,0 (92,0–103,0) против 0,72 (0,68–0,76), р=0,0019). Использование многофакторного анализа позволило подтвердить, что ИМТ (р=0,0156, ОШ=1,08; 95% ДИ 1,01–1,56) и ОТ (р=0,0237, ОШ=1,11; 95% ДИ 1,01–1,19) являются значимыми факторами риска развития СПКЯ.
Как и следовало ожидать, у 92 (70,8%) девочек с СПКЯ был отмечен повышенный рост стержневых волос в нетипичных для женщин местах (по верхнему краю губы, подбородку, вокруг сосков, по средней линии живота, на внутренней поверхности бедер), тогда как в группе контроля гирсутизма не отмечено. Большая половина пациенток с СПКЯ (77; 59,2%) предъявляли жалобы на угри и повышенную сальность кожи, тогда как в группе контроля таких девочек было 4 (13,3%) (р<0,0001, χ2-тест).
В момент обследования у 60 (46,2%) пациенток наблюдалась олигоменорея, задержки менструаций сменялись аномальными маточными кровотечениями у 17 (13,1%) пациенток. Аменорея отмечена у 43 (33,8%) девочек, при этом первичная аменорея – у 5 (3,8%) пациенток. Регулярный цикл в год обследования отмечен у 7 (5,3%) девочек с СПКЯ, однако 4 (3,1%) из них отмечали олигоменорею в анамнезе.
Обследованные пациентки по показателям липидного профиля крови не отличались значимо от группы контроля, при этом характеризовались более высоким ИВО (1,0 (0,6–1,6) против 0,7 (0,5–1,0), р=0,0461), что говорит о повышенном риске кардиометаболических нарушений у пациенток с СПКЯ уже в подростковом возрасте.
При анализе гормонального профиля выявлено, что многие из параметров, значимо отличавшихся между группами СПКЯ и контролем, находились в пределах референсных лабораторных и утвержденных повозрастных значений. В сравнении с утвержденными повозрастными нормативами гормонов для девочек (Н.Д. Фанченко и соавт., 1986 [8]) выявлено изменение современных показателей у здоровых девочек, у многих из которых регистрировалось снижение уровня ЛГ (12; 40,0%) и у большинства – снижение концентрации Т (17; 56,7%), что затрудняет применение прежних возрастных интервалов у современных подростков. Полученные нами данные валидированы для группы российских здоровых подростков по рекомендациям международных сообществ по гормональным исследованиям, что позволило пересмотреть референсные значения гормональных параметров у девочек в возрасте 15–17 лет в фолликулярную фазу на 2–3-й день самостоятельного менструального цикла (табл. 1).
Сравнение полученных гормональных показателей между группами пациенток с СПКЯ и здоровых девочек приведено в табл. 2.
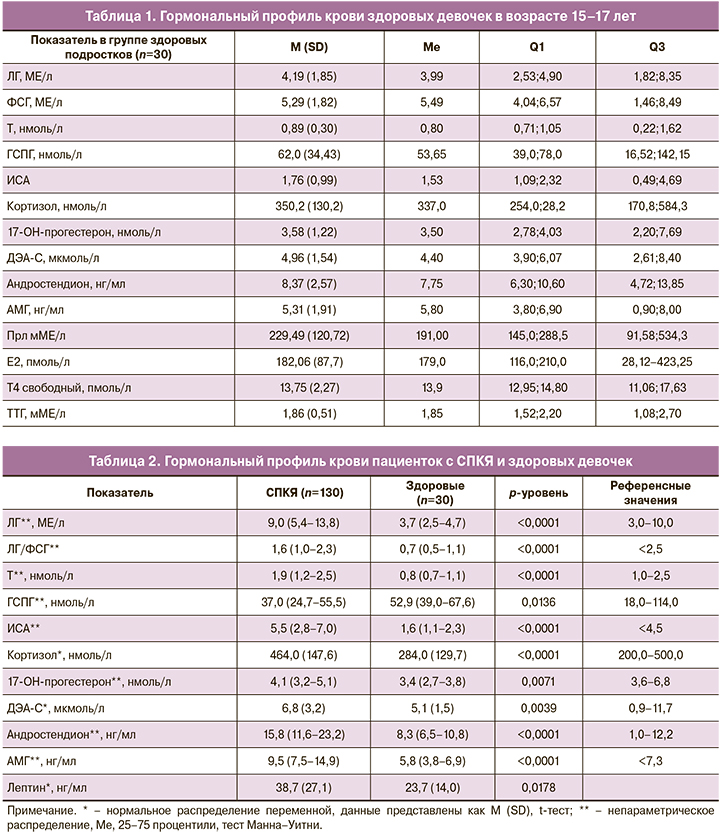
 Поиск пороговых значений гормональных показателей, которые могли бы быть использованы для диагностики СПКЯ в возрасте 15–17 лет, позволил определить, что наиболее значимыми критериями СПКЯ у девочек в подростковом возрасте с высокой чувствительностью и специфичностью (>75,0% и 89,0–93,0%) являются уровень АМГ >7,20 нг/мл и ИСА >2,75 (рис. 1). Высокая чувствительность (63,2–78,2%) и специфичность (84,4–93,7%) выявлены для показателей Т >1,15 нмоль/л, андростендиона >11,45 нг/мл, соотношения ЛГ/ФСГ >1,23 в диагностике СПКЯ у девочек в возрасте 15–17 лет.
Поиск пороговых значений гормональных показателей, которые могли бы быть использованы для диагностики СПКЯ в возрасте 15–17 лет, позволил определить, что наиболее значимыми критериями СПКЯ у девочек в подростковом возрасте с высокой чувствительностью и специфичностью (>75,0% и 89,0–93,0%) являются уровень АМГ >7,20 нг/мл и ИСА >2,75 (рис. 1). Высокая чувствительность (63,2–78,2%) и специфичность (84,4–93,7%) выявлены для показателей Т >1,15 нмоль/л, андростендиона >11,45 нг/мл, соотношения ЛГ/ФСГ >1,23 в диагностике СПКЯ у девочек в возрасте 15–17 лет.
При сравнительной характеристике структуры яичников с помощью 2D-УЗИ органов малого таза показано, что наиболее значимыми параметрами в диагностике СПКЯ у подростков явились: показатель среднего объема яичников (при Vяичников ср.>10,70 см3, чувствительность 83,0%, специфичность 83,0%, AUC=84,8%, р<0,05) и яичниково-маточный индекс (ЯМИ) (при ЯМИ >3,95, чувствительность 81,0%, специфичность 83,0%, AUC=83,7%, р<0,05).
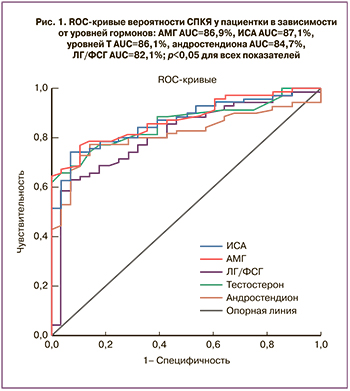
Проведенный нами регрессионный анализ выявленных специфичных параметров показал, что использование более 4 параметров позволяет диагностировать СПКЯ у подростков с наиболее высокой точностью – выше 90%; применение более 3 параметров – с точностью 85%; при использовании 2 и менее – точность снижается (рис. 2). При этом оказалось, что из всех представленных параметров именно уровень АМГ, который сам по себе имеет высокую, но недостаточную точность в 78,7%, в сочетании с переменной упоминавшегося выше лептина – адипокина, характеризующего метаболические особенности пациенток, дает максимальную точность диагностики – 91,8% – уже на основании 2 параметров и может быть рекомендован к определению (χ2 (2)=58,3, р<0,00001). Уравнение для диагностики СПКЯ: logit=85,73–1,73×[АМГ]–0,12×[Лептин]. При значении уравнения меньше 70,72 чувствительность диагностики составила 92,5%, специфичность – 90,0%. Таким образом, возможна диагностика СПКЯ у подростков с высокой точностью, используя концентрацию АМГ и лептина в сыворотке крови.
Обсуждение
Диагностические критерии, используемые в подростковом возрасте, являются предметом дискуссии [4, 7]. В 2003 г. группой экспертов Европейского общества репродукции и эмбриологии человека (ESHRE) и Американского общества репродуктивной медицины (ASRM) в Роттердаме была сформулирована наиболее широко применяемая на сегодняшний день система критериев диагностики СПКЯ на основании наличия 2 из 3 следующих признаков: олиго-/ановуляции, клинической и/или биохимической ГА и эхографических признаков поликистозных яичников [2]. Однако уровни гормонов для определения гормональных показателей и биохимической ГА у подростков не определены, поскольку широко варьируют, в том числе в зависимости от используемого лабораторного оборудования и реагентов. Нами предложены уровни гормональных показателей, валидированные для популяции российских подростков в первую фазу цикла на 2–3-й день в возрасте 15–17 лет включительно, на наиболее часто используемом оборудовании для электро- и иммунохемилюминесцентных методов на автоматических анализаторах Cobas е 411 («Ф. Хоффманн-Ла Рош», Швейцария), Immulite 2000, Immulite 1000 (Siemens, США), DYNEX DSX System с использованием реагентов тех же фирм.
При анализе гормонального профиля пациенток с СПКЯ в сравнении с группой «здоровых» девочек нами было выявлено значимое повышение уровня ЛГ, соотношения ЛГ/ФСГ, Т, ИСА, 17-ОН-прогестерона, ДГА-С, андростендиона и АМГ, что согласуется с данными ряда авторов [3]. В нашем исследовании, аналогично данным Güdücüa N. et al., у пациенток с СПКЯ были показаны положительные корреляции ИСА с ИМТ (r=0,46; p<0,05), ОТ/ОБ (r=0,35; р<0,05), НОМА-ИР (r=0,30; p<0,05), ИВО (r=0,40; р<0,05), и отрицательная – с ЛПВП (r=-0,29; р<0,05), которые не были значимыми в группе здоровых девушек [13]. Данные связи подтверждают положение о положительной ассоциации ГА яичникового генеза с атерогенным профилем крови, инсулинорезистентностью и риском сердечно-сосудистых осложнений у пациенток с СПКЯ уже в подростковом возрасте. Одним из значимых маркеров СПКЯ, взаимосвязанным с инсулинорезистентностью и ГА, является снижение уровня ГСПГ [3, 14]. В нашем исследовании у пациенток с СПКЯ уровень ГСПГ был значимо снижен по сравнению с контрольной группой (37,0 нмоль/л (24,7–55,5) против 52,9 нмоль/л (39,0–67,6); p<0,05), что определило более высокий уровень ИСА (5,5 (2,8–7,0) против 1,6 (1,1–2,3); р<0,0001). В исследовании Yetim A. et al. [2] в 2016 г. с участием 53 пациенток с СПКЯ в возрасте 15–20 лет и 26 здоровых девочек медиана уровня ГСПГ у пациенток с СПКЯ, в сравнении со здоровыми девочками, была значимо ниже (25,8 нмоль/л против 49,6 нмоль/л; p<0,01), а медиана уровня ИСА – значимо выше (6,8 против 3,0; p<0,0001), что сопоставимо с нашими данными [1].
Сложность диагностики СПКЯ в подростковом возрасте, связанную не только с гетерогенной клинической картиной, но и с отсутствием четких значений гормональных параметров и ГА у подростков, подчеркивают Tsikuras P. et al. в систематическом обзоре 2015 г. [2]. Авторы суммировали данные 24 работ и выявили, что при обследовании подростков с СПКЯ, в сравнении с существующими референсными интервалами, уровни Т, ДГА-С, ЛГ, ЛГ/ФСГ, андростендиона были выше нормы не намного более чем в половине случаев и часто соответствовали нормативным интервалам. В нашем исследовании (на основании нормативных повозрастных параметров для подростков) наиболее значимыми в диагностике гормональных нарушений при СПКЯ оказались повышенные уровни АМГ (75,4%), ЛГ (62,3%) и андростендиона (66,2%), т.е. несколько более чем в половине случаев. Все остальные показатели отличались от нормативов менее чем в половине и даже в трети случаев. Таким образом, вероятность подтверждения диагноза недостаточно высока.
Большинством авторов подчеркивается важность при оценке ГА в подростковом возрасте подсчета ИСА и определения андростендиона [2, 7]. Принимая во внимание, что у подростков с СПКЯ показатели ГА зачастую находятся в пределах нормативных значений для взрослых, а методы анализа Т в крови существенно лимитированы по чувствительности, авторы подчеркивают, что необходимы исследования пороговых повозрастных уровней гормонов при СПКЯ, а также определение референсных интервалов для здоровых девочек с нормально протекающим пубертатным периодом [3]. В работе Pinola M.et al. 2015 г. показано, что уровень андрогенов при СПКЯ снижается с возрастом. При этом продемонстрировано, что высокую чувствительность и специфичность в диагностике СПКЯ у женщин до 40 лет имели уровни андростендиона >9,65 нг/мл, ИСА >2,34 [9]. Основываясь на результатах нашего исследования 130 девочек с СПКЯ и 30 здоровых девочек, использование показателей Т >1,15 нмоль/л, андростендиона >11,45 нг/мл, соотношения ЛГ/ФСГ >1,23 является обоснованным для комплексной диагностики СПКЯ в данном возрастном интервале, так как показана высокая чувствительность (63,2–78,2%( и специфичность (84,4–93,7%) данных тестов. На сегодняшний день в доступной нам литературе подобные работы у пациенток в подростковом возрасте практически отсутствуют.
Всемирным педиатрическим Консенсусом в 2015 г. подчеркивается возможность использования в качестве неинвазивного скринингового теста в диагностике СПКЯ уровня АМГ [11]. В исследовании девочек 15–20 лет с СПКЯ Yetim A. et al. в 2016 г. при расчете порога отсечки для уровня АМГ показали, что значение АМГ >6,10 нг/мл обладало 92,3% чувствительностью и 81,1% специфичностью в диагностике СПКЯ [1]. В другом исследовании 2017 г. Merino P.M. et al. рекомендовали использовать пороговое значение АМГ >7,03 нг/мл при обследовании 102 подростков с СПКЯ с 50,0% чувствительностью и 70,8% специфичностью [11]. Вместе с тем исследования по определению пороговых значений гормонов для диагностики СПКЯ в подростковом возрасте единичны. Наши данные согласуются с результатами исследования Буралкиной Н.А., Уваровой Е.В. (2010) 49 здоровых подростков в возрасте 15–17 лет, для которых определены референсные значения АМГ 5,24 (0,74) нг/мл [15]. В качестве диагностических тестов СПКЯ у девушек в возрасте 15–17 лет по результатам нашей работы наиболее перспективным оказалось использование уровня АМГ >7,20 нг/мл и ИСА >2,75, что обладало наибольшей чувствительностью и специфичностью (>75,0% и 89,0–93,0%).
Одним из общепринятых диагностических критериев СПКЯ является поликистозная морфология яичников по данным УЗИ, параметры которого в подростковом возрасте дискутабельны [11]. При этом в работе Григоренко Ю.П. и соавт. (2012–2014) показано, что, по сравнению с трансабдоминальным методом, использование трансректального доступа у девушек позволяет лучше визуализировать яичники и оценить их размеры и фолликулярный аппарат, что существенно помогает в диагностике заболевания [16]. В результате обследования 83 пациенток с СПКЯ в возрасте 14–16 лет установлено, что у девочек с СПКЯ в сравнении со «здоровыми» девочками, кроме увеличения объема яичников, в 3 раза чаще встречается расширение аркуатных вен и сосудов маточного сплетения; в 2,1 раза чаще – гиперваскуляризация стромы яичников. С учетом размеров и расположения фолликулов авторы выделили при СПКЯ у подростков равнокалиберный (57%) и разнокалиберный (43%) типы строения яичников, обусловившие различие гормонального статуса и размеров органов. Авторы указывают, что данный метод с использованием трансректального доступа и возможностью 3D-визуализации яичников обладает рядом преимуществ в диагностике у подростков, однако требует оборудования экспертного класса и не является общедоступным методом скрининга. В нашем исследовании при использовании 2D-ультразвукового сканирования показано, что диагностическим критерием СПКЯ в возрасте 15–17 лет может служить показатель среднего объема яичников >10,70 см3 и ЯМИ >3,95 с высокой чувствительностью 81,0–83,0% и специфичностью 83,0%. Указанные параметры могут быть рекомендованы к определению в качестве скринингового метода при обследовании подростков для выделения групп риска пациенток для дальнейшего дообследования.
Заключение
Шансы развития СПКЯ у девочки выше в 8,9 раза при наличии неврологических нарушений в периоде новорожденности и младенчества (р=0,0391) и в 4,9 раза – при наличии гинекологической патологии у матери пациентки (р=0,0157). Анамнестическими особенностями девочек-подростков с СПКЯ на фоне метаболических нарушений, в отличие от пациенток без таковых и здоровых девочек, явилось осложненное течение родов у их матерей (р=0,0220).
При 2D-ультразвуковом сканировании из всех предлагаемых при СПКЯ диагностических критериев у подростков в возрасте 15–17 лет наиболее чувствительными (81,0–83,0%) и специфичными (83,0%) оказались показатель среднего объема яичников >10,70 см3 и ЯМИ>3,95.
Наиболее значимыми гормональными показателями СПКЯ в возрасте 15–17 лет оказались уровень АМГ >7,20 нг/мл, ИСА >2,75 нг/мл (чувствительность >75,0% и специфичность 89,0–93,0%), а также Т >1,15 нмоль/л, андростендиона >11,45 нг/мл и соотношение ЛГ/ФСГ >1,23 (чувствительность 63,2–78,2% и специфичность 84,4–93,7%).
Подростки с СПКЯ, в сравнении со здоровыми девочками, характеризуются более высокими показателями ИМТ [ОШ 1,31 (95% ДИ 1,10–1,56), р=0,0021] и ОТ [ОШ 1,11 (95% ДИ 1,01–1,19), р=0,0237], а также более высоким кардиометаболическим риском, согласно ИВО (р=0,0461).



