Задержка роста плода (ЗРП), несмотря на продолжающиеся исследования, остается одной из ведущих проблем современного акушерства и перинатологии. Как известно, гипотеза «фетального происхождения болезней у взрослых» предполагает связь между неоптимальной средой внутриутробного развития плода и последствиями для организма взрослого в виде метаболических, кардиоваскулярных и других осложнений, а именно ожирения, сахарного диабета (СД) 2 типа, атеросклероза и гипертонической болезни [1]. Данная концепция подтверждает идею о том, что питание плода и гормональный статус во время беременности могут необратимо влиять на обмен веществ, приводя к дисфункции β-клеток поджелудочной железы, и изменять инсулиновую чувствительность тканей, формируя тем самым нарушение углеводного обмена уже в постнатальной жизни. Во многих работах показана важная роль в росте и развитии плода и детей гормона роста и инсулиноподобных факторов роста 1 и 2 [2–5]. Также в последнее время значительное внимание уделяется жировой ткани, а именно адипоцитокинам, которые она вырабатывает [4, 6]. Последние включают структурно и функционально разнообразные и высокоактивные пептиды, белки и гормоны, регулирующие гомеостаз глюкозы. Следует отметить, что некоторые из них синтезируются плацентой, что, в свою очередь, указывает на их возможную роль во внутриутробном развитии плода, регуляции его роста и энергетическом обмене.
Интерес представляет изучение роли грелина во время беременности, являющегося пептидным гормоном и преимущественно продуцирующимся эндокринными клетками слизистой оболочки желудочно-кишечного тракта и поджелудочной железы [4]. Экспрессия грелина и его синтез также были обнаружены в плаценте (цитотрофобласте), что подтверждает его роль в течение беременности, однако функции остаются до конца не изученными [7].
Другим гормоном, синтезирующимся адипоцитами и плацентой во время беременности и участвующим в росте и развитии плода, является лептин. Имеются исследования, что при таких осложнениях беременности, как плацентарная недостаточность, преэклампсия и гестационный сахарный диабет, синтез данного адипоцитокина увеличивается [4, 8].
Интерес представляет также изучение роли висфатина во время физиологической беременности и при развитии осложнений. Данный адипоцитокин преимущественно вырабатывается жировой тканью, а именно висцеральным жиром, и может экспрессироваться в плаценте, плодных оболочках, миометрии, макрофагах и нейтрофилах [9]. Следует отметить, что висфатин обладает иммунорегуляторным свойством за счет регуляции про- и противовоспалительной активности цитокинов моноцитами человека и метаболическими свойствами. Связываясь с рецепторами инсулина, при этом не конкурируя с ним, висфатин вызывает инсулинимитирующее действие, стимулирует поглощение глюкозы периферическими тканями и тормозит глюконеогенез в печени [10].
Учитывая различия литературных данных о различных концентрациях адипоцитокинов при осложнениях беременности [2, 4, 11], в том числе и при ЗРП, наше внимание было уделено изучению экспрессии генов висфатина, грелина и лептина в крови матери и плода, а также в плаценте, что может позволить получить новые данные о патогенетических особенностях ЗРП и выявить потенциальные маркеры данного осложнения беременности.
Цель исследования: определить уровень экспрессии генов энергетического метаболизма – висфатина (NAMPT), грелина (GHRL) и лептина (LEP) в материнской и пуповинной крови и в плаценте при ЗРП.
Материалы и методы
Работа выполнялась в ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» (ФГБУ «НМИЦ АГП им. В.И. Кулакова») Министерства здравоохранения Российской Федерации (директор – академик РАН Г.Т. Сухих) и включала 52 беременных женщин. Группу I (основная) составили 27 пациенток с ЗРП; группу II (сравнения) – 25 женщин с физиологически протекающей беременностью без ЗРП по данным клинического обследования и результатам функциональных методов исследования.
Проведение исследования было одобрено на заседании комиссии по этике биомедицинских исследований при ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России 11 ноября 2021 г. (протокол заседания №11).
Диагноз ЗРП на антенатальном этапе был установлен согласно критериям единого консенсусного документа по Дельфийской системе для ранней и поздней форм. Постнатальный диагноз малого или маловесного к сроку гестации плода устанавливался при массо-ростовых показателях новорожденного меньше 10-го процентиля, согласно перцентильным шкалам INTERGROWTH-21 для доношенных и недоношенных детей.
Критериями включения беременных в исследование являлись: срок беременности 22–40 недель, возраст беременных от 18 до 49 лет, одноплодная беременность, осложнившаяся ЗРП (основная группа), физиологически протекающая беременность (группа сравнения), подписанное информированное добровольное согласие на участие в исследовании.
Критерии невключения для обеих групп: многоплодная беременность, использование донорской яйцеклетки, тяжелая экстрагенитальная патология (СД I типа и другие), антифосфолипидный синдром, острые инфекционные и генетические (сбалансированные хромосомные перестройки) заболевания беременной женщины, пороки развития, гемолитическая болезнь плода.
Для определения уровня экспрессии генов в крови образцы венозной крови беременных женщин и венозной пуповинной крови, собранные во время родоразрешения, собирались в вакуумные пробирки, содержащие этилендиаминтетрауксусную кислоту (ЭДТА) в объеме 5 мл. Обработка образцов производилась в течение 30 минут после забора биологического материала. К 200 мкл цельной крови добавлялось 200 мкл лизирующегося буфера ExtractRNA («Евроген», Россия), после чего образцы оставляли на хранение при температуре -80°С.
Фрагменты плацентарной ткани из парацентральной зоны, включающие ворсинчатый хорион, размерами 1,0×0,5 см помещали в криопробирку, содержащую раствор RNA later, в течение 10 минут после родоразрешения, после чего хранили при температуре -80°С.
После сбора полной коллекции образцы крови и плаценты размораживались. Выделение тотальной РНК проводилось согласно протоколу производителя методом фенольной экстракции с использованием реагента ExtractRNA («Евроген», Россия). Степень чистоты и концентрация РНК определялись спектрофотометрически на приборе DeNovix (Thermo Fisher, США). Синтез кДНК проводился с использованием набора для постановки обратной транскрипции ОТ-1 («Синтол», Россия) согласно протоколу производителя.
Амплификацию уровня мРНК исследуемых генов (NAMPT, GHRL, LEP) и гена «домашнего хозяйства» HPTR1 проводили методом полимеразной цепной реакции (ПЦР) с детекцией накопления продуктов реакции в режиме реального времени (RealTime PCR) с использованием амплификатора CFX-96 (Bio-Rad, США) и специфических праймеров и зондов к исследуемым участкам генов. Пороговый цикл определяли как среднее арифметическое значение трех повторностей. Последовательности праймеров и зондов представлены в таблице 1.
ПЦР проводили по следующему протоколу: 95° – 5 минут; 40 циклов: 95° – 10 с, 60° – 25 с.
Положительный контроль праймеров проводился на 3 образцах плаценты, которые подтвердили валидность всех 4 праймеров. Для нормализации результатов использовался ген «домашнего хозяйства» HPTR1.
Статистический анализ
Статистическая обработка результатов проводилась при помощи программы Microsoft Excel, OriginPro 8 и SPSS Statistics 17. Проверку гипотезы о нормальном распределении осуществляли, используя критерий Шапиро–Уилка (при числе исследуемых менее 50). При сравнении двух групп по количественному показателю при наличии распределения, отличного от нормального, использовали критерий Манна–Уитни. Описание данных проводилось с помощью медианы (Me), нижнего и верхнего квартилей (Q1; Q3); диаграммы на рисунках представлены в виде процентилей (5; 25; 50; 75; 95). Сравнение качественных параметров проводилось с помощью точного критерия Фишера. Категориальные данные описывались с указанием абсолютных значений и процентных долей (%). Оценку диагностической точности полученных данных проводили с применением ROC-анализа. Определяли площадь под ROC-кривой, чувствительность и специфичность. Показатели диагностической точности рассчитывали путем построения таблиц сопряженности, для каждого показателя рассчитывали 95% ДИ. Для выявления корреляционной связи между переменными рассчитывали коэффициент корреляции Спирмена. Статистически значимыми различия между сравниваемыми величинами признавали при значении p<0,05.
Результаты и обсуждение
Все пациентки, включенные в исследование, были сопоставимы по исходной клинико-анамнестической характеристике (табл. 2).
Возраст беременных колебался от 24 до 46 лет и составил 33 (27; 36) года в основной группе и 32 (30; 35) года в группе сравнения (р=0,94). Массо-ростовые отношения не отклонялись от популяционных норм. Масса тела составила 63 (57,0; 70,5) и 73,8 (62,5; 79,0) кг; рост 162 (160; 164) см и 165 (160; 168) см соответственно по группам (р>0,05).
Принимая во внимание значимость индекса массы тела и нарушения жирового обмена у беременных в некоторых работах и их взаимосвязь с исследуемыми гормонами, были изучены данные характеристики. Индекс массы тела в основной группе составил 23 (22; 28) кг/м2, в группе сравнения – 25 (23,0; 29,5) кг/м2 (р=0,26). Частота встречаемости ожирения I и II степени, а также гестационного СД в изучаемых группах не различалась.
Анализ акушерского анамнеза показал, что в группе I чаще, однако статистически не значимо, встречались ЗРП в анамнезе (6/27, 22,2%) и антенатальная гибель плода (3/27, 11,1%), а также преждевременные роды (6/27, 22,2%).
Течение беременности у пациенток основной группы осложнялось угрозой прерывания беременности на разных сроках беременности и составило 6/27 (22,2%) при р=0,65, развитием хронической (5/27, 18,51%, р=0,6) и гестационной артериальной гипертензии (5/27, 18,51%, р=0,22).
Родоразрешение у пациенток с ЗРП проводилось на сроке 36,5 (34,4; 37,3) недели беременности, в отличие от группы сравнения – 38,3 (37,7; 39,4) недели (р=0,001), что объясняется необходимостью досрочного родоразрешения пациенток в связи с ухудшением состояния плода по данным функциональных методов исследования. Частота преждевременных родов в данной группе составила 14/27 (51,85%) против 2/25 (8%) в группе сравнения, р=0,007.
Дети были рождены с оценкой состояния по шкале Апгар от 5 до 9 баллов. Анализ антропометрических данных показал, что масса тела при рождении у детей основной группы составила 1790 (1327; 2050) г, а детей из группы сравнения – 3320 (3080; 3604) г (р<0,001). Согласно перцентильным шкалам INTERGROWTH-21, процентиль массы тела после рождения составил 1 (1; 2) и 70 (55; 85) соответственно по группам (р<0,001).
При изучении уровня экспрессии генов LEP, NAMPT, GHRL методом ПЦР в реальном времени в материнской крови в обеих группах не было выявлено генной экспрессии LEP.
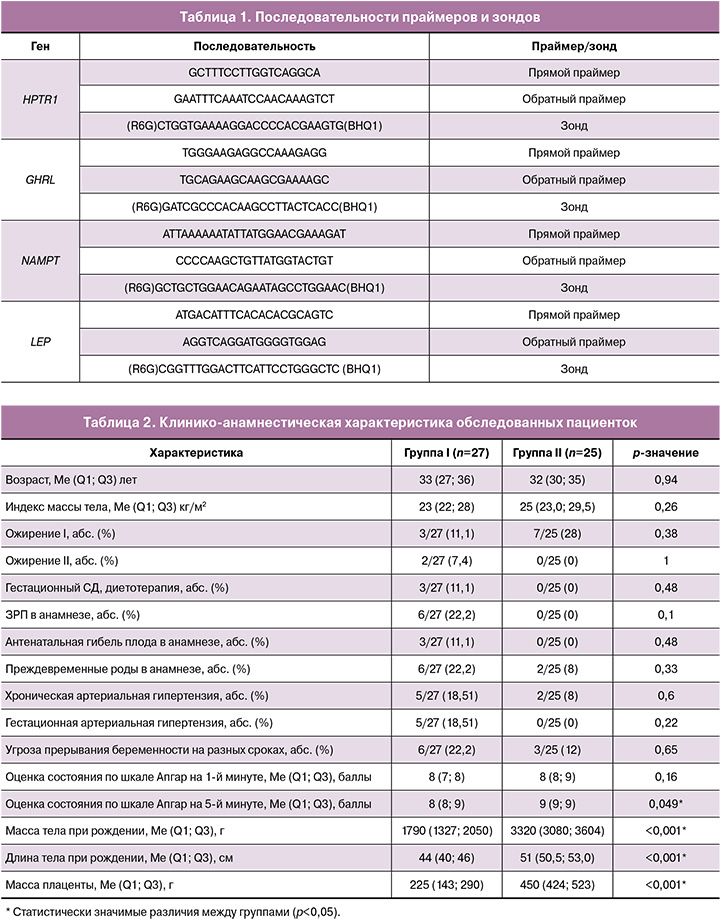
Однако уровень экспрессии генов NAMPT и GHRL в материнской крови был статистически значимо снижен в группе с ЗРП. Так, уровень генной экспрессии GHRL в основной группе составил 1 (0,8; 2,4) отн. ед. и 2,34 (2,06; 2,82) отн. ед. в группе сравнения при р=0,019. Экспрессия NAMPT также была статистически значимо снижена у женщин с ЗРП и составила 1 (0,84; 1,47) отн. ед. и 1,89 (1,23; 2,07) отн. ед. в группе сравнения при р=0,012, что указывает на роль висфатина и грелина в ЗРП (рис. 1).
Как известно, висфатин участвует не только в метаболизме глюкозы и инсулина, но и в выработке про- и противовоспалительных цитокинов, регулируя тем самым иммунитет [12]. Экспрессия висфатина увеличивается при активации иммунной системы, что является важным механизмом обеспечения клеток достаточной энергией за счет инсулиномиметического действия и поглощения клетками глюкозы [13]. Понижение экспрессии висфатина в лейкоцитах можно объяснить сниженной активностью клеток, что может быть связано с подавлением иммунного ответа при ЗРП.
Интерес представляет изучение грелина и его влияния на регуляцию гормона роста и ось гормон роста–инсулиноподобный фактор роста-1. Длительное воздействие грелина повышает их уровень, тем самым способствуя нормальному росту и дифференцировке клеток и тканей плода, а также плаценты [14]. В проведенном нами исследовании отмечено статистически значимое снижение экспрессии гена грелина в крови матери, статистически значимое снижение длины и массы плода при рождении в группе с ЗРП, а также меньший вес плаценты относительно группы сравнения. Описанные результаты подтверждают данные литературы о взаимосвязи между уровнем грелина и осью гормон роста–инсулиноподобный фактор роста-1, однако это требует дальнейшего изучения.
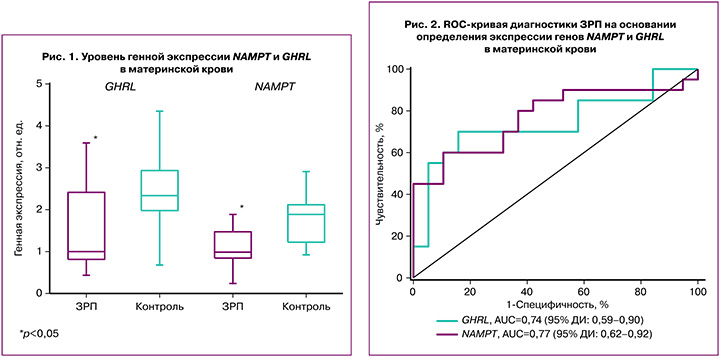
Для определения диагностической значимости генной экспрессии NAMPT и GHRL в материнской крови был проведен ROC-анализ (рис. 2). Установлено, что площадь под ROC-кривой для генной экспрессии грелина составила 0,74 (95% ДИ 0,59–0,90) с пороговым значением 1,27 отн. ед., для которого чувствительность составила 70% и специфичность 84,20% (р=0,02). Прогностическая ценность положительного результата составила 82,35% (95% ДИ 56,57–96,20), а отрицательного результата – 72,73% (95% ДИ 49,78–89,27). Для генной экспрессии висфатина площадь под ROC-кривой составила 0,77 (95% ДИ 0,62–0,92) с пороговым значением 1,01 отн. ед., при котором чувствительность составила 60%, а специфичность 89,40% (р=0,01). Прогностическая ценность положительного результата составила 85,71% (95% ДИ 57,19–98,22), а отрицательного результата – 68,00% (95% ДИ 46,50–85,05). Таким образом, согласно экспертной шкале, оба параметра обладают «хорошей» диагностической ценностью и их можно рассматривать в качестве потенциальных маркеров ЗРП.
Принимая во внимание взаимосвязь различных патологических процессов, происходящих в системе «мать-плацента-плод», мы изучили их экспрессию в пуповинной крови и в плаценте. При анализе генной экспрессии LEP в пуповинной крови не было обнаружено экспрессии в обеих группах. Уровень экспрессии генов NAMPT и GHRL был снижен относительно группы сравнения, однако статистически не значимо. Так, уровень экспрессии NAMPT в основной группе составил 1 (0,29; 1,99) отн. ед., а в группе сравнения – 1,36 (0,7; 2,4) отн. ед. при р=0,30; уровень экспрессии GHRL: 0,96 (0,45; 1,64) и 1,52 (1,10; 1,77) отн. ед. при р=0,23 соответственно (рис. 3).
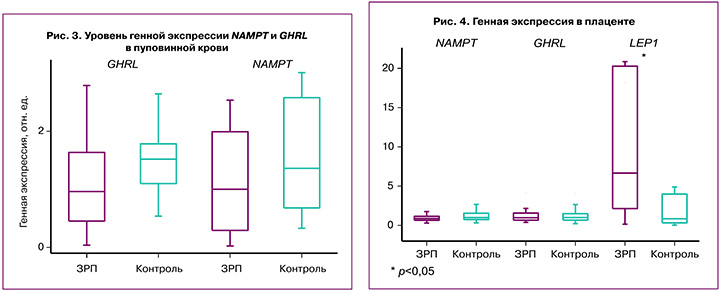
Особый интерес представляет изучение экспрессии генов в плаценте, которая во время беременности является не только их источником, но и экспрессирует гены в зависимости от осложнений беременности. Так, определение уровня экспрессии генов NAMPT и GHRL в плаценте не показало статистически значимых результатов, а их уровень был одинаков в исследуемых группах. При этом уровень NAMPT в основной группе составил 0,87 (0,65; 1,13) и 1 (0,75; 1,44) отн. ед. в группе сравнения при р=0,24, а GHRL – 0,97 (0,67; 1,56) и 1 (0,68; 1,36) отн. ед. соответственно при р=0,57 (рис. 4).
Изучая экспрессию гена LEP в плаценте, нами было установлено, что уровень его экспрессии статистически значимо повышен в основной группе и составляет 5,6 (1,64; 18,8) отн. ед. и 1 (0,36; 4,28) отн. ед. в группе сравнения при р=0,045 (рис. 4).
Согласно литературным данным, уровень лептина коррелирует с индексом массы тела [15]. В нашем исследовании для определения связи между уровнем экспрессии гена лептина в плаценте и весом новорожденного был проведен корреляционный анализ. Оценив уровень экспрессии гена лептина в плаценте в основной группе пациентов, нами была выявлена обратная корреляционная связь между уровнем экспрессии LEP и весом плода при рождении (коэффициент корреляции Спирмена составил -0,53 при р=0,01). При этом при проведении корреляционного анализа в группе сравнения статистически значимой корреляционной связи получено не было (коэффициент корреляции Спирмена 0,27 при р=0,17).
Чтобы убедиться, что уровень генной экспрессии лептина при ЗРП зависит от веса новорожденного, а не от срока родоразрешения, мы провели корреляционный анализ между уровнем LEP и сроком родоразрешения. Так, статистически значимой корреляции между изучаемыми параметрами выявлено не было (коэффициент корреляции Спирмена составил -0,24 при р=0,17).
Таким образом, у пациенток с наименьшим весом новорожденного экспрессия гена лептина в плаценте была значительно выше (р<0,05). При этом данные различия не были связаны со сроком гестации на момент родоразрешения. Можно сделать предположение о том, что наибольшая экспрессия LEP в плаценте указывает на большее внутриутробное страдание плода.
Согласно данным литературы, лептин, синтезируемый в клетках трофобласта, оказывает митогенное и антиапоптотическое действие, регулирует рост и развитие плода, стимулируя такие сигнальные пути, как JAK/STAT, MAPK и PI3K [8, 16]. Предыдущие исследования показали, что лептин является модулятором эндокринной функции плаценты, которая является важным источником материнского циркулирующего лептина. В исследовании, проведенном Stefaniak M. и Dmoch-Gajzlerska E. [17], авторы делают заключение о возможном компенсаторном механизме, с помощью которого малые для гестационного срока плаценты производят больше лептина. Кроме того, связь с массой новорожденного и уровнем лептина в пуповинной крови была обнаружена при ЗРП в исследовании Karakosta P. et al. [18], которое показало отрицательную корреляцию между данными параметрами. Несмотря на то что роль лептина как фактора роста до рождения остается неопределенной, повышенная экспрессия лептина в плаценте позволяет сделать предположение о физиологическом значении лептина в жизни плода. Изменение внутриутробного синтеза может сигнализировать об изменении в доступности питательных веществ, следовательно, может играть важную роль в контроле глюконеогенеза и созревания тканей плода, а также в установлении нервных путей, важных для энергетического баланса в дальнейшей жизни новорожденного.
Полученные нами данные подтверждают данные литературы [8, 16] о том, что плацента является основным источником лептина во время беременности и, по всей видимости, меняет уровень экспрессии во время ЗРП в пользу его увеличения.
Заключение
Определение уровней экспрессии генов висфатина, грелина и лептина в материнской крови и в плаценте при ЗРП способствует пониманию механизмов развития данной патологии и обеспечивает разработку новых методов ее диагностики.
Так, нами было показано, что уровень экспрессии генов NAMPT и GHRL в материнской крови был статистически значимо снижен при ЗРП, что может стать объективным маркером диагностики данного состояния во время беременности.
Определение уровня экспрессии LEP в плаценте подтверждает данные о том, что плацента является основным источником данного адипоцитокина во время беременности. Обратная взаимосвязь между повышенным уровнем экспрессии лептина и весом новорожденного указывает на большее внутриутробное страдание плода и подтверждает его роль в регуляции роста плода.
Следует отметить необходимость дальнейшего углубленного исследования с корреляционным анализом концентрации изучаемых адипоцитокинов в материнской и пуповинной крови и профиля метилирования ДНК в плаценте для уточнения патогенетических механизмов формирования ЗРП.



