Синдром поликистозных яичников (СПКЯ) – одно из наиболее частых гормонально-ассоциированных нарушений функции репродуктивной системы; на его долю приходится около 75–80% всех случаев ановуляторного бесплодия [1, 2]. Распространенность СПКЯ варьирует от 6 до 21% в зависимости от используемых диагностических критериев и исследуемой популяции [3, 4].
Многие клиницисты при лечении бесплодия фокусируются на использовании вспомогательных репродуктивных технологий, а не на медикаментозной индукции овуляции (ИО). Вместе с тем высокая стоимость программ экстракорпорального оплодотворения, повышенный риск гиперстимуляции яичников и многоплодной беременности не позволяют рассматривать этот метод лечения в качестве ведущего. В соответствии с Российскими клиническими рекомендациями первой линией ИО при СПКЯ является применение блокатора эстрогеновых рецепторов – кломифена цитрата (КЦ) [5]. В 2018 г. в качестве альтернативы КЦ в международные клинические рекомендации был включен летрозол (ЛТ) как препарат первой линии для ИО при СПКЯ, поскольку его эффективность примерно в 1,5 раза превышает аналогичные показатели на КЦ [3, 6, 7]. Хотя безопасность применения ЛТ, как ИО, была доказана в большом числе крупных научных исследованиях, ЛТ пока отнесен к группе препаратов «off-lable» (англ.: off – за пределами, label – этикетка, инструкция) и, согласно Российским клиническим рекомендациям, может быть рекомендован к применению только после подписания информированного добровольного согласия [5, 8–10]. ЛТ, как и КЦ, обладает антиэстрогенной активностью, хотя механизм его действия иной. Вследствие ингибирования ароматазы и снижения конверсии андрогенов в эстрогены, по отрицательной обратной связи, повышается секреция фолликулостимулирующего гормона (ФСГ) и, как следствие, происходит активация роста фолликулов. Считается также, что ассоциированное с ЛТ накопление внутрияичниковых андрогенов может повышать чувствительность фолликулов к ФСГ, стимулировать инсулиноподобный фактор роста-1, что может оказывать позитивное влияние на фолликулогенез [11, 12 ].
Высокая частота кломифен-резистентности послужила поводом к поиску новых подходов к ИО в виде модификации протоколов стимуляции. Помимо комбинации КЦ и метформина, был предложен так называемый «ступенчатый» протокол, в рамках которого после неэффективной стимуляции КЦ в дозе 50 мг проводилось удвоение дозы препарата без индукции менструации [13]. Немногочисленные исследования показали, что применение «ступенчатого» протокола позволяет сократить время до наступления овуляции по сравнению со стандартным протоколом, а по некоторым данным, дает возможность повысить частоту овуляции и беременности [14–18]. В последние годы были опубликованы несколько статей с неоднозначными результатами по использованию «ступенчатого» протокола ИО ЛТ при СПКЯ. Так, в одном из исследований были получены данные об увеличении частоты овуляции и беременности [19], в другом исследовании существенных различий выявлено не было [20]. Исходя из этого, для оптимизации схем терапии ановуляторного бесплодия при СПКЯ было запланировано и проведено данное исследование.
Цель исследования: сравнение эффективности и частоты побочных эффектов при проведении «ступенчатого» и стандартного протоколов ИО ЛТ у пациенток с СПКЯ.
Материалы и методы
В проспективное рандомизированное исследование были включены 194 женщины с СПКЯ и ановуляторным бесплодием (возраст 28,7 (25; 33) года; индекс массы тела (ИМТ) 21,5 (21; 26) кг/м²). Диагноз СПКЯ был установлен в соответствии с Роттердамскими критериями (2003) [21].
Отбор пациенток проводился в соответствии с критериями включения (возраст от 18 до 35 лет; ИМТ от 18,5 до 40 кг/м²) и критериями исключения (трубно-перитонеальный и мужской факторы бесплодия; эндокринные заболевания; тяжелые соматические заболевания; врожденные пороки развития половых органов, ИО и прием комбинированных оральных контрацептивов в течение последних 3 месяцев).
Перед началом исследования всем пациенткам на 2–3-й день менструального цикла была проведена оценка гормонального профиля, включающая определение уровней: антимюллерова гормона (АМГ); лютеинизирующего (ЛГ) и ФСГ; тиреотропного гормона (ТТГ); пролактина; общего и свободного тестостерона; андростендиона; глобулина, связывающего половые гормоны (ГСПГ).
Ультразвуковое исследование (УЗИ) органов малого таза проводили на аппарате 2000 Toshiba SSA-240 (Япония) трансвагинальным конвексным датчиком 7,5 Мгц; определяли объем яичников и подсчитывали число антральных фолликулов в них. Фолликулярный «ответ» оценивали на 14-й день цикла. При наличии доминантного фолликула более 10 мм через 7 дней проводили ультразвуковой контроль овуляции и измеряли толщину эндометрия; также определяли уровень прогестерона в сыворотке крови. Беременность диагностировалась определением β-субьединицы хорионического гонадотропина (ХГЧ) человека в сыворотке крови через 14 дней после овуляции.
С целью ИО исходно все женщины получали ЛТ (препарат «Фемара» 2,5 мг, Novartis) в дозе 2,5 мг/сутки с 3-го по 7-й день спонтанного или индуцированного микронизированным прогестероном менструального цикла. По результатам фолликулометрии в 88/194 (45,4%) случаев размеры фолликула превышали 10 мм, и эти пациентки не были включены в дальнейшее исследование. Не «ответившие» на стартовую дозу ЛТ 106/194 (54,6%) женщин были случайным образом разделены на 2 группы в зависимости от используемого протокола стимуляции: 1-ю группу составили 52 пациентки, которым был предложен «ступенчатый» протокол, 2-ю группу – 54 пациентки, которым ИО проводилась по стандартному протоколу. Для случайного распределения участниц исследования в группы использовалась простая рандомизация методом конвертов. Процедуры ослепления в данном исследовании не проводилось.
В 1-й группе при отсутствии доминантного фолликула на 14-й день цикла ЛТ назначали в удвоенной дозе (5 мг) в течение 5 дней без индуцированного менструального кровотечения. Через 7 дней после завершения приема препарата проводили повторное УЗИ органов малого таза с оценкой толщины эндометрия, функции яичников, уровня прогестерона (рисунок, схема А). Во 2-й группе (стандартный протокол) при отсутствии доминантного фолликула на 14-й день цикла, признаков овуляции по результатам уровня прогестерона (менее 3 нг/мл) и УЗИ органов малого таза через 7 дней (21-й день цикла), в последующем менструальном цикле, индуцированном микронизированным прогестероном (300 мг/сут), доза ЛТ увеличивалась до 5 мг/сут с 3-го по 7-й день цикла (рисунок, схема Б). Предположительное время до овуляции считалось от 1-го дня менструального цикла до определения уровня прогестерона. Максимальная длительность ИО не превышала 6 циклов, доза ЛТ – 7,5 мг. В качестве клинических исходов оценивались: частота овуляции, среднее время до наступления овуляции, частота наступления беременности и живорождения, частота многоплодной беременности, толщина эндометрия.

Исследование было выполнено на базе отделения гинекологической эндокринологии ФГБУ «Национального медицинского исследовательского центра акушерства, гинекологии и перинатологии им. В.И. Кулакова» Минздрава России, было одобрено локальным этическим комитетом; все пациентки подписали информированное согласие на участие в исследовании.
Статистический анализ
Статистический анализ проводился с использованием программы IBM SPSS Statistics v.26 (IBM Corporation). Для определения нормальности распределения использовался критерий Колмогорова–Смирнова, а также показатели асимметрии и эксцесса. Описание количественных данных, имеющих нормальное распределение, представлено как среднее арифметическое (М) и (SD) стандартное отклонение. При распределении, отличающемся от нормального, методы описательной статистики были представлены в виде медианы (Me) и квартилей (Q1; Q3). Номинальные данные описываются с указанием абсолютных значений и процентных долей. Для обработки и сравнения данных в двух группах применяли следующие методы: параметрический – t-критерий Стьюдента, непараметрический метод – U-критерий Maнна–Уитни, для качественных номинальных данных критерий Фишера. В качестве оценок эффекта при сравнении групп использовались относительный риск с соответствующим 95% доверительным интервалом (95% ДИ) в отношении бинарных исходов, разница между средними с соответствующим 95% ДИ и разница между медианами с соответствующим 95% ДИ, оцененным с использованием непараметрического бутстрапа (B=9999).
В отношении всех изучаемых исходов тестировались гипотезы превосходства. Процедуры ослепления в данном исследовании не проводилось. Различия считали статистически значимыми при p<0,05. Расчет объема выборки исследования не проводился, так как оно являлось пилотным, и в литературе не было найдено данных, которые позволили бы оценить ожидаемый эффект.
Результаты
Клинико-лабораторные данные исходного обследования пациенток обеих групп представлены в таблице 1. Пациентки были сопоставимы по всем основным показателям (р>0,05).
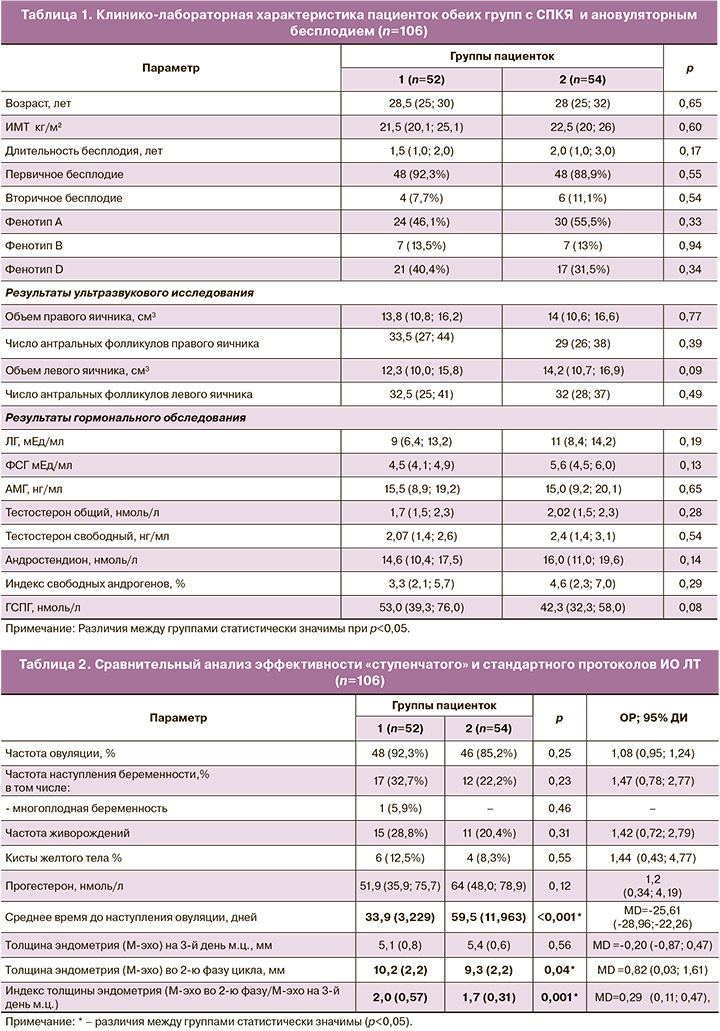
Проведенный анализ показал, что частота распределения фенотипов в обеих группах была схожей: в каждом 2-м случае был диагностирован классический фенотип А, примерно в каждом 3-м – неандрогенный фенотип Д; значительно реже отмечали фенотип В; пациентки с овуляторным фенотипом С в исследовании не принимали участия. Избыточную массу тела имели 14/52 (26,9%) пациенток из 1-й группы и 18/54 (33,3%) – из 2-й группы; ожирение I степени было в каждой из групп у 2 женщин (3,8 и 3,7% соответственно; p=0,47; p=0,97). Клиническая гиперандрогения диагностирована в 25/52 (48%) случаях в 1-й группе и в 27/54 (50%) – во 2-й группе (p=0,84). Нарушения менструального цикла отмечались у всех пациенток: в 1-й группе по типу первичной олигоменореи – у 38/52 (73,1%), по типу вторичной – у 12/52 (23,1%), по типу вторичной аменореи – у 2/52 (3,8%); во 2-й группе эти показатели составили – 45/54 (83,3%), 5/54 (9,3%) и 4/54 (7,4%), соответственно (р=0,10; р=0,12; р=0,42).
Средняя длительность бесплодия в 1-й группе составила 1,5 (1,0; 2,0) года, во 2-й – 2,0 (1,0; 3,0) года (р=0,17). У пациенток с вторичным бесплодием беременности наступили самостоятельно: в 2 случаях было выполнено прерывание беременности на ранних сроках; в 4 – в анамнезе были неразвивающиеся беременности в сроке до 12 недель, в 4 – беременности закончились самопроизвольными родами.
Как видно из данных таблицы 2, частота овуляции в ответ на 5 мг ЛТ была высокой и существенно не различалась в обеих группах (p=0,25; ОР=1,08 (95% ДИ 0,95; 1,24). Однако промежуток времени до наступления овуляции на «ступенчатом» протоколе был почти в 2 раза короче, чем на стандартном протоколе (33,9 (3,229) против 59,5 (11,963); MD=-25,61 (95% ДИ -28,96; -22,26), р<0,001). В этой же группе средний показатель толщины эндометрия во 2-ю фазу цикла был статистически значимо больше, чем во 2-й группе (MD=0,82 (95% ДИ 0,03; 1,61), p=0,04), как и индекс толщины эндометрия (2,0 (0,57) против 1,7 (0,31); MD =0,29 (95% ДИ 0,11; 0,47), р<0,001). В обеих группах не было выявлено случаев «тонкого» эндометрия (менее 7 мм). Уровень прогестерона менее 10 нг/мл был в 5/48 (10,4%) случаях в 1-й группе, и в 4/46 (8,7%) – во 2-й (р=0,77; ОР=1,2 (95% ДИ 0,34; 4,19)). Кисты желтого тела наблюдались примерно у каждой 10-й пациентки, статистических различий между группами не установлено (р=0,55; ОР=1,44 (95% ДИ 0,43; 4,77)). Размер кист варьировал от 3 до 4,5 см; они самостоятельно регрессировали в течение 1–2 последующих циклов. Ни в одной из групп на фоне ИО ЛТ не было зафиксировано синдрома гиперстимуляции яичников. Все пациентки хорошо переносили лекарственный препарат. Отсутствие овуляции в течение 3 циклов стимуляции при достижении максимальной дозы препарата (7,5 мг), расценивалось, как резистентность к ЛТ, она наблюдалась у 3 пациенток: 1/52 (1,9%) из 1-й группы и 2/54 (3,7%) – из 2-й группы (р=0,53; ОР=0,52 (95% ДИ 0,05; 5,55)).
Как видно из данных таблицы 2, в 1-й группе частота наступления беременности была почти в 1,5 раза выше, чем во 2-й группе, но разница не достигла статистической значимости (р=0,23; ОР=1,47 (95% ДИ 0,78; 2,77)). Биохимическая беременность диагностирована в 2/17 (11,8%) случаях в 1 группе; во 2 группе был 1/12 (8,3%) случай неразвивающейся беременности в сроке до 12 недель. В 1-й группе в 1/17 (5,9%) случае была установлена многоплодная беременность (p=0,46). Частота живорождения в обеих группах была сопоставима: в 1-й группе – 15/52 (28,8%), во 2-й группе – 11/54 (20,4%) (р=0,31; ОР=1,42 (95% ДИ 0,72; 2,79).
Анализ акушерских осложнений показал, что гестационный сахарный диабет был диагностирован у 3/15 (20 %) пациенток из 1-й группы и у 2/11 (18,1%) из 2-й группы (р=0,90; ОР=1,10 (95% ДИ 0,22; 5,51), гестационная артериальная гипертензия была у 1/15 (6,7%) пациентки из 1-й группы, преждевременные роды в сроке от 34–36 недель – у 2/15 (13,3%) из 1-й группы и у 1/11 (9,1%) из 2-й группы (р=0,73; ОР=1,47 (95% ДИ 0,15; 14,21). В 1-й группе 3/15 (20%) женщины и 4/11 (36,7%) – во 2-й группе были родоразрешены путем операции кесарева сечения (р=0,35; ОР=0,55 (95% ДИ 0,15; 1,97). Из них в 1 случае операция была произведена по поводу многоплодной беременности, в 3 случаях – по поводу тазового предлежания, в 2 случаях по поводу гипоксии плода в родах и в 1 случае – офтальмологические показания. Медианный вес детей при рождении составил в 1-й группе – 3400 (3135; 3625) г, во 2-й группе – 3340 (3330; 3545) г (разница между медианами=60 (95% ДИ -350; 237), p=0,83). Оценка по шкале Апгар на 1-й минуте в обеих группах составила 8,6 (1,2) против 8,2 (1,3) (MD=0,4 (95% ДИ -0,64; 1,44), p=0,43) и на 5-й минуте 9,3 (0,6) против 9,3 (0,6) (MD =0,2 (95% ДИ -0,21; 0,61), р=0,32).
Обсуждение
Среди больных с хронической ановуляцией 2 типа (по классификации ВОЗ) примерно 90% составляют пациентки с СПКЯ [2]. С 2008 г. для лечения ановуляторного бесплодия при СПКЯ используется «трехэтапный» подход [22]. В качестве терапии первой линии рекомендуются непрямые индукторы овуляции (ЛТ, КЦ), в качестве терапии второй линии – гонадотропины или лапароскопический дриллинг яичников, третья линия – вспомогательные репродуктивные технологии. Некоторые из этих методов лечения зачастую требуют длительного времени до проявления терапевтического эффекта, высокую стоимость, высокий риск синдрома гиперстимуляции яичников и многоплодной беременности, а некоторые – сопряжены с рисками хирургических осложнений. В результате поиска эффективных схем терапии ановуляторного бесплодия более десяти лет назад американскими учеными был разработан и применен в клинической практике «ступенчатый» протокол ИО КЦ, который позволил повысить частоту овуляции и снизить время до ее достижения [13]. Авторы сделали вывод, что нет необходимости в индукции менструации перед увеличением дозы КЦ у пациенток не «ответивших» на начальную дозу индуктора овуляции. В 2019 г. Thomas S.et al. был проведен сравнительный анализ эффективности КЦ и ЛТ, которые применялись без индукции менструального кровотечения у пациенток резистентных к КЦ. Были выявлены преимущества ЛТ, по сравнению с КЦ в виде меньшего времени до достижения овуляции, тогда как частота овуляции и беременности практически не различались [19]. Вместе с тем, в более позднем аналогичном по дизайну исследовании, применение ЛТ статистически значимо чаще вызывало овуляцию, наступление беременности и приводило к большей частоте живорождений, по сравнению с КЦ [20]. В отечественной литературе представлено лишь несколько публикаций по эффективности стандартного протокола ИО ЛТ [23, 24]. Все это послужило основанием для проведения данного исследования, направленного на оптимизацию лечения ановуляторного бесплодия при СПКЯ.
Результаты, полученные в ходе данного исследования, показали, что в каждом втором случае нет овуляции на начальную дозу ЛТ в 2,5 мг, на дозу в 5 мг она была в 2 раза выше и составила на «ступенчатом» протоколе 92,3%, на стандартном – 85,2%. Частота овуляции оказалась даже более высокой, чем в одном из наиболее крупных многоцентровых исследований по изучению эффективности ЛТ, в котором она составила 61,7% [6]. Возможно, это связано с различиями в ИМТ, поскольку в проведенном нами исследовании практически отсутствовали женщины с ожирением. Показатели овуляции на «ступенчатом» протоколе оказались сопоставимыми с таковыми в исследованиях, где применялась комбинация ЛТ с метформином и использовался ХГЧ, как триггер овуляции [19, 20]. Несмотря на отсутствие различий по частоте овуляции, промежуток времени до ее наступления при использовании «ступенчатого» протокола был почти в 2 раза короче (33,9 (3,23) и 59,5 (11,96) дней, р=0,04). С учетом того, что женщины с бесплодием в 23–54% случаев страдают тревожными и депрессивными расстройствами, можно полагать, что уменьшение длительности лечения и времени ожидания результатов ИО способствуют снижению частоты данных расстройств и повышению качества жизни пациенток с СПКЯ [25].
Согласно полученным данным, ЛТ не оказывает негативного влияния на эндометрий; об этом свидетельствует отсутствие случаев «тонкого» эндометрия. Следует также отметить, что средний показатель М-эхо во 2-ю фазу цикла был больше на «ступенчатом» протоколе, чем на стандартном. Более значительная разница была выявлена при сравнении такого показателя, как индекс толщины эндометрия: в 1-й группе он составил 2,0 (0,7) и во 2-й группе – 1,6 (0,5) (р=0,01). Проведенные ранее исследования показали, что уровни экспрессии интегрина αvβ3, L-селектина, фактора ингибирования лейкемии и образование пиноподий в эпителиальных и стромальных клетках эндометрия были значительно выше у пациенток, принимающих ЛТ, по сравнению с КЦ, что оказывает положительное влияние на частоту наступления беременности и ее течение [26, 27].
На фоне ИО частота наступления беременности была сопоставима в обеих группах (32,7% против 22,2%, р=0,23); возможно, отсутствие статистической разницы может быть связано с относительно небольшим объемом выборки. В литературе обсуждается возможность негативного влияния менструального кровотечения, индуцированного гестагенами, перед проведением ИО у пациенток с СПКЯ, которое может реализовываться за счет воздействия на гипоталамо-гипофизарно-яичниковую ось, влияния на структуру и рецептивность эндометрия, что может снижать вероятность зачатия, а возможно, и живорождений [28, 29]. Стоит также отметить, что в исследовании S. Thomas et al. частота наступления беременности на «ступенчатом» протоколе с применением ЛТ была вдвое меньше, по сравнению с полученными нами результатами. Столь существенная разница связана с тем, что в исследование были включены женщины более старшего репродуктивного возраста, резистентные к КЦ, с более высоким ИМТ (ИМТ 30,9 (4,7) кг/м2) [19]. Частота акушерских осложнений была сопоставима с заявленными в литературе данными [30].
Заключение
Таким образом, удвоение дозы ЛТ двукратно повышает частоту овуляции по сравнению с начальной дозой в 2,5 мг у пациенток с ановуляторным бесплодием и СПКЯ. Применение «ступенчатого» протокола можно рекомендовать как эффективный и безопасный подход к ИО, позволяющий сократить промежуток времени до наступления овуляции и увеличить толщину, без увеличения риска синдрома гиперстимуляции яичников и многоплодной беременности.



