Объективный рост частоты рака тела матки, почти каждый десятый случай которого приходится на женщин в возрасте до 40 лет, обосновывает необходимость интенсивного развития профилактического направления, заключающегося в грамотном ведении больных с гиперплазией
эндометрия (ГЭ). Однако до настоящего времени нет объективных предикторов возникновения ГЭ
и разнонаправленности ее развития – от спонтанной регрессии, варьирующей от 20 до 50% [7,
16], до прогрессии в аденокарциному, которая при атипической ГЭ (АГЭ) достигает 40–50% [23, 27].
Очевидно, что в развитии ГЭ играют роль многочисленные факторы, вклад которых в прогнозирование возникновения заболевания и прогрессирование процесса клиницисту трудно оценить, а это затрудняет объективизацию выбора тактики ведения больных. Для женщин репродуктивного возраста решение данной проблемы возможно не за счет расширения показаний к оперативному лечению, а путем развития органосохраняющего направления. Не зная точных механизмов развития процесса и его генетической обусловленности, невозможно предложить патогенетические подходы к терапии. Этим можно объяснить отсутствие единых рекомендаций по выбору лекарственного средства, дозе и оптимальной длительности его применения, которая часто является неадекватной, в связи с чем приходится сталкиваться с рецидивами ГЭ. В связи с этим не менее важными представляются вопросы разработки долгосрочной программы ведения больных, направленной на профилактику рецидивов ГЭ и маточных кровотечений.
Принимая во внимание определяющую роль избыточного влияния эстрогенов и дефицита прогестерона, стандартной терапией ГЭ можно считать назначение прогестагенов, обладающих прогестагенной и антиэстрогенной активностью. Сравнительная оценка различных режимов назначения прогестагенов указывает на более высокую эффективность пролонгированного режима терапии [15, 16, 24, 26]. Однако длительное системное применение прогестагенов, необходимое для
достижения и поддержания лечебного эффекта, часто ограничено возникновением или усугублением метаболических нарушений. Это обосновывает важность дальнейшего поиска эффективных и безопасных способов лечения ГЭ.
В последние годы во многих странах активно внедряется в клиническую практику способ терапии ГЭ путем внутриматочного воздействия левоноргестрела (ЛНГ). Этот метод обеспечивает достаточно высокую концентрацию ЛНГ в эндометрии (в 100–500 раз более высокую, чем при пероральном его назначении), более низкую в миометрии и лишь незначительную в сыворотке крови, что позволяет минимизировать возникновение нежелательных системных воздействий и достигнуть высокой эффективности прогестагенного влияния на матку [20,21]. Однако публикации по применению ЛНГ-внутриматочной системы (ВМС) при ГЭ основаны на небольшом числе клинических наблюдений и отражают в основном результаты влияния гормональной рилизинг-системы на морфологию эндометрия [5, 15, 16, 26]. В связи с этим многие аспекты, касающиеся возможностей применения ЛНГ-ВМС при различных формах ГЭ, требуют уточнения.
Целью данного исследования явилась клинико-морфологическая оценка эффективности внутриматочного воздействия ЛНГ при различных формах ГЭ.
Материал и методы исследованияŠ
„ ‰Проведено клинико-лабораторное обследование и лечение 128 больных с ГЭ, средний возраст которых составил 40,1±6,82 года, средний индекс массы тела (ИМТ) – 28,3±7,0 кг/м²; 62,5% из них
находились в репродуктивном возрасте, остальные – в пременопаузе.
Согласно классификации ВОЗ, у 77 больных была диагностирована простая ГЭ (ПГЭ), у 30 – сложная (СГЭ), у 21 − атипическая (АГЭ). В структуре нарушений менструального цикла доминировала олигоменорея (у 63,3% больных), сменяющаяся менометроррагиями, у 26,5% пациенток отмечались меноррагии, у 4,7% ‒ олигоменорея, у 5,5% больных клинических проявлений ГЭ не наблюдалось. У 69,5% больных ГЭ сочеталась с аденомиозом, у 46,1% ‒ с лейомиомой матки (ЛМ). В 60,1% случаев ГЭ имела рецидивирующий характер, среднее количество произведенных диагностических выскабливаний составило 4,0±0,28. Анализ ранее проведенной терапии показал, что у 40,6% больных с целью лечения ГЭ были использованы комбинированные оральные контрацептивы (КОК), у 80,5% ‒ прогестагены (преимущественно дюфастон и 17-оксипрогестерон капронат, у 46,1% ‒ агонисты гонадолиберина. Высокая частота рецидивов указывает на временный эффект терапии и обосновывает необходимость проведения противорецидивного лечения, которое было включено в протокол исследования.
После гистологической верификации диагноза всем больным с целью лечения ГЭ была введена ЛНГ-ВМС «Мирена», содержащая 52 мг ЛНГ, скорость высвобождения которого составляет в среднем 20 мкг в сутки. Критериями исключения служили противопоказания для введения гормоновыделяющих ВМС (ВОЗ).
Первый, 6-месячный, этап локального воздействия ЛНГ был отнесен к основному курсу лечения, второй, 12-месячный, – к противорецидивному. Влияние основного курса терапии было проанализировано у 124 больных (1 выбыла из исследования в связи с ростом миомы матки, 3 – по причинам, не связанным с осложнениями вследствие применения ЛНГ-ВМС), влияние противорецидивного курса оценено у 93, поскольку 19 пациенткам последующая терапия не проводилась в связи с планируемой беременностью, 9 вступили в менопаузу, а 3 выбыли из исследования по причинам, не связанным с нежелательными эффектами терапии.
Согласно протоколу исследования исходно и на фоне воздействия ЛНГ-ВМС проводился мониторинг клинико-лабораторных показателей: с 3-месячным интервалом оценивали гормональные и эхографические параметры, с 6-месячным – морфологическое состояние эндометрия. Толщину эндометрия измеряли как самую толстую часть в продольном сечении, включая оба слоя эндометрия, структура в яичниках диаметром ≥ 3 см, наполненная жидкостью, трактовалась как киста. Сывороточные уровни фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона
(ЛГ), тестостерона, эстрадиола (E2), тестостеронэстрадиолсвязывающего глобулина (ТЭСГ) определяли хемолюминесцентным иммунологическим методом с применением тест-систем фирмы DPC
(США).
По истечении 6 мес от момента введения ЛНГ- ВМС больным с рецидивирующей ПГЭ, СГЭ и АГЭ производили контрольную гистероскопию и кюретаж эндометрия, при впервые выявленной ПГЭ – вакуумаспирацию эндометрия атравматичными аспирационными кюретками «Pipelle de Cornier» (Франция). Полученные образцы ткани эндометрия подвергались гистологическому исследованию, частично – иммуногистохимическому. Статистическую обработку данных проводили с использованием программы Statistica 6, критериев Вилкоксона, Манна–Уитни, χ2, корреляционного анализа Пирсона.
Результаты исследования и обсуждени冋 ‰ Œ
На фоне терапии оценивали влияние ЛНГ-ВМС на основные гормональные параметры, отражающие функциональное состояние гипофизарно-яичниковой системы. Установлено отсутствие динамики сывороточных уровней гонадотропинов и тестостерона, средние значения последнего до начала терапии составили 1,91±0,18 пмоль/л, после − 1,76±0,14 (р>0,05). На фоне терапии существенно не менялся средний уровень ТЭСГ: до лечения он составил 48,7±3,64 нмоль/л, после − 44,8±2,92 нмоль/л (р>0,05). Исследования показали, что на фоне воздействия ЛНГ-ВМС нормализуются исходно высокие уровни E2: через 3 мес от начала терапии среднее содержание E2 в сыворотке крови понизилось с 432,4±43,2 до 354,8±39,4 пмоль/л (р<0,05), через 6 мес – до 328,8±26,4 пмоль/л (р<0,05). На 2-м этапе терапии динамика E2 была не столь выраженной, однако через 12 мес средний уровень данного
показателя составил 261,6±23,3 пмоль/л и был достоверно ниже, чем после 1-го этапа применения
ЛНГ-ВМС (р<0,05).
Известно, что высокие уровни E2 могут отражать аномальный рост фолликулов. Подобная закономерность прослеживалась и на фоне воздействия ЛНГ-ВМС в виде взаимосвязи повышенного
содержания E2 с наличием и диаметром функциональных образований в яичниках. До введения ЛНГ-ВМС функциональные образования у 17 (13,3%) больных носили характер персистирующих фолликулов диаметром от 2 до 3 см, у 15 (11,7%) ‒ были верифицированы как кисты, средний диаметр которых составил 4,06±0,39 см. В 8 случаях диаметр кист колебался от 3 до 4 см, в 4 − от 4 до 5 см, в 3 − был более 5 см. Во всех случаях функциональные образования в яичниках протекали бессимптомно и самостоятельно редуцировались через 3 мес от момента их возникновения у 80% больных, а через 6 мес – у 100%. Однако исчезновение кист у одних больных сопровождалось их возникновением у других. В связи с этим через 3 и 6 мес от начала лечения частота функциональных образований в яичниках существенно не изменилась, они выявлялись примерно у каждой 3-й больной с ГЭ и в равных долях представляли собой персистирующие фолликулы и кисты. После 6 мес противорецидивного этапа применения ЛНГ-ВМС частота функциональных образований в яичниках оставалась прежней, тогда как после 12 мес фолликулярные кисты не были диагностированы ни у одной больной, а частота персистирующих фолликулов составила 12,5%. При наличии последних уровни E2 оказались
более высокими, чем при фолликулярных кистах, эту закономерность подтверждает отрицательная
корреляционная зависимость между диаметром функциональных образований и содержанием
E2 (r=−0,488). Формирование кист в яичниках не зависело от возраста больных, тогда как частота персистирующих фолликулов, обладающих большей гормональной активностью, оказалась более
высокой у больных репродуктивного возраста.
У подавляющего большинства больных на фоне ЛНГ-ВМС отмечались ациклические кровяные выделения из половых путей: в 1-й месяц лечения их частота составила 80,5%, к 6-му месяцу снизилась до 26,5%. Среднее число дней с кровяными выделениями за этот период без применения какой-либо гемостатической терапии сократилось с 16,9±8,18 до 5,4±4,84 и прогрессивно снижалось на фоне последующего 12-месячного использования ЛНГ-ВМС. Оценка карт менструальной кровопотери показала, что к концу основного курса лечения по сравнению с исходными данными среднее значение пикториального числа уменьшилось примерно в 13 раз (со 168,4±34,6 до 14,6±1,92 балла), а к концу противорецидивного курса − в 27 раз (до 6,9±1,03 балла). Проведенный анализ показал, что длительность кровяных выделений, возникающих на фоне воздействия ЛНГ-ВМС, не зависит от наличия внутреннего эндометриоза, ЛМ (в исследование не включали больных с центрипитальным или субмукозным ростом миоматозных узлов), а также толщины эндометрия.
На момент введения ЛНГ-ВМС средняя толщина эндометрия была равна 4,8±0,2 мм и существенно не менялась на протяжении основного курса терапии (через 3 мес − 5,0±0,2 мм и через 6 мес − 4,8±0,1 мм) (р≥0,05). Более детальный анализ показал, что почти у половины больных толщина эндометрия на всех этапах основного курса терапии была менее 5 мм, примерно в 40–45% случаев колебалась от 5 до 10 мм и лишь в единичных случаях исходно и через 3 мес терапии превышала 10 мм. На фоне 12-месячной экспозиции ЛНГ-ВМС, введенной с противорецидивной целью, отмечалась четкая динамика уменьшения срединного М-эхо, его среднее значение достоверно снизилось по отношению к исходному и составило 4,3±0,2 мм (р≤0,05). Установлена положительная корреляционная связь толщины эндометрия с уровнем Е2 и индексом свободных эстрогенов (r=0,505, r=0,439) при отсутствии взаимосвязи с длительностью кровяных выделений и наличием кист в яичниках.
Эхографический мониторинг включал оценку состояния не только эндометрия, но и миометрия. На фоне основного курса терапии не отмечено динамики объема матки, который до начала терапии составил 89,9±4,05 см3, через 3 мес – 83,7±3,89 см3 и через 6 мес − 81,8±3,90 см3 (р≥0,05). К моменту окончания противорецидивного применения ЛНГ-ВМС средний объем матки составил 78,8±3,90 см3 (р≥0,05). Как сказано выше, в каждом втором случае ГЭ сочеталась с бессимптомным течением ЛМ малых размеров. Исследования показали, что 6-месячное применение ЛНГ-ВМС не отражается на средних размерах наибольших миоматозных узлов, диаметр которых до лечения составил 1,91±0,58 см, после 6 мес воздействия ЛНГ-ВМС – 1,84±0,62 см ( р>0,05), тогда как на фоне последующего 12-месячного воздействия он уменьшился до 1,44±0,11 см (р<0,05). Более детальный анализ свидетельствует о разнонаправленном локальном воздействии ЛНГ-ВМС. Так, за 6 мес терапии
диаметр наибольших миоматозных узлов у 40,7% больных существенно не изменился, у 37,3% ‒ уменьшился с 2,31±1,01 до 1,65±0,27 см (р<0,05), у 22% ‒ увеличился с 2,98±0,63 до 3,61±1,12 см
(р<0,05).
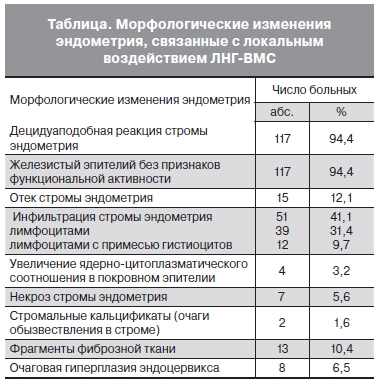
Для оценки эффективности проведенной терапии и понимания особенностей локального воздействия ЛНГ на эндометрий по истечении 6 мес применения ЛНГ-ВМС было проведено гистологическое исследование 124 (96,9%) образцов ткани эндометрия. В 84 (67,7%) случаях (при СГЭ, АГЭ и рецидивирующей ПГЭ) ткань была получена при контрольном раздельном диагностическом выскабливании эндометрия и эндоцервикса, в остальных 40 (32,3%) случаях – путем вакуум-аспирации
эндометрия.
У 118 (95,2%) больных через 6 мес применения ЛНГ-ВМС морфологические признаки ГЭ отсутст вовали, у 6 (4,8%) сохранялись очаги гиперплазированного эндометрия, классифицированные как ПГЭ.
Независимо от формы ГЭ под воздействием ЛНГ-ВМС выявлены однотипные в структурном отношении изменения как в железистом, так и в стромальном компоненте эндометрия, за исключением одного случая, когда после экспульсии ЛНГ-ВМС эндометрий соответствовал стадии пролиферации. В строме эндометрия преобладала децидуаподобная реакция, выражавшаяся в появлении крупных клеток со светлой цитоплазмой, овальным, центрально расположенным ядром, местами встречались клетки веретенообразной формы. В подавляющем большинстве исследуемых образцов отмечалось полнокровие сосудов, при этом они имели вид щелей неправильной формы с преимущественным расположением в поверхностных отделах эндометрия (рис. 1, см. на вклейке). В результате воздействия ЛНГ суживался просвет эндометриальных желез и отмечалось значительное уменьшение их количества, в поверхностных отделах эндометрия железы были более узкими, чем в глубоких, выстилающий эпителий был однорядным кубическим без признаков функциональной активности.
Помимо указанных выше изменений под влиянием ЛНГ-ВМС в эндометрии был выявлен целый ряд других особенностей, которые представлены в таблице. Так, почти в каждом 2-м случае наблюдалась рассеянная и очаговая инфильтрация стромы лимфоцитами, в том числе с примесью гистиоцитов, в каждом 10-м – были обнаружены фиброзные изменения.
Следует отметить, что у больных с остаточными явлениями ГЭ средняя толщина эндометрия была равна 4,9±0,02 см, среднее число дней с кровяными выделениями − 5,6±0,39, средняя частота
функциональных образований в яичниках − 28,6% (2 из 7), в остальной группе эти показатели соответственно составили 5,0±0,03 см, 5,2±2,64 и 31,6% (37 из 117) (р>0,05).
По окончании 2-го этапа применения ЛНГ-ВМС ни в одном образце ткани признаков ГЭ не обнаружено. Следовательно, оправдано проведение более длительного курса терапии.
После 6 мес применения ЛНГ-ВМС получен сопоставимый лечебный эффект у больных репродуктивного и пременопаузального возраста, признаков ГЭ не было соответственно у 95 и 95,5%. Установлено, что эффективность терапии определяется не возрастом больных, а наличием признаков клеточной атипии в железистом компоненте эндометрия. Так, при ПГЭ и СГЭ полный морфологический эффект был достигнут практически у всех больных, при АГЭ − лишь в 76,2% случаев (рис. 2).
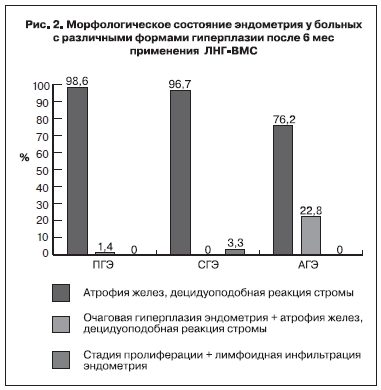
Таким образом, у 23,8% женщин с АГЭ сохранялись очаги ПГЭ, по-видимому, у этого контингента больных период воздействия ЛНГ-ВМС должен быть более длительным или терапия должна быть
комбинированной.
В настоящее время стандартом медикаментозной терапии ГЭ является применение различных
режимов прогестагенов, назначаемых как перорально, так и в виде депоинъекций [7, 14, 18].
Внутриматочное введение ЛНГ имеет определенные преимущества по сравнению с системным
назначением прогестагенов. Во-первых, ЛНГ является более активным прогестагеном, чем натуральный прогестерон и его производные, во-вторых, его концентрация в эндометрии при использовании ЛНГ-ВМС почти в сотни раз превышает таковую в сыворотке крови, что имеет важное значение при
лечении гормонозависимых заболеваний матки [3]. ЛНГ-ВМС исключает необходимость ежедневного
приема лекарственных средств, вместе с тем обеспечивает четкое соблюдение режима дозировки.
Накопленный опыт свидетельствует о высоком контрацептивном и лечебном эффекте ЛНГ-ВМС,
хотя указывает на возможность возникновения нерегулярных кровяных выделений из половых путей [1–3, 14, 22]. Согласно полученным данным, наибольшая частота ациклических кровяных выделений (80,5%) была зарегистрирована в первый месяц после введения ЛНГ-ВМС, с последующим уменьшением их продолжительности и частоты. Среднее число дней с кровяными выделениями за этот период без применения какой-либо гемостатической терапии уменьшилось в 3 раза и после воздействия в течение 6 мес не превышало нормативных значений. Механизмы возникновения кровотечений «прорыва», часто возникающих при непрерывном применении прогестагенов независимо от пути их введения,
до конца не ясны. Наиболее вероятной причиной их появления являются морфологические изменения сосудистого компонента эндометрия, характеризующиеся увеличением объема сосудов, их расширением в поверхностных слоях, с истончением стенок и соответственно увеличением хрупкости
[11, 12, 22]. Эти особенности могут быть обусловлены нарушениями ангиогенеза, о чем свидетельствует увеличение экспрессии в эндометрии адреномедуллина, сосудисто-эндотелиального
и фибробластного фактора роста, возникающее под действием ЛНГ-ВМС [13,19].
Ультразвуковой мониторинг не позволил выявить уменьшения толщины эндометрия на фоне применения ЛНГ-ВМС по сравнению с его исходными значениями, что противоречит данным ряда других авторов [3,17].
Полученные нами данные свидетельствуют об отсутствии снижения сывороточных уровней ЛГ и ФСГ. Несмотря на это, можно согласиться с точкой зрения, что даже низкая концентрация ЛНГ в системном кровотоке способна вызвать нарушения развития фолликулов [9]. Это подтверждают данные о высокой частоте функциональных образований в яичниках, отмеченных примерно у каждой 3–4-й из пролеченных больных. Как сказано выше, все кисты имели бессимптомное течение и в 80% случаев самостоятельно исчезали через 3 мес без проведения какой-либо медикаментозной терапии. Сходная динамика фолликулярных кист, возникающих на фоне воздействия ЛНГ-ВМС, представлена и в других работах, где эти показатели составили 82 и 94% [8].
Среднее содержание Е2 в сыворотке крови больных с функциональными образованиями в яичниках превышало таковое у больных без подобных образований на всех этапах лечения. Данный факт указывает на то, что фолликулярные кисты в яичниках могут быть источником избыточной секреции Е2 эпителиальной выстилкой кисты. Однако высокое содержание ЛНГ в эндометрии обеспечивает протективный эффект в отношении транзиторного воздействия повышенных концентраций Е2 на эндометрий, о чем свидетельствуют данные о высокой эффективности (95,2%) проведенной терапии. Локальный эффект ЛНГ приводит к атрофии железистого компонента и децидуаподобной реакции стромы эндометрия, в ряде случаев сопровождающейся лимфоидно-гистиоцитарной инфильтрацией, очагами обызвествления
и гранулематозной реакцией. Собственные наблюдения, как и большинство приведенных в литературе данных [10, 26], дают основание полагать, что ингибирование пролиферации эндометрия наряду с выраженным снижением экспрессии эстрогеновых и прогестероновых рецепторов можно рассматривать в качестве одного из возможных механизмов реализации прогестагенного влияния ЛНГ-ВМС на эндометрий.
Морфологическое состояние слизистой оболочки матки после курса терапии ЛНГ-ВМС не зависело от толщины эндометрия на момент контрольного обследования, наличия функциональных образований в яичниках и длительности ациклических кровяных выделений. Полученные данные свидетельствуют о том, что эффективность терапии определяется не возрастом больных, а наличием признаков клеточной атипии в железистом компоненте эндометрия. Так, при ПГЭ и СГЭ полный морфологический эффект был достигнут практически у всех больных, при АГЭ − в 76,1% случаев, в остальных образцах сохранялись очаги ПГЭ, которые исчезали после 12-месячного противорецидивного курса внутриматочного воздействия ЛНГ. Немногочисленные данные литературы также свидетельствуют о том, что на фоне воздействия ЛНГ-ВМС при АГЭ можно получить положительный эффект в 50 – 82% случаев [24, 25]. Лечение больных репродуктивного возраста с АГЭ, которым важно сохранить матку, безусловно, заслуживает самого пристального внимания, поскольку, помимо высокого риска малигнизации, имеется вероятность сопутствующей аденокарциномы эндометрия. Так, по данным исследования группы онкогинекологов, в материале, полученном после гистерэктомии, проведенной через небольшой временной промежуток от момента кюретажа, на фоне сложной АГЭ в 42% случаев
выявляется аденокарцинома [23]. Крайне важно на этапе обследования идентифицировать пациенток с высоким риском развития рака эндометрия, что уже возможно благодаря имеющимся на сегодняшний день методикам. Поиск убедительных молекулярно-генетических маркеров развития рака эндометрия на фоне ГЭ продолжается [4, 6].
В целом, результаты, полученные в ходе исследования, позволяют считать оправданным внутриматочное применение ЛНГ в качестве высокоэффективного средства для лечения ПГЭ и СГЭ
и альтернативного – для лечения АГЭ у женщин репродуктивного возраста, заинтересованных в беременности, а также дают возможность рассматривать ЛНГ-ВМС в качестве метода вторичной
профилактики ГЭ.



