Привычный выкидыш (ПВ) – актуальная проблема современного акушерства, требующая проведения дальнейших исследований. Несмотря на совершенствование диагностических подходов, причинные факторы ПВ в 30,0–40,0% случаев остаются неясными. В тех зарубежных клиниках, где иммунологическое исследование не введено в алгоритм обследования супружеских пар, процент идиопатического ПВ достигает 60,0–70,0%. По данным ряда исследователей, до 80,0% ПВ неясного генеза обусловлено нераспознанными иммунологическими нарушениями [1]. Возможно, аллоиммунные нарушения связаны с «неадекватным» распознаванием антигенов отцовского происхождения материнской иммунной системой, что может приводить к последующему отторжению плодного яйца и ранним потерям беременности. Кроме того, аллоиммунные факторы могут быть причиной реализации плацентарной недостаточности, осложняющей вторую половину беременности и приводящей к элективному досрочному родоразрешению. В этой связи разработка оптимальных методов предгестационной подготовки у женщин с ПВ аллоиммунного генеза является исключительно важной задачей.
Процедура иммуноцитотерапии (ИЦТ) – иммунизация женщин аллогенными клетками партнеров – предлагалась в нашей стране для решения проблемы аллоиммунного ПВ в течение 30 лет. Несмотря на столь долгий опыт клинического применения, отсутствует единое мнение о влиянии ИЦТ на клеточное, гуморальное звено иммунной системы, нет четких критериев оценки эффективности проведенных процедур. До сих пор не существует единых рекомендаций о кратности проведения ИЦТ клетками партнера, основанных на сравнении последствий иммунизаций на параметры иммунной системы и клинические исходы.
В этой связи целью настоящего исследования стало изучение влияния кратности иммунизации на уровни антиотцовских антилейкоцитарных антител (АОАТ) и блокирующего эффекта женской сыворотки в процессе предгестационной подготовки женщин с ПВ.
 Материал и методы исследования
Материал и методы исследования
В исследование включены пациентки с ПВ, имеющие в анамнезе две и более спонтанные потери беременности от одного партнера при условии нормального кариотипа у плода. Критериями исключения были аномалии развития матки, особенности кариотипа родителей, наличие инфекционных, аутоиммунных, эндокринных заболеваний, отягощенный аллергоанамнез, тяжелая экстрагенитальная патология, использование ИЦТ для лечения ПВ в течение последних двух лет.
Пациентки были обследованы до назначения лечения, в процессе предгестационной подготовки и в течение наступившей беременности.
Предгестационная подготовка включала полное клинико-лабораторное обследование, терапию воспалительных заболеваний органов малого таза при их выявлении (хронического эндометрита, сальпингита, цервицита, вагинита), контрольные анализы и ультразвуковые исследования. У всех пациенток, включенных в исследование, толщина эндометрия во второй фазе менструального цикла была более 8 мм. Назначался прием фолиевой кислоты для подготовки к беременности в дозе 1 мг в сутки. После проведения данных мероприятий приступали к проведению ИЦТ.
В работе ретроспективно проанализированы данные иммунологического обследования пациенток с ПВ неясного генеза, полученные в течение наблюдения с 2007 по 2014 г. Всего обследованы 152 пациентки с ПВ.
Пациенткам с ПВ с интервалом в один месяц на 5–9-й день менструального цикла подкожно/внутрикожно вводили 50 млн клеток лейкоцитарной фракции партнера в ладонную поверхность предплечья в 10–12 точек. Кровь у женщин для анализа забирали натощак из локтевой вены до назначения лечения и после каждого введения клеток на 18–22-й день менструального цикла (через две недели после каждой процедуры иммунизации). Во время наступившей беременности ИЦТ проводили дважды с интервалом в один месяц в сроках 5–6 недель и 8–9 недель согласно протоколу ведения беременности у пациенток с ПВ [2]. Во время наступившей беременности кровь для анализа забирали на сроке 5–6 (до иммунизации), 8–9 недель (до иммунизации) и 11–12 недель гестации.
АОАТ определяли методом перекрестного реагирования [3]. Для этого мужские лимфоциты инкубировали с женской сывороткой с последующим добавлением флуоресцентно-меченых вторичных антител к Fc-фрагменту иммуноглобулина G человека. Определяли долю покрытых антителами Т-лимфоцитов, которые выявляли с помощью моноклональных антител к CD3. Уровень АОАТ в сыворотке женщины соответствовал доле мужских Т-лимфоцитов, покрытых антителами к Fc-фрагменту иммуноглобулина G, определяемых методом проточной цитометрии на приборе FacsCalibur (Beckton Dickinson, США).
Блокирующий эффект аутологичной сыворотки (БЭ) определяли по ингибированию экспрессии CD69 мононуклеарами периферической крови (МНК) при стимуляции митогеном (фитогемагглютинином) in vitro в течение 72 часов в CO2-инкубаторе методом проточной цитофлуориметрии на цитофлуориметре FACScan (Becton-Dickinson, США). [4].
Статистическую обработку данных производили общепринятыми методами вариационной статистики. Данные представлены как среднее±ошибка среднего.
Соответствие расчетных выборок показателей нормальному распределению оценивали с помощью критерия Колмогорова–Смирнова с использованием пакета Statistica 6.0 для Windows XP. Значимость наблюдаемых отклонений средних значений измеренных параметров оценивали с помощью двухвыборочного t-критерия Стьюдента с различными дисперсиями для средних значений с использованием пакета статистического анализа для Microsoft Office Excel 2007.

Результаты исследования
1. Определение АОАТ.
Появление в сыворотке крови антител к HLA-антигенам лейкоцитов доноров (партнеров), или АОАТ, – один из показателей формирования ответа иммунной системы женщины на введение аллогенных клеток (аллоиммунизацию) [5].
Результаты определения АОАТ в женской сыворотке после неоднократных аллоиммунизаций партнерскими клетками представлены на рис. 1.
Как видно из рис. 1, до назначения лечения уровень АОАТ у женщин с ПВ был низким. Проведение процедуры аллоиммунизации приводит к постепенному значимому повышению уровня АОАТ по сравнению с исходным. Уровень АОАТ, достигнутый после второй процедуры ИЦТ, сохраняется одинаковым после 2, 3 и 4 иммунизаций.
Ранее нами была проанализирована динамика АОАТ у пациенток с ПВ после 2-кратной иммунизации в предгестационной подготовке [6]. Показано, что уровень АОАТ, достигнутый после второй процедуры иммунизации в предгестационной подготовке у женщин с 2-кратной иммунизацией, сохраняется стабильным у забеременевших в дальнейшем женщин на протяжении всего первого триместра. Отличий уровня АОАТ после 2-й иммунизации, которая являлась последней вне беременности, от уровней АОАТ на разных сроках первого триместра не выявлено. Было обнаружено снижение средней интенсивности флуоресценции позитивных клеток (СИФ – показатель, характеризующий количество антител на одной клетке) в сроке 5–6 недель наступившей беременности по сравнению с уровнем после 2-й предгестационной иммунизации. Однако после иммунизации в 5–6 недель СИФ значимо выросла к сроку 8–9 недель, и этот уровень был стабильным до 12 недель гестации. Снижение СИФ можно связать с разными сроками наступления беременности пациенток: интервал ожидания беременности был до одного года.
Также нами выявлено, что сходная динамика и не отличающиеся уровни АОАТ были как у женщин с состоявшимся самопроизвольным выкидышем, так и у женщин с пролонгированной беременностью (табл. 1), но различий в СИФ позитивных клеток в этих группах не обнаружено.
На основании изложенных результатов по анализу АОАТ после 2-кратной и 4-кратной иммунизации можно сделать заключение о достаточности двух процедур аллоиммунизации в предгестационной подготовке женщин с ПВ.
2. Определение БЭ женской сыворотки.
Наличие феномена иммуносупрессии, сопровождающей развитие нормальной беременности, определяется присутствием в сыворотке крови так называемых блокирующих факторов, среди которых есть неспецифические (различные гидролитические ферменты и антиидиотипические антитела, иммунные комплексы, растворимые формы рецепторов к иммунорегуляторным молекулам, в том числе и к цитокинам) и специфические (антитела к антигенам партнера, появляющиеся после проведения процедуры ИЦТ, антитела к антигенам плода отцовского происхождения, появляющиеся во время беременности, а также стероидинициируемые белки беременности) [7, 8].

Предполагается, что с недостаточным образованием в организме будущей матери блокирующих факторов может быть связано формирование различных осложнений гестации, в том числе и самопроизвольное прерывание беременности на ранних сроках [9, 10].
Основное внимание при изучении иммуносупрессии уделялось изучению антител, специфичных к аллоантигенам плода (АОАТ), однако в настоящее время связь между количеством совпадений аллелей генов системы HLA, выработкой АОАТ и повторяющимися спонтанными абортами ставится под сомнение [11, 12]. Поэтому большой интерес приобретает изучение феномена неспецифической иммуносупрессии, которая проявляется в подавлении (блокировании) митогенной активации лимфоцитов матери in vitro в присутствии аутологичной сыворотки. Нами был разработан способ оценки БЭ сыворотки по ее влиянию на экспрессию раннего маркера активации CD69 аутологичными лимфоцитами, стимулированными in vitro митогеном [4].
Особый интерес представляет характеристика изменения супрессивной активности сывороточных растворимых факторов у женщин с ПВ под влиянием аллоиммунизации [13].
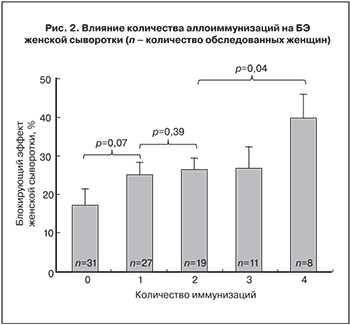
Результаты оценки БЭ женской сыворотки после неоднократных аллоиммунизаций в предгестационной подготовке показаны на рис.2. После первой процедуры выявлена тенденция к увеличению БЭ сыворотки, который затем остается без изменений после 2-й и 3-й процедур и значительно увеличивается после 4-й процедуры.
Нами отмечалось, что в целом БЭ у женщин с ПВ до назначения лечения значимо выше, чем у здоровых фертильных женщин, и в предгестационной подготовке не выявлено его значимых изменений [14].
 Однако при ретроспективном анализе динамика БЭ оказалась разной в группах женщин с разными исходами предгестационной подготовки.
Однако при ретроспективном анализе динамика БЭ оказалась разной в группах женщин с разными исходами предгестационной подготовки.
В группе женщин с наступившей и пролонгированной до доношенного срока беременностью БЭ не отличался от БЭ фертильных женщин до назначения лечения и после проведения предгестационной подготовки [15].
В группе женщин, у которых беременность не наступила в течение двухлетнего периода наблюдения, БЭ до назначения лечения был выше, чем у фертильных женщин, а после проведенной предгестационной аллоиммунизации произошло его дальнейшее увеличение (табл. 2).
Нами было показано, что у женщин с беременностью, пролонгированной до доношенного срока после 2 процедур в предгестационной подготовке и 2 про-цедур в течение первого триместра, БЭ сыворотки до назначения аллоиммунизации вне беременности не отличался от БЭ сыворотки контрольной группы фертильных женщин, становился меньше после 1-й процедуры иммунизации, возвращался к исходным значениям после 2-й процедуры и оставался стабильным в первом триместре гестации [15]. У женщин с состоявшимся выкидышем в первом триместре наступившей беременности был отмечен низкий БЭ [15].
Обсуждение результатов
Идиопатический привычный выкидыш – акушерское осложнение предположительно иммунного генеза. Рассматривались различные гипотезы нарушения функционирования иммунной системы, с точки зрения которых пытались найти иммунологические маркеры, коррекция которых могла бы способствовать благополучному течению беременности у пациенток с ПВ. Одна из самых первых гипотез связана с признанием высокой провоспалительной активности иммунной системы беременной c ПВ. Способом снижения провоспалительной активности рассматривалась ИЦТ – введение пациенткам лейкоцитов полового партнера. Истоки данной процедуры лежат в области трансплантологии. Было замечено, что переливание реципиенту крови от донора органа до пересадки существенно улучшает приживление трансплантата. Этот факт позволил предположить, что проведение ИЦТ, вызывая снижение реакции иммунной системы матери на отцовские аллоантигены плода, будет способствовать вынашиванию беременности, поэтому иммуносупрессия считалась целью иммунотерапии. В настоящее время постулируется физиологическая необходимость провоспалительного состояния иммунной системы матери при имплантации и плацентации [16, 17]. Проведенными нами исследованиями БЭ аутологичной женской сыворотки показано, что нет необходимости добиваться его высокого уровня при планировании беременности. Оптимальный уровень БЭ, не отличающийся от уровня фертильных здоровых женщин, является положительным прогностическим фактором наступления и развития беременности на ранних сроках.
С точки зрения гипотезы недостаточности аллогенной стимуляции иммунной системы матери антигенами плода отцовского происхождения, особенно при наличии у супругов совпадающих аллелей генов системы гистосовместимости человека (HLA), процедура иммунизации женщин лимфоцитами полового партнера рассматривается как способ усиления специфического ответа лимфоцитов женщины на аллоантигены партнера [18, 19].
Как уже упоминалось, в настоящее время связь между количеством совпадений аллелей генов системы HLA, выработкой АОАТ и повторяющимися спонтанными абортами ставится под сомнение [11, 12].
Нами показано, что появление после иммунизации АОАТ, специфичных к аллоантигенам плода, регистрируется на максимальном уровне уже после 2-й иммунизации в предгестационной подготовке, который сохраняется на том же уровне в первом триместре у пациенток с беременностью, пролонгированной до доношенного срока. Требуются дальнейшие исследования, чтобы установить, являются ли АОАТ антителами к антигенам НLA-I и/или НLA-II класса; как зависит продукция АОАТ от совпадений по HLA-антигенам I и II класса в супружеской паре, и являются ли АОАТ фактором, влияющим на течение беременности.
Заключение
Проведены исследования состояния иммунной системы пациенток с ПВ в анамнезе после иммунизации женщин клетками лейкоцитарной фракции половых партнеров, проводимой в процессе предгестационной подготовки и в первом триместре наступившей беременности.
Показано, что у женщин с беременностью, пролонгированной до доношенного срока после 2 процедур аллоиммунизации в программе предгестационной подготовки, уровень АОАТ, достигнутый после 2-й процедуры предгестационной иммунизации, сохраняется стабильным до конца первого триместра беременности.
Установлено, что уровень БЭ аутологичной женской сыворотки, определяемый по ингибированию экспрессии раннего активационного маркера CD69 на поверхности митоген-активированных лимфоцитов in vitro, не отличался от уровня женщин группы контроля до аллоиммунизации, после второй процедуры иммунизации до беременности и в целом в первом триместре наступившей беременности.
На основании анализа выбранных показателей состояния иммунной системы женщин с ПВ в процессе предгестационной подготовки с использованием процедуры ИЦТ можно сделать заключение о достаточности двух процедур аллоиммунизации. Это подтверждают и клинические исходы наступивших беременностей после проведения 2 процедур ИЦТ. Избыточная иммунизация не только не предотвращает неблагоприятные исходы беременностей, но и, возможно, приводит к снижению фертильности, вероятно, за счет избыточной супрессии иммунной системы, которая оценивалась по действию аутологичной сыворотки на митогенную активацию мононуклеаров in vitro. Показано, что как низкий, так и высокий БЭ является неблагоприятным прогностическим фактором развития беременности: при низких показателях отмечены выкидыши в первом триместре, при избыточном – отсутствие наступления беременностей за период наблюдения в течение 2 лет. Также показано, что уровень АОАТ и БЭ, достигнутый после 2-й процедуры предгестационной аллоиммунизации, сохраняется стабильным до конца первого триместра беременности при благоприятном ее исходе.
Полученные результаты исследования позволяют рекомендовать 2-кратную иммунизацию клетками полового партнера (ИЦТ) как необходимую и достаточную процедуру у супружеских пар с ПВ аллоиммунного генеза в программе предгестационной подготовки.



